香螺肽脱色工艺及其抗氧化活性
慢性非传染性疾病,包括心脑血管疾病、肿瘤、糖尿病等,现已成为危害当今人类生命健康的头号杀手之一[1],据世界卫生组织预估,到2030年,由慢性非传染性疾病导致的死亡人数将可能达到5 200万 人[2]。研究发现,慢性非传染性疾病的主要诱因之一为机体产生过多的活性氧簇,无法通过自身代谢排出,长期累积引起氧化应激反应,从而导致疾病的发生[3-4]。因此,补充抗氧化剂可以作为抑制氧化应激反应的一种手段,用于减少慢性非传染性疾病的发生[5-6]。然而由于人工合成的抗氧化剂往往具有一定的毒副作用[7],因此,安全有效的食源性抗氧化剂成为研究和开发的热点[8]。
海洋生物因其生活环境与陆地生物迥异,来源于海洋生物的活性物质往往具有新颖的化学结构、独特的生理功效以及相对较高的安全性,近年来,海洋生物,特别是海洋食源性生物已经成为新型药物、保健食品、功能食品、功能材料以及化妆品的重要资源,而肽类成分作为海洋生物活性物质中研究最多的一类化合物[9-11],具有广泛的研究和开发的潜力。
香螺(Neptunea cumingi)是我国北方沿海主要的经济贝类,属于海洋底栖性大型腹足类,味道鲜美,营养丰富,具有较高的食用价值[12]。目前关于香螺的研究主要集中在系统分布[13]、生殖生态学[14-15]、资源分布[16]等方面,其化学成分的研究则主要围绕营养成分[17-18],关于香螺的活性成分及其生物功能的研究较少,多见香螺凝集素的提取、分离及纯化[19-20],及降血压、抗氧化活性多肽的报道[21-22],鲜见香螺多肽粗提物的脱色工艺及其脱色后生物活性的报道。
本研究采用响应面分析,以脱色率及多肽保留率为综合评价指标,对香螺多肽粗提物在脱色过程中所涉及的脱色剂种类及用量、脱色温度及时间等参数进行优选,确定最佳脱色工艺;采用体外1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除实验及基于斑马鱼的体内抗氧化活性评价模型,探讨脱色后精制的香螺多肽的抗氧化活性,采用高效液相色谱柱前衍生法,分析脱色后香螺多肽的氨基酸组成,以期为香螺多肽为原料的高附加值的产品研发提供参考。
1 材料与方法
1.1 材料与试剂
香螺(产地山东省烟台市) 山东沃恩生物科技有限公司;DPPH(分析纯)、氨基酸混合标准品(分析纯,含有L-丙氨酸、L-精氨酸、L-天冬氨酸、L-胱氨酸、L-谷氨酸、甘氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-蛋氨酸、L-苯丙氨酸、L-脯氨酸、L-丝氨酸、L-苏氨酸、L-酪氨酸、L-缬氨酸) 美国Sigma公司;6-氨基喹啉-N-羟基琥珀酰亚胺氨基甲酸酯(分析纯,6-aminoquinolyl-N-hydroxysuccinimdyl carbamate,AQC) 源叶生物科技有限公司;VC 上海阿拉丁生化科技股份有限公司;活性炭(分析纯) 莱阳市康德化工有限公司;硅藻土(分析纯) 天津市大茂化学试剂厂;活性白(分析纯) 天津市福晨化学试剂厂;所有提取用有机溶剂均为国产分析纯;转基因斑马鱼(krt4-NTR:GFPcy17)由山东省科学院生物研究所繁育。
1.2 仪器与设备
LE204E分析天平 瑞士梅特勒-托利多仪器有限 公司;KQ 2200DV型数控超声波清洗器 昆山市超声仪器有限公司;DS-200高速组织捣碎机 江苏江阴科研器械厂;CS601超级恒温水浴锅 上海博迅实业有限 公司;TOL-5-A台式离心机 上海安享科学仪器厂 制造;TU1901双光束紫外分光光度计 北京普析通用仪器有限公司;HITACHI D-2000 Elite型高效液相色谱系统(配有L-2400型紫外检测器和L2130色谱工作站) 日本日立公司;SZX16体式荧光显微镜 日本Olympus公司;DNP-9082恒温培养箱 上海精宏实验设备有限公司。
1.3 方法
1.3.1 香螺粗多肽提取
基于课题组已建立的酸醇浸提法[21],制备香螺粗多肽,即取香螺组织,磨碎、匀浆,加入10 倍量的酸性稀乙醇溶液(冰醋酸调整溶液pH值至5),室温搅拌提取3 h,离心,取上层清液,减压浓缩至无醇味,浓缩液冷冻保存,即得。
1.3.2 香螺多肽保留率的测定
采用福林-酚法,测定香螺样品脱色前后总多肽含量,按式(1)计算样品多肽保留率[23]:

式中:A1为脱色前样品中多肽含量/mg;A2为脱色后样品中多肽含量/mg。
1.3.3 香螺多肽脱色率的测定
采用紫外-可见分光光度法,确定香螺多肽的最大吸光度波长为410 nm,以最大波长为脱色率检测波长[24],按式(2)计算脱色率:
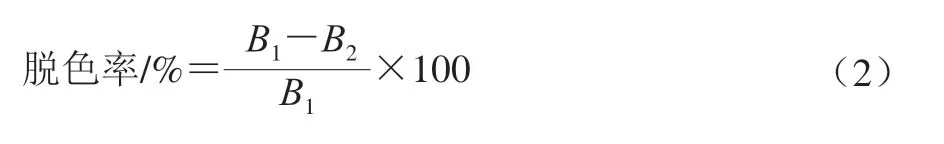
式中:B1为脱色前样品吸光度;B2为脱色后样品吸光度。
1.3.4 香螺粗多肽脱色工艺参数的单因素考察
以多肽保留率及脱色率为考察指标,采用超声波处理方法,分别对脱色剂种类、脱色剂用量、脱色温度、脱色时间及溶液pH值进行单因素考察,确定脱色工艺的主要影响因素和水平。
1.3.5 响应面分析优化香螺粗多肽脱色工艺
以多肽保留率及脱色率为响应值,在单因素考察的基础上,确定脱色工艺的主要影响因素和水平,采用Design-Expert V8.0.6软件,进行3因素3水平的 Box-Behnken试验设计[25],并对结果进行统计分析。试验设计因素与水平如表1所示。
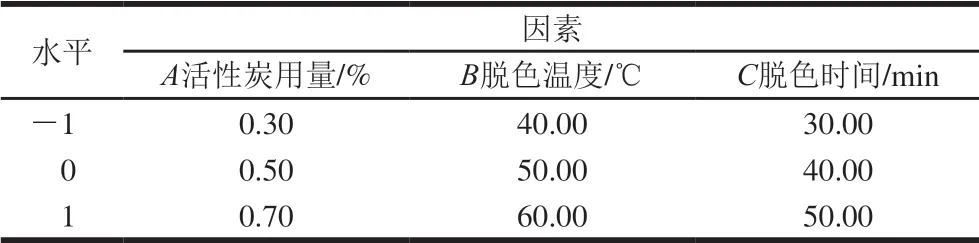
表 1 Box-Behnken试验因素与水平Table 1 Factors and levels used in Box-Behnken design
1.3.6 多肽氨基酸组成的测定
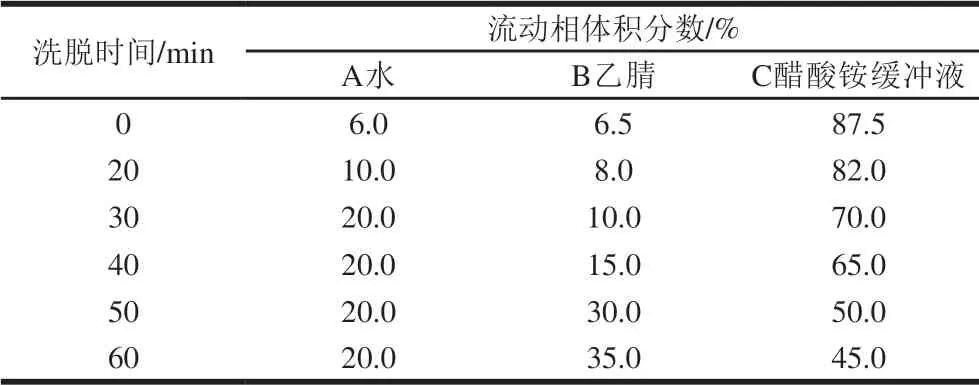
表 2 梯度洗脱条件Table 2 Gradient elution conditions
脱色后香螺多肽提取物经12 mol/L盐酸于105 ℃条件下,密封水解24 h,水解液回收至干,水洗至中性,减压浓缩后过0.45 μm滤膜,采用AQC柱前衍生法,测定氨基酸组成[22,26]。色谱条件为YMC C18色谱柱(4.6 mm×250 mm,5 μm),流动相A为水,B为乙腈,C为醋酸铵缓冲液(10 mmol/L,pH 5.10),梯度洗脱条件见表2,检测波长260 nm,进样量10 μL,流速0.8 mL/min,柱温室温。
1.3.7 DPPH自由基清除率的测定
以VC为阳性对照,分别配制质量浓度为1、10、100、200、500、1 000和2 000 μg/mL的脱色后香螺多肽溶液和VC溶液,采用Lee等[27]的方法,计算各样品的DPPH自由基清除率,绘制质量浓度-清除率曲线,计算清除率为50%时样品的质量浓度(EC50),测定香螺多肽和VC的DPPH自由基清除能力。
1.3.8 体内抗氧化活性的测定
以角质细胞标记荧光蛋白的转基因斑马鱼krt4-NTR:GFPcy17为模式动物,采用甲硝唑诱导氧化损伤模型,以VC为阳性对照(质量浓度为20 μg/mL),根据张轩铭等[28]的方法,测定高(200 μg/mL)、中 (100 μg/mL)、低(50 μg/mL)3 个质量浓度的香螺多肽的体内抗氧化活性,按式(3)计算多肽的相对抗氧化能力:
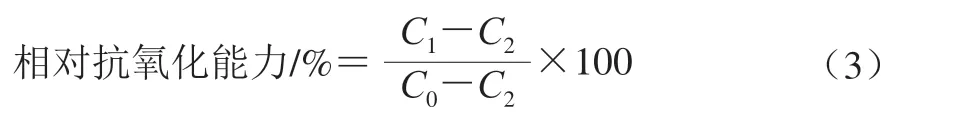
式中:C0为空白组荧光细胞数量;C1为给药组荧光细胞数量;C2为甲硝唑诱导模型组荧光细胞数量。
1.4 数据处理
综合考虑多肽保留率和脱色率对香螺多肽脱色工艺的贡献率,确定指标权重系数各为0.5,采用各指标的最高值作为参考,进行数据归一化处理[29],制定综合评价计算方法,按式(4)计算。所有实验均重复3 次,实验结果用±s表示。采用SPSS 16.0进行数据统计分析, P<0.05,差异显著。采用Origin 9.0软件作图。

2 结果与分析
2.1 脱色工艺的单因素考察结果
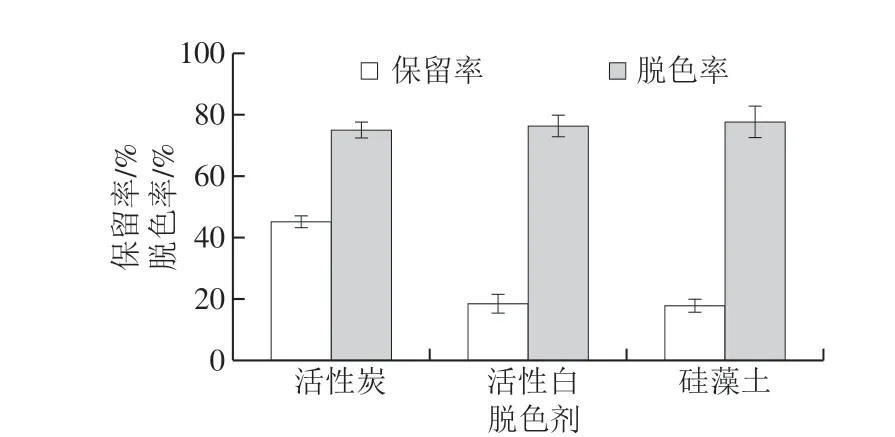
图 1 脱色剂种类对脱色工艺的影响Fig. 1 Effect of different decolorizing agents on the decolorization efficiency of peptides from N. cumingi
2.1.1 脱色剂种类对脱色工艺的影响
在脱色剂用量1%、脱色温度40 ℃、pH 7.4、超声脱色40 min条件下,测定脱色剂为活性炭、活性白及硅藻土时,对香螺多肽的保留率及脱色率的影响。如图1所示,不同种类脱色剂对香螺多肽的保留率影响较大,但其脱色效果相差不大。采用活性炭脱色,香螺多肽损失相对较少。因此,选择活性炭作为脱色工艺进一步优选的脱色剂。
2.1.2 脱色剂用量对脱色工艺的影响
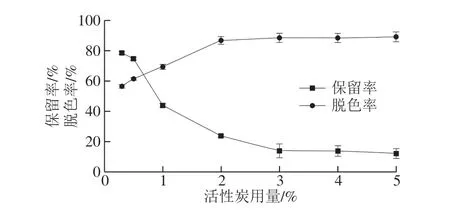
图 2 脱色剂用量对脱色工艺的影响Fig. 2 Effect of decolorizing agent amount on the decolorization efficiency of peptides from N. cumingi
在脱色剂为活性炭、脱色温度40 ℃、pH 7.4、超声脱色40 min条件下,分别考察脱色剂用量为0.25%、0.5%、1%、2%、3%、4%和5%时,香螺多肽的保留率及脱色率的变化。如图2所示,随着脱色剂用量的逐渐增多,多肽的保留率逐渐降低,脱色率逐渐增大,且当脱色剂用量为2%时,脱色率基本不再变化。因此,综合保留率及脱色率结果,脱色剂最佳用量确定为0.5%。
2.1.3 脱色温度对脱色工艺的影响
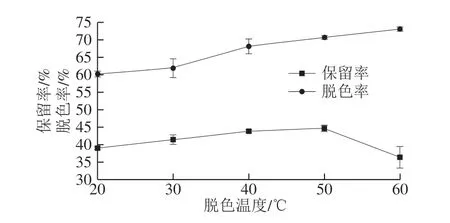
图 3 脱色温度对脱色工艺的影响Fig. 3 Effect of temperature on the decolorization efficiency of peptides from N. cumingi
在脱色剂为活性炭、脱色剂用量1%、pH 7.4、超声脱色40 min条件下,分别考察脱色温度为20、30、40、50 ℃和60 ℃时,香螺多肽的保留率及脱色率的变化。如图3所示,温度越高活性炭脱色效果越好。而活性炭对多肽的吸附效果则处于一种变化状态,在一定温度范围内,温度升高有利于多肽从活性炭中脱附出来,但当温度超过50 ℃时,保留率明显降低,可能原因是高温可使多肽降解变性。因此,综合保留率及脱色率结果,脱色的最佳温度确定为50 ℃。
2.1.4 脱色时间对脱色工艺的影响
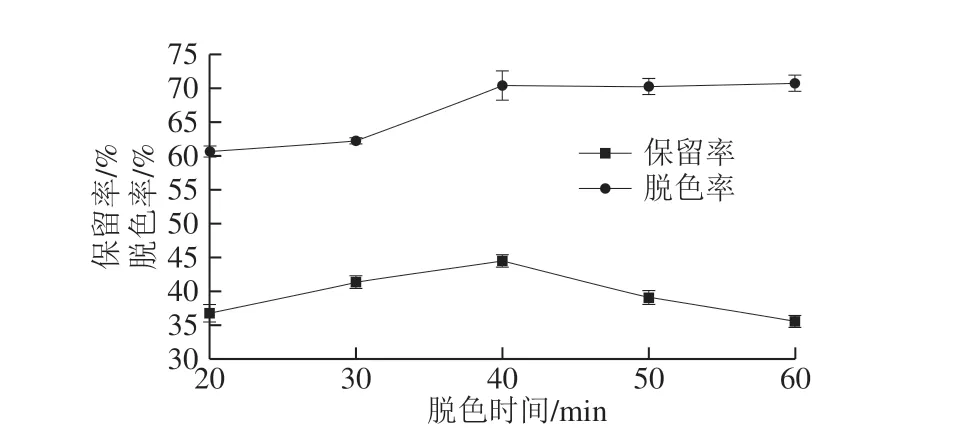
图 4 脱色时间对脱色工艺的影响Fig. 4 Effect of decolorization time on the decoloriation efficiency of peptides from N. cumingi
在脱色剂为活性炭、脱色剂用量1%、脱色温度40 ℃、pH 7.4条件下,分别考察脱色时间20、30、40、50 min和60 min时,香螺多肽的保留率及脱色率的变化。如图4所示,活性炭脱色率与脱色时间呈正相关,在一定时间范围内,多肽保留率随着时间的延长而增大,但超过40 min后,多肽保留率明显降低,表明超声处理在一定程度上可以促进多肽从活性炭上脱吸附。因此,综合保留率及脱色率结果,脱色的最佳时间确定为40 min。
2.1.5 脱色体系pH值对脱色工艺的影响
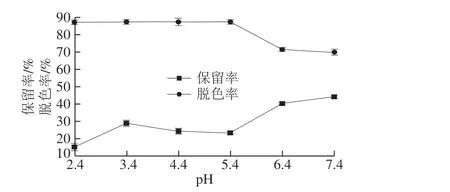
图 5 脱色体系pH值对脱色工艺的影响Fig. 5 Effect of pH on the decolorization efficiency of peptides from N. cumingi
在脱色剂为活性炭、脱色剂用量1%、脱色温度40 ℃、超声脱色40 min条件下,分别用稀盐酸及稀氢氧化钠溶液调整反应体系pH值,比较反应体系pH值分别为2.4、3.4、4.4、5.4、6.4和7.4时对香螺多肽脱色效果的影响。如图5所示,酸性条件有利于活性炭对色素的吸附,当pH值大于5.5后,脱色率明显降低,但反应体系处于酸性环境,不利于多肽成分的保留,因此,综合保留率及脱色率结果,确定反应体系的最佳pH值为7.4。
2.2 响应面试验结果
响应面试验设计与结果如表3所示,得各因素与综合评价指标回归方程为:Y=85.88-7.13A-2.89B+2.02C-1.06AB-2.72AC+3.42BC-12.25A2-1.72B2-1.24C2。二次多项式模型R2为0.988 1,校正系数R2Adj为0.972 7,表明回归模型拟合良好。由表4可知,模型具有极显著差异(P<0.01),失拟项无显著性差异(P>0.05), 表明模型正确。3 个因素对成分保留率及脱色率都有极显著影响(P<0.01),影响效果从小到大依次为脱色时间<脱色温度<活性炭用量,且活性炭用量与脱色时间的交互作用以及脱色温度与脱色时间的交互作用对脱色效率也具有极显著差异(P<0.01)。如图6所示,活性炭用量和脱色温度对香螺多肽脱色工艺综合评分的交互作用较弱;脱色温度和脱色时间对综合评分的交互作用较强;活性炭用量和脱色时间对综合评分的交互作用较强。优选的最佳脱色工艺为活性炭用量0.42%、脱色温度52.79 ℃、脱色时间50.00 min,预测综合评分为88.78%。根据实际操作的可行性,确定最佳工艺为活性炭用量0.42%,脱色温度52 ℃、脱色时间50 min、反应体系pH 7.4。按上述提取条件进行3 次验证实验,样品的成分保留率为(67.63±0.80)%,脱色率为(68.70±0.54)%,综合评分为(86.47±0.26)%,与预测值相对标准偏差为1.85%,表明该模型准确度良好,所优选的工艺稳定可行。
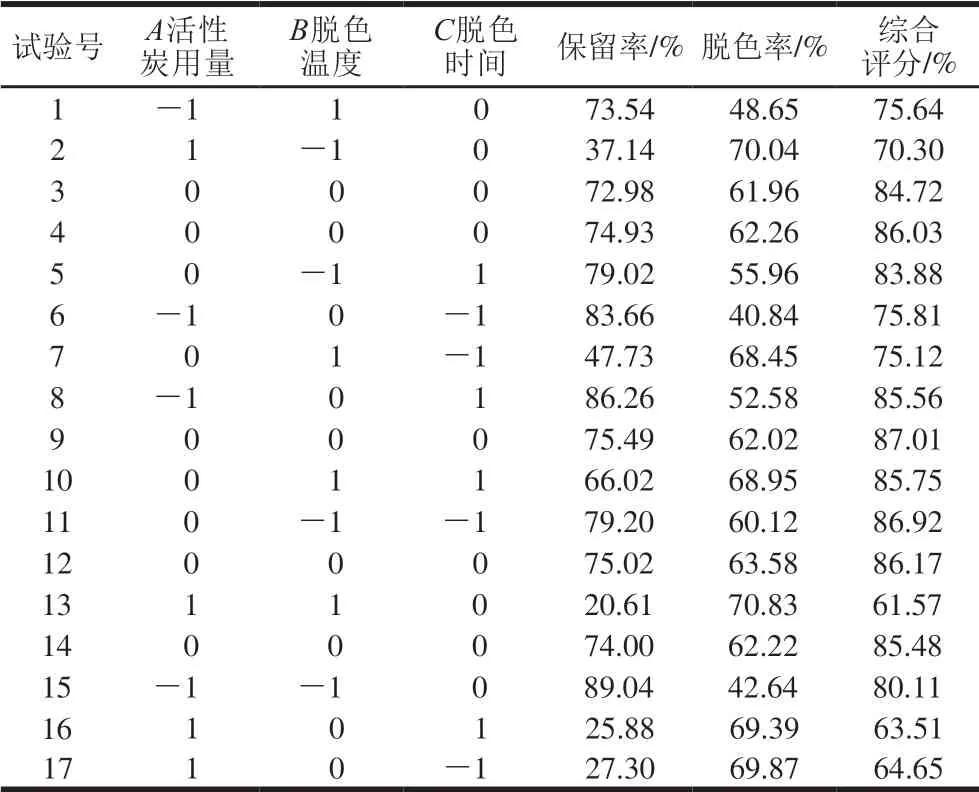
表 3 响应面试验设计与结果Table 3 Program and experimental results of Box-Behnken design
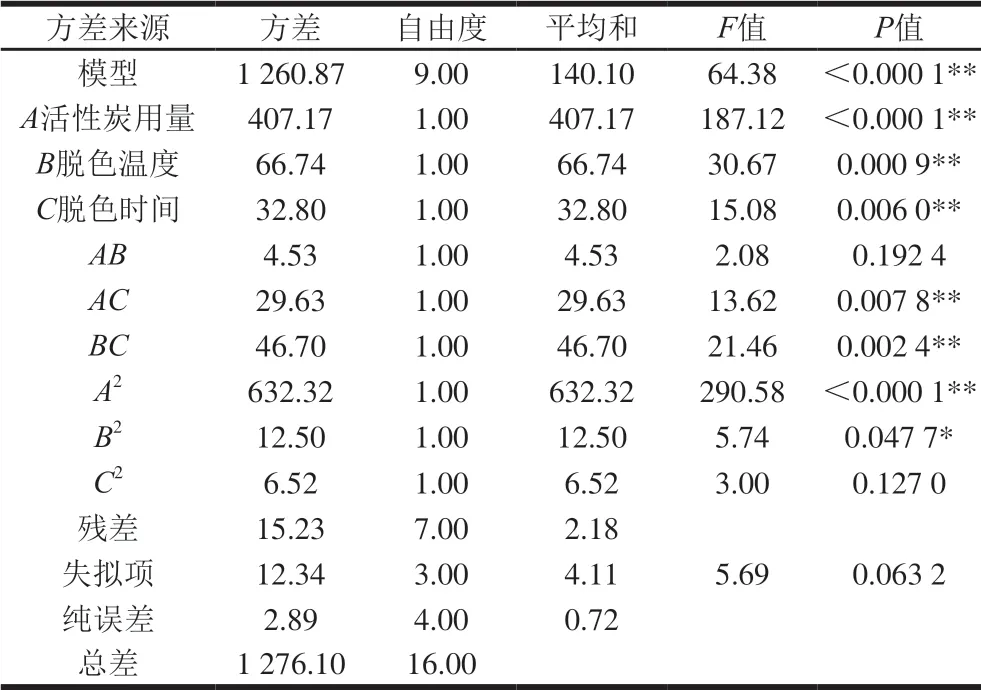
表 4 模型方差分析结果Table 4 Analysis of variance of quadratic polynomial regression model
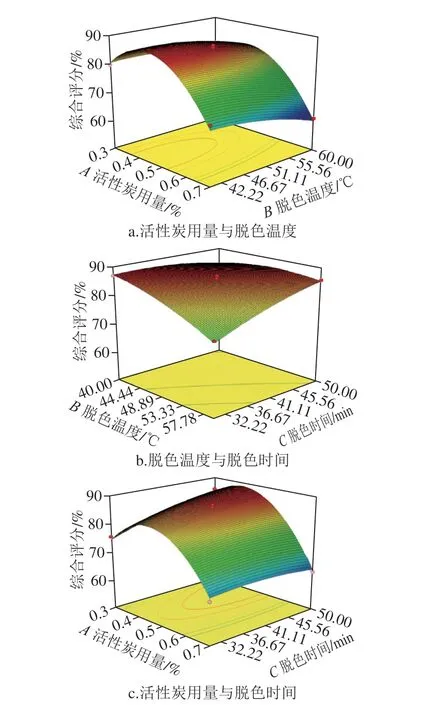
图 6 各因素交互作用对香螺多肽脱色工艺的综合评分影响的响应面图Fig. 6 Response surface plots showing the interactive effects of various factors on comprehensive evaluation
2.3 香螺多肽的氨基酸组成
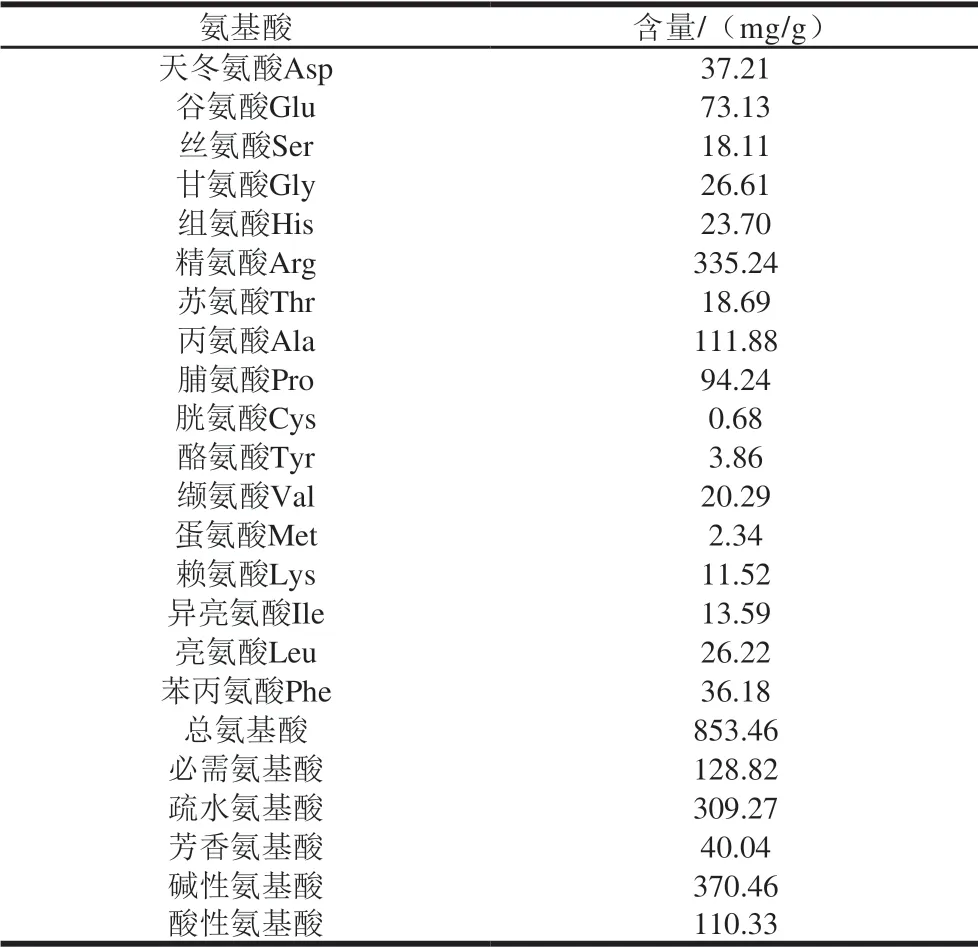
表 5 香螺多肽氨基酸组成及其含量Table 5 Amino acid composition of peptides from N. cumingi
如表5所示,脱色后香螺多肽的总氨基酸含量为853.46 mg/g,共检出17 种氨基酸,由于样品前处理需经酸水解,而色氨酸在酸性环境结构不稳定[30],因此样品中未检出色氨酸。其中,精氨酸、丙氨酸和脯氨酸为香螺中含量最高的3 种氨基酸,占其氨基酸总量的63.43%。香螺多肽中的碱性氨基酸及疏水性氨基酸的比例也相对较高,均超过35%以上。
2.4 香螺多肽体外DPPH自由基清除活性评价结果
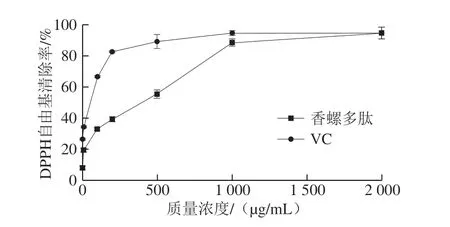
图 7 香螺多肽DPPH自由基清除能力Fig. 7 DPPH radical scavenging activity of peptides from N. cumingi
如图7所示,在样品及VC的供试质量浓度范围内,香螺多肽的清除DPPH自由基EC50值为170.041 μg/mL,阳性对照VC的清除DPPH自由基EC50值为15.569 μg/mL。虽然与VC相比,在1~1 000 μg/mL质量浓度范围内,香螺多肽的DPPH自由基清除能力相对较弱,但香螺多肽的DPPH自由基清除能力与其质量浓度呈现明显的剂量依赖性,随着样品质量浓度越高,DPPH自由基清除能力明显增强,当样品质量浓度大于1 000 μg/mL时,其DPPH自由基清除能力趋于稳定,1 000 μg/mL的香螺多肽可达到与500 μg/mL的VC相似的清除效果,当样品质量浓度达到2 000 μg/mL时,其DPPH自由基清除能力与质量浓度为2 000 μg/mL的VC相当。
2.5 香螺多肽体内抗氧化活性评价结果
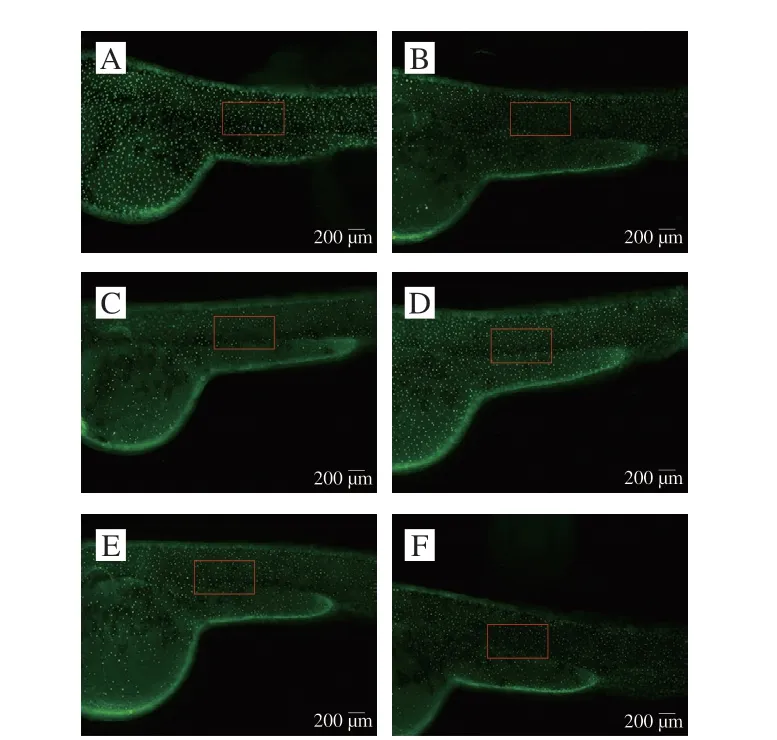
图 8 香螺多肽体内抗氧化活性评价结果Fig. 8 Antioxidant activity in vivo of peptides from N. cumingi
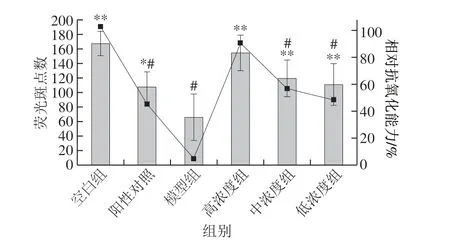
图 9 样品的体内抗氧化活性统计结果Fig. 9 Statistical results of in vivo antioxidant activity of peptides
虽然DPPH为一种经典的抗氧化及筛选模型,但因生物体内不存在DPPH自由基,其结果的准确性仍需要生物实验进一步验证。常见的体内抗氧化活性评价模型包括大鼠、小鼠等,但具有实验周期长、成本高的确定,而斑马鱼作为一种新型的模式生物,具有多种独特的优势,如实验周期短、样品用量少、成本低、可实现活性物质的快速高通量筛选,近年来,已被广泛应用于天然药物活性成分的筛选[31]。本研究基于斑马鱼皮肤荧光氧化损伤模型,探讨香螺多肽的体内抗氧化活性。如图8所示,斑马鱼经甲硝唑处理后,机体出现氧化应激状态,导致其皮肤角质细胞发生损伤,细胞凋亡[32],从而使斑马鱼荧光斑点数量显著减少(图8C),加入抗氧化剂后,可减少角质细胞损伤的发生率,避免荧光斑点数的过度减少(图8B、D~F),药物抗氧化活性越强,其皮肤荧光斑点数越接近正常组(图8A)。由图9可知,香螺多肽的相对抗氧化能力与其给药质量浓度呈现明显的计量依赖性,随着药物质量浓度升高,其抗氧化能力明显增高,当质量浓度在50~100 μg/mL范围内,香螺多肽的抗氧化能力与20 μg/mL的VC相当(P>0.05),当香螺多肽质量浓度达到200 μg/mL时,其荧光斑点数接近于未用甲硝唑处理的正常组(P>0.05)。在实验质量浓度范围内,斑马鱼幼鱼形态未见任何畸形及死亡。实验结果表明,香螺多肽具有较好的抗氧化能力,可以抑制由甲硝唑导致的角质细胞凋亡。与体外DPPH自由基清除实验结果相比,香螺多肽在基于斑马鱼模式生物的体内抗氧化活性评价中,表现出相对更强的抗氧化能力,产生此结果的原因可能为,脱色后的香螺多肽药液,经斑马鱼皮肤渗透吸收后,分布于斑马鱼幼鱼的机体中,随后香螺多肽在消化系统中经过代谢,发生降解,生成抗氧化活性更强的次级代谢产物,从而表现出更强的抗氧化活性,另一方面,生物体内的氧化应激是一种复杂状态,与氧化应激相关的自由基种类多样,因此,香螺多肽可能是可同时作用于多种由氧化应激所产生的活性氧自由基,表现出较强的体内抗氧化活性。本实验结果表明,香螺多肽具有潜在的抗氧化功能,其作用机制仍需要进一步研究。
3 结 论
香螺多肽脱色工艺为活性炭用量0.42%、脱色温度52 ℃、脱色时间50 min、反应体系pH值为7.4。香螺多肽的成分保留率为(67.63±0.80)%,脱色率为(68.70±0.54)%。香螺多肽总氨基酸含量为853.46 mg/g,碱性氨基酸及酸性氨基酸总量占比约为80%,且精氨酸、丙氨酸、脯氨酸含量高。香螺多肽对DPPH自由基清除活性的EC50值为170.041 μg/mL,抗氧化活性较强,在200 μg/mL质量浓度下可抑制斑马鱼氧化损伤,香螺多肽的抗氧化活性可能与其高比例的疏水性氨基酸及碱性氨基酸有关[33]。

