枫香拟茎点霉B3生物转化花生废弃物 合成白藜芦醇
刘连红,陈 飞,管永祥,仇美华,张 丽,戴传超,
(1.南京师范大学生命科学学院,江苏省微生物与功能基因组学重点实验室,江苏省微生物资源产业化工程技术研究中心, 江苏 南京 210023;2.江苏省农业技术推广总站,江苏 南京 210008;3.江苏省耕地质量保护与环境监测站,江苏 南京 210008)
白藜芦醇是一种多酚类化合物,存在于虎杖、花生、葡萄、桑葚等植物中[1]。白藜芦醇也被认为是一种植物抗毒素,在植物受到生物或非生物胁迫时产生[2]。近年来,白藜芦醇在医药及保健食品方面的应用发展引起了人们的极大兴趣。研究发现白藜芦醇具有抗肿瘤、抗动脉粥样硬化、抗菌消炎、调节油脂代谢、保护心脏血管等功能[3-4],被誉为继紫杉醇之后的又一新的绿色抗癌药物[5]。目前,获取白藜芦醇的主要途径之一是采用有机溶剂从虎杖中提取[6],但该法提取率低且受到虎杖植物资源的限制。近几年利用转基因微生物生产白藜芦醇是另一种被广泛研究的方法[7],但在该体系中诱导白藜芦醇的合成不仅时限较长而且成本较高。
花生是含有白藜芦醇的最重要的可食用植物之一,国内外有关于花生中白藜芦醇的大量研究[8-9]。据报道,花生中含有许多对健康有益的天然活性化合物,如芪类、黄酮类、酚酸类和植物固醇类等[10-12]。目前世界花生消费一是油用,二是食用[13]。长期以来,人们仅重视花生仁的利用,而忽视花生壳、红衣、根茎叶等利用。花生植株除了胚、上胚轴、根尖和黏液外其他各部位均含有白藜芦醇[14],它主要通过苯丙氨酸代谢途径合成。花生体内可合成白藜芦醇,植株中必然有其前体物质的大量存在,比如对香豆酸。另外,植物中白藜芦醇一般与糖结合以白藜芦醇苷的形式存在,近几年,研究表明微生物可以通过分泌β-葡萄糖苷酶(β-glucosidase,GLU)转化苷元合成白藜芦醇[15-16]。因此,结合微生物转化法探索出一条高效、绿色的生产路径,即将花生废弃物中的前体物质转化为白藜芦醇,在之后的回收过程中,将不仅回收花生废弃物已经存在的一部分产品,还能额外增加一部分生物转化而来的白藜芦醇。
内生真菌是指生长于植物组织细胞间、宿主不表现出感染症状的一类真菌[17]。前期研究发现,接种内生真菌枫香拟茎点霉(Phomopsis liquidambari)B3可加速花生残茬秸秆的腐解和缓解花生连作障碍[18-20]。近期全基因测序结果表明枫香拟茎点霉B3含有白藜芦醇合成途径中关键酶GLU、4-香豆酸辅酶A连接酶(4-coumarate CoA ligase,4CL)和白藜芦醇合酶(stilbene synthase,STS)的基因。因此,本研究首先通过代谢物检测和关键基因的定量实验探究枫香拟茎点霉B3利用花生废弃物合成白藜芦醇的初步机理。在此基础上,利用单因素试验和响应面法对其发酵条件进行优化使白藜芦醇含量最大化,以期为花生废弃物中白藜芦醇的开发和利用提供参考价值。
1 材料与方法
1.1 材料与试剂
花生(Archis hypogaea)采用江西省鹰潭市常规品种赣花5号。
花生废弃物:2016年9月收获赣花5号花生,将花生秸秆和花生壳样品清洗晾干,用小型高速粉碎机粉碎,即得到花生废弃物粉末,过60 目筛备用。
内生真菌枫香拟茎点霉B3分离自大戟科植物重阳木(Bischofia polycarpam)茎内皮,保存于南京师范大学生命科学学院微生物资源与生态实验室,马铃薯葡萄糖固体斜面4 ℃保藏。
白藜芦醇、白藜芦醇苷和对香豆酸等标准品 美国Sigma-Aldrich公司;甲醇(色谱级)和其他分析纯试剂 中国江苏汉邦科技有限公司。
1.2 仪器与设备
1100型高效液相色谱仪、1290 Infinity LC/6460 QQQ MS型液相色谱-质谱联用仪 美国安捷伦有限公司;实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,real-time PCR)仪 美国Applied Biosystems公司;5 L小型发酵罐及其配件(溶解氧电极、pH电极及空气过滤膜等配件) 上海联环生物工程设备有限公司;6202小型高速粉碎机 北京环亚天元机械技术有限公司。
1.3 方法
1.3.1 发酵培养基及发酵工艺
种子液培养基:将枫香拟茎点霉B3从马铃薯葡萄糖固体斜面培养基转接至马铃薯葡萄糖液体(potato dextrose broth,PDB)培养基,28 ℃、180 r/min培养36 h用作种子液。
发酵培养基配方:马铃薯浸提液200 g/L,葡萄糖20 g/L,花生废弃物(花生秸秆-花生壳5∶1,记作PS)50 g/L,pH 7.0,培养基经121 ℃高压灭菌20 min。
为探究接种枫香拟茎点霉B3对发酵培养基中白藜芦醇含量的影响,设置2 个处理:未接种B3的发酵培养基(CK)和接种B3的发酵培养基(B3)。发酵工艺:将B3种子液接种到发酵培养基中,以培养基初始pH 7.0、料液比1∶20(g/mL)、接种量5%(生物量(3.40±0.28)g/L)、发酵温度28 ℃、发酵转速 150 r/min为初始条件,避光振荡培养。收集样品放置于-80 ℃过夜,使用冷冻干燥机运行24 h冻干后添加30 mL甲醇超声辅助(100 Hz,45 ℃,30 min)提取,4 500 r/min离心15 min收集上清液,65 ℃旋蒸至干,最后用1 mL甲醇溶解备用。
1.3.2 生物转化单因素试验
按照1.3.1节发酵条件,以发酵培养基中白藜芦醇含量为测定指标,进一步考察料液比(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL))、培养基初始pH值(4.0、5.0、6.0、7.0、8.0、9.0)、接种量(1%、3%、5%、7%、9%、11%)、发酵温度(20、24、28、32、36、40 ℃)和发酵转速(90、120、150、180、210、240 r/min)对白藜芦醇含量的影响。
1.3.3 响应面试验优化
根据单因素试验结果,固定料液比1∶30(g/mL),以培养基初始pH值、接种量、发酵温度和发酵转速为试验因素,以白藜芦醇增量为响应值,设计4因素3水平试验,因素与水平设计见表1。
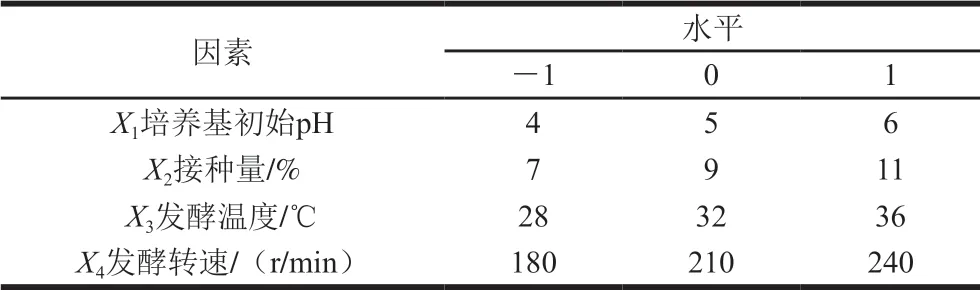
表 1 响应面试验因素与水平Table 1 Coded levels and corresponding actual levels of independent variables used for response surface methodology
1.3.4 发酵罐放大实验
选取5 L发酵罐进行中试放大实验,其中发酵条件按照响应面最终优化条件设置培养基初始pH值、接种量、发酵温度和发酵转速,其余条件按照实际条件如通气量1.5~3 m3/min和压力0.7 kg/cm2培养48 h后放罐。
1.3.5 分析方法
1.3.5.1 花生废弃物中物质的鉴定
质谱条件:安捷伦C18色谱柱(250 mm×4.6 mm,5 μm),流动相使用甲醇(A泵)和0.2%冰醋酸(B泵)进行梯度洗脱;梯度洗脱:0~20 min,甲醇体积分数从5%上升到 50%;20~40 min,甲醇体积分数升到80%;40~80 min,甲醇体积分数升到100%;紫外吸收波长280 nm;流速0.2 mL/min;柱温30 ℃;进样量20 μL。
1.3.5.2 白藜芦醇含量的测定[21]
色谱条件:安捷伦C18色谱柱(250 mm×4.6 mm,5 μm),紫外吸收波长为306 nm;柱温30 ℃;流动相为乙腈-超纯水(30∶70,V/V),流速为1 mL/min;进样量为20 μL。
1.3.5.3 总糖和GLU活性的检测
总糖测定采用蒽酮-硫酸比色法[22];GLU活性测定参考Kuo等[23]方法。
1.3.5.4 关键酶基因表达的检测
为确定合成过程中GLU、4CL和STS基因的转录水平,本实验设置了2 个处理组:在添加花生废弃物的PDB中接种B3(PDB+PS+B3)和未添加花生废弃物的PDB中接种B3(PDB+B3)。在每个取样点收集大约0.1 g真菌菌丝(湿质量),并用蒸馏水洗涤。研磨真菌菌丝并用TRIZOL试剂(Invitrogen,Carlsbad,CA)取总RNA[24]。使用EasyScript RT试剂盒(TransGen Biotech)将提取的总RNA合成cDNA。使用real-time PCR仪StepOne系统(Applied Biosystems)进行real-time PCR。反应混合液(20 μL)包括10 μL SYBR Green探针(AceQ qPCR SYBR Green Master Mix (High ROX Premixe),Vazyme)、2 μL cDNA模板和上下游引物各0.4 μL。基于B3中GLU、4CL和STS基因的部分或全长mRNA序列分别设计了特异性引物对(GLU-F-q/GLU-R-q、4CL-F-q/4CL-R-q 和STS-F-q/STS-R-q),以B3的β-actin基因作为表达水平的内参基因,具体引物对见表2。real-time PCR程序:95 ℃预变性5 min;循环反应95 ℃变性10 s,60 ℃退火30 s,40 个循环;融解曲线:95 ℃、15 s,60 ℃、60 s和95 ℃、15 s。使用标准熔解曲线验证扩增的特异性。使用StepOne software(version 2.0,Applied Biosystems)确定荧光通过循环阈值(Ct)的周期数,这个值被用于表达水平的定量。通过2-ΔΔCt方法分析cDNA样品的相对表达水平。每个样品都设置3 次重复。

表 2 实验使用引物Table 2 Sequences of oligonucleotide primers used for real-time PCR in this study
1.4 数据分析
响应面采用Design-Expert V11.0软件,其他数据使用SPSS 16.0和Excel 2016进行分析。所有实验数据表示为每个处理3 个重复的平均值和标准误。数据采用SPSS 16.0软件中的One-way ANOVA进行分析,并用Tukey多重比较不同处理组间的显著性差异(P<0.05,差异显著)。
2 结果与分析
2.1 接种枫香拟茎点霉B3对发酵液中白藜芦醇含量的影响
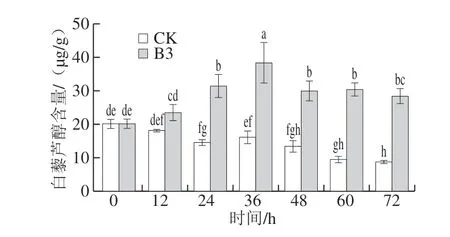
字母不同表示差异显著(P<0.05),下同。
由图1可知,随着发酵时间的延长,CK组中白藜芦醇含量呈持续下降趋势,这是因为白藜芦醇不稳定易受外界环境的影响[25]。而接种B3处理组中白藜芦醇含量呈现先上升后下降的趋势,时间从0 h延长至36 h时,白藜芦醇含量上升至最大值38.34 μg/g,当继续延长时间,白藜芦醇含量开始逐渐下降至保持稳定,这说明时间过长菌体会出现老化而影响白藜芦醇合成,且与CK相比,36 h之前接种枫香拟茎点霉B3显著加快白藜芦醇的合成,36 h之后,B3处理组中白藜芦醇含量显著高于CK。因此,总体上看接种B3于36 h可显著提高花生废弃物中白藜芦醇含量。
2.2 花生废弃物中的物质鉴定
为更深入研究枫香拟茎点霉B3对白藜芦醇生物转化的途径,首先需鉴定白藜芦醇合成的前体物质。高效液相色谱-质谱分析结果揭示了花生废弃物中2 种主要前体物质的存在,如对香豆酸和白藜芦醇苷(图2)。因此,推测枫香拟茎点霉B3既可分泌GLU转化白藜芦醇苷生成白藜芦醇,也可分泌4CL和STS利用花生废弃物中的对香豆酸合成白藜芦醇,仍需进一步验证。
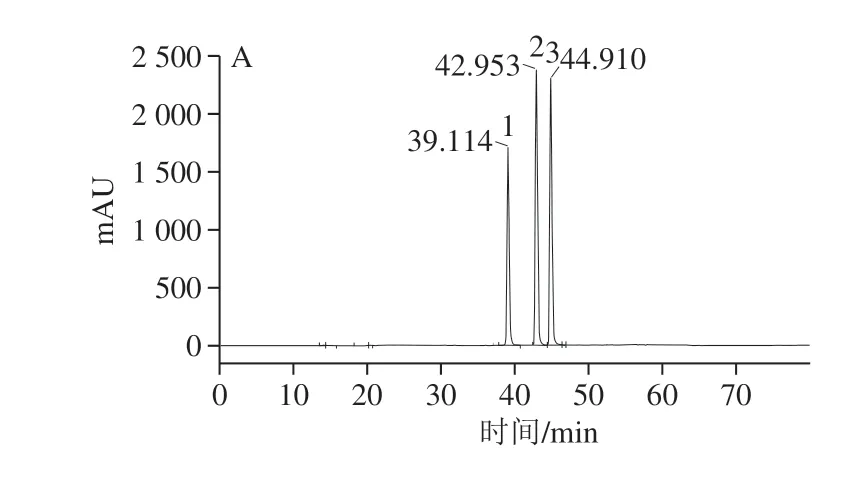
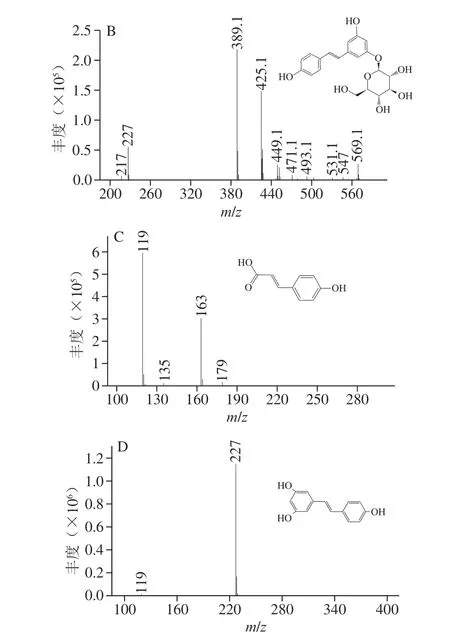
图 2 花生废弃物中白藜芦醇及其相关前体物质的 高效液相色谱-质谱洗脱图Fig. 2 HPLC-MS profiles of resveratrol, luteolin and related precursors in peanut wastes
2.3 发酵液中总糖含量和GLU活性的变化

图 3 发酵液中接种枫香拟茎点霉B3对总糖含量和GLU活性的影响Fig. 3 Evolution of total sugar content and β-glucosidase activity during fermentation of peanut wastes with P. liquidambari B3
为验证接种B3的生长情况和GLU的分泌,每隔12 h检测总糖和GLU活性(图3)。结果显示,PBD+PS+B3 处理组中总糖从12 h之后急剧下降至36 h后保持稳定,而PBD+PS对照组无显著性差异,表明枫香拟茎点霉B3在该时间段有最大生长速率;另外通过对GLU活性的测定,发现24~36 h急剧上升后保持稳定,结果说明:枫香拟茎点霉B3在转化过程中能够分泌GLU,同时GLU活性依赖于B3的生长。
2.4 关键酶基因的表达和推测合成途径

图 4 枫香拟茎点霉B3中GLU(A)、4CL(B)和STS(C)的 相对表达情况Fig. 4 Relative expression levels of GLU (A), 4CL (B) and STS (C) in P. liquidambari B3
为进一步阐明枫香拟茎点霉B3合成白藜芦醇的代谢途径,通过real-time PCR测定不同时间点3 种关键酶基因的转录水平。图4A显示,PDB+B3处理组相对CK(12 h)表达水平无显著性差异,而PDB+PS+B3处理组中GLU基因表达水平呈现先升后降的趋势,总体来说,在36 h时间段内PDB+PS+B3处理组中基因的转录水平上调较高,结合GLU活性,说明B3在36 h内能释放GLU转化白藜芦醇苷合成白藜芦醇。另外,图4B、C显示,在每个时间段下,处理组中4CL和STS基因表达与CK(12 h)相比均成上调趋势,并且在36 h时间段内4CL基因转录水平上调较高,而在24、36 h和48 h内的STS基因转录水平上调均较高,说明在该时间范围内,STS释放量较高,与白藜芦醇含量变化一致,枫香拟茎点霉B3可分泌4CL和STS利用对香豆酸转化合成白藜芦醇。基于以上结果,推测枫香拟茎点霉B3生物转化花生废弃物合成白藜芦醇的途径见图5,但具体途径的转化率尚有待进一步研究。

图 5 枫香拟茎点霉B3生物转化花生废弃物合成白藜芦醇的推测途径Fig. 5 Speculative synthesis pathway of resveratrol from P. liquidambari B3-biotransformed peanut wastes
2.5 单因素试验结果


图 6 料液比(A)、培养基初始pH值(B)、发酵温度(C)、 发酵转速(D)和接种量(E)对白藜芦醇含量的影响Fig. 6 Effects of radio of liquid to solid (A), initial pH of fermentation medium (B), culture temperature (C), rotating speed (D) and inoculum volume (E) on the content of resveratrol
接种枫香拟茎点霉B3可转化花生废弃物合成白藜芦醇,因此,设计单因素试验确定不同发酵条件的影响。图6A表明,不同料液比条件下,CK组中白藜芦醇含量无显著性差异,而B3处理组中白藜芦醇含量均提高到2 倍左右,且在料液比为1∶30时最高,达到38.96 μg/g,这可能是菌株分泌酶量有限导致。从图6B可以看出,在不同pH值条件下,CK组中白藜芦醇含量近乎无显著性差异,而当pH值为中性和碱性时B3处理组中白藜芦醇含量明显低于酸性条件,因为花生中白藜芦醇在酸性条件下较为稳定,而碱性条件下易变性[26]。图6C~E结果表明,发酵温度、发酵转速和接种量对白藜芦醇含量的影响相似,表现为先增加后下降。原因分别为:温度对白藜芦醇含量的影响与菌株的温度适应性有关[27],即与枫香拟茎点霉B3生长的最适温度相同(28 ℃);在本研究采用的发酵条件中,低接种量导致细胞生长缓慢,而过大的接种量可能表现为细胞降解,从而导致一定时期内细胞质量的降低;白藜芦醇含量在较高转速下降可能是由于白藜芦醇不稳定或在氧气存在下产生较低量的白藜芦醇,因为高转速会导致培养过程中的高含氧量[28]。因此综合考虑,在料液比1∶30条件下,选取培养基初始pH 5.0、发酵温度32 ℃、发酵转速210 r/min和接种量9%为响应面优化时自变量的0水平。
2.6 响应面试验结果
2.6.1 响应面试验设计及结果
在各单因素试验结果基础上,以白藜芦醇增量(Y)作为响应值,以培养基pH值(X1)、接种量(X2)、发酵温度(X3)和发酵转速(X4)作为自变量,建立4因素3水平的试验设计。利用Design-Expert设计统计分析软件进行Box-Behnken试验设计,共29 组,所得结果如表3所示。采用Design-Expert V11.0软件对数据进行方差分析,结果见表4。

表 3 响应面试验设计及结果Table 3 Response surface design with experimental results

表 4 回归方程方差分析Table 4 Analysis of variance of regression model
运用Design-Expert软件进行多元回归拟合,得到回归方程如下:Y=-713.67+97.92X1-9.05X2+23.44X3+2.03 X4+1.66X1X2-0.57X1X3+0.04X1X4+0.21X2X3+0.07X2X4+ 0.02X3X4-10.19X12-1.05X22-0.46X32-0.01X42。
从表4可看出,模拟P值小于0.000 1,表示该回归模拟高度显著;失拟项P值为0.119 5,不显著,说明该回归模型预测值与实测值有较好的拟合水平,所选模型适宜。回归系数R2为0.907 3,表明模型较准确,试验误差较小,可以对试验结果进行准确分析和预测。回归方程各项的方差分析表明,二次项X22显著,X3、X12、X32和 X42极显著。F值越大,表明对试验指标的影响越大,结合方差分析表,对白藜芦醇增量影响程度大小顺序为发酵温度、接种量、培养基初始pH值、发酵转速。
2.6.2 响应面分析及验证


图 7 任意两变量对白藜芦醇增量影响的响应面和等高线图Fig. 7 Contour and response surface plots showing the interactive effects of various variables on increasing resveratrol content
等高线的形状不同,交互效应的强弱也不同。交互项的等高线图越近似椭圆形,表明交互作用越强[29]。由图7可以看出,3 组交互作用中,培养基初始pH值与接种量的交互作用最强,其次是接种量与发酵转速的交互作用,而发酵温度和发酵转速的交互作用最弱。
从响应面图可看到拟合曲面有最大值,对拟合方程求偏导,可得出模型最大值,即为最优方案[30]。通过对二次多项式数学模型的解逆矩阵,得出白藜芦醇增量最高的最佳条件为培养基初始pH 5.167、接种量9.097%、发酵温度28.632 ℃、发酵转速203.643 r/min,预测白藜芦醇增量为40.555 μg/g。结合实际操作情况,将发酵条件修正为培养基初始pH 5.2、接种量9%、发酵温度28.6 ℃、发酵转速204 r/min,在此条件下进行3 次实验,计算平均值为39.73 μg/g,该结果与模型预测值基本一致,相对误差为2.024%,说明该模型对试验具有一定的实际指导意义。后续实验为了扩大发酵规模,选取5 L发酵罐进行中试放大实验。从图8可知,随着发酵时间的延长,白藜芦醇含量逐渐增加,到第36小时达到最大值111.78 μg/g,与未接种枫香拟茎点霉B3时相比,白藜芦醇含量提高了1.9 倍。总糖含量逐步下降,说明菌丝要先消耗掉葡萄糖后,才能产生合成酶,从而利用白藜芦醇苷和对香豆酸产生白藜芦醇。pH值呈现先下降后上升的趋势,这可能是因为发酵前期氨基酸等物质不断释放造成酸性条件,直至36 h合成大量白藜芦醇,随后菌体生长能力下降释放胞内一些碱性物质导致pH值逐渐上升。因此36 h为最佳发酵时间。
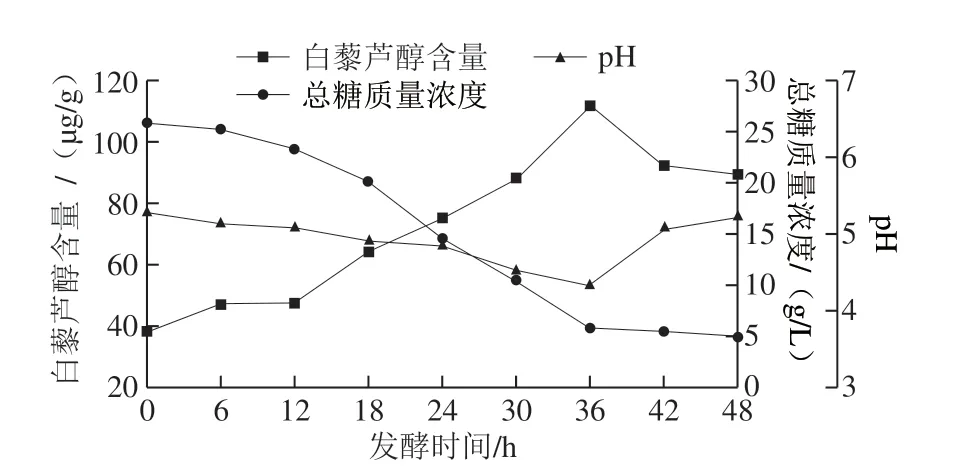
图 8 花生废弃物发酵罐各跟踪指标Fig. 8 Time courses of fermentation of peanut wastes in a 5 L fermentor
3 结 论
本研究表明,内生真菌枫香拟茎点霉B3既可以通过分泌糖苷酶转化花生废弃物中的白藜芦醇苷为白藜芦醇,又可以通过从头合成途径利用花生废弃物中的对香豆酸生产白藜芦醇。其中,两条途径具体途径的转化率尚有待进一步研究。本研究在单因素试验的基础上,对摇瓶试验中内生真菌B3生物转化花生废弃物合成白藜芦醇的发酵条件进行了优化。建立了pH值、接种量、发酵温度和转速对发酵液中白藜芦醇含量的二次回归方程模型,经验证,该数学模型可靠,可以用于发酵液中白藜芦醇含量的预测。结合单因素试验和响应面优化模型的结果来看,在料液比1∶30(g/mL)、培养基初始pH 5.2、接种量9%、发酵温度28.6 ℃、发酵转速204 r/min条件下,发酵液中白藜芦醇含量提高了39.73 μg/g。在此最优条件下,在5 L发酵罐进行中试放大实验,结果显示发酵36 h白藜芦醇含量提高了1.9 倍。因此开发花生废弃物中的白藜芦醇不仅不会造成像虎杖中那样“与药争源”的矛盾,而且对于提高花生的价值将更加有意义。

