酸化速率对大豆蛋白凝胶结构的调控
李倩如,熊 瑶,林嘉诺,叶 倩,缪 松,张龙涛,,郑宝东
(1.福建农林大学食品科学学院,福建 福州 350002;2.中爱国际合作食品物质学与结构设计研究中心,福建 福州 350002;3. Teagasc食品研究中心,爱尔兰 科克 999014)
大豆分离蛋白(soy protein isolate,SPI)作为一种优质的植物蛋白源[1],具有良好的功能特性[2],如凝胶 性[3-6]、溶解性、保水性[7-10]等,因而被广泛应用于食品工业。目前,SPI及其深加工产品遍及食品的各个领域,对其聚集和凝胶特性进行研究,力求对其凝胶过程进行调控也是研究热点。Campbell等[11]通过控制SPI溶液的加热次数,调控SPI聚集体的性质,进一步调控了大豆蛋白凝胶的质构特性。研究表明,大豆蛋白的聚集情况显著影响大豆蛋白的凝胶性质[12]。
葡萄糖酸内酯(glucono-δ-lactone,GDL)诱导的大豆蛋白凝胶的凝固机理为GDL在水溶液中缓慢水解为葡萄糖酸,通过降低体系pH值,使蛋白质分子负电荷集团间静电斥力降低,蛋白分子间不断聚集、成胶。 武肖[13]通过对比不同的加热和冷却速率对大豆蛋白聚集和凝胶特性的影响,发现凝胶点受加热速率调控,而与冷却速率无关,并且,较低加热速率形成的三维网络凝胶结构更加致密。李云[14]研究GDL诱导形成的大豆蛋白凝胶时,也发现慢速加热时凝胶的保水性提高,而快速加热时结果相反。GDL在水中的水解(酸化)速率与温度成正相关,温度越高,GDL酸化速率越快,蛋白分子的聚集和凝胶速率越快[15-16]。
迄今为止,关于酸化速率对大豆蛋白凝胶结构的研究较少。本实验通过改变保温温度,以pH值、浊度为指标,揭示GDL酸化速率的变化,进一步探讨GDL酸化速率对大豆蛋白凝胶的凝胶强度、刚性、保水性和微观结构的影响,对调控大豆蛋白凝胶的形成过程、开发质构各异的大豆蛋白凝胶制品具有重要的理论意义和实际应用价值。
1 材料与方法
1.1 材料与试剂
SPI(>90%蛋白) 山东嘉华保健品股份有限公司; GDL、Rhodamine B 麦克林生化科技有限公司。所有试剂均为分析纯。
1.2 仪器与设备
HH-6型数显恒温水浴锅 常州国华电器有限公司; TA.XT plus质构测试仪 英国Stable Micro System公司; UV-1800紫外-可见分光光度计 日本岛津公司; MCR 301高级旋转流变仪 奥地利安东帕有限公司;pH700型pH计 德信科技有限公司;JB300-D型搅拌器 上海标本模型厂;Allegra X-30R离心机 美国贝克曼有限公司;BSA224S电子天平、BSA2202S电子天平 赛多利斯科学仪器(北京)有限公司;TCS SP8X DLS激光共聚焦显微镜 Leica生物系统公司。
1.3 方法
1.3.1 GDL诱导的SPI凝胶的制备
将蛋白样品取出添加去离子水配制60 g/L的SPI溶液,搅拌器搅拌2 h至完全溶解后,在4 ℃水化12 h,贮藏于4 ℃备用。将SPI溶液在95 ℃水浴60 min至完全变性,加入GDL溶液至最终溶液中的SPI质量浓度为50 g/L,凝固剂质量浓度为5 g/L,SPI混合液放置于30、40、50、60、70、80、90 ℃条件下保温30 min后自然冷却成型,在4 ℃放置24 h,待测。
1.3.2 酸化速率的分析
1.3.2.1 样品pH值的测定
将新鲜配好的GDL溶液加入大豆蛋白溶液,使蛋白总质量浓度为50 g/L,凝固剂质量浓度为5 g/L,SPI混合液放置在30、40、50、60、70、80、90 ℃条件下保温,每隔10、20、30、60、90、120、180、240、360、480 min,将SPI凝胶取出,在25 ℃水浴锅内平衡5 min后,测定pH值。
1.3.2.2 浊度测定
根据María等[17]的方法作适当修改,用UV-1800紫外-可见分光光度计测量共混溶液的浊度。蛋白溶液在95 ℃加热1 h后,与新鲜配制的GDL溶液混合至最终溶液中的SPI质量浓度为50 g/L,凝固剂质量浓度为5 g/L。取4 mL的液体混合物在波长600 nm处测量吸光度。
1.3.3 凝胶强度的测定
按照1.3.1节方法制备凝胶。参照Cardoso等[18]的方法并稍作修改,将凝胶在4 ℃贮藏24 h之后,利用TA. XT plus物性测试仪测定凝胶强度。探头型号P/0.5,测前速率1 mm/s,测试速率1 mm/s,测后速率1 mm/s,测定距离为10 mm,触发力5 g,触发类型为自动,实验设置6 个平行样品。
1.3.4 保水性的测定
参照Maltais等[19]的方法,将含有凝胶的试管在25 ℃条件下10 000×g离心10 min,然后倒转30 min,使析出的水分充分释放。保水性为离心后凝胶质量占离心前凝胶质量的百分比,实验设置3 个平行样品。
1.3.5 频率扫描测定
使用MCR 301旋转流变仪,配备PP50(1 mm间隙)平行板进行频率扫描。用刀片剪切凝胶,制备样品。在25 ℃、0.1~10 Hz、应力1%条件下进行频率扫描,记录模量。
1.3.6 微观结构分析
1.3.6.1 激光共聚焦扫描测试
将成胶前的大豆蛋白共混溶液与染色染料Rhodamine B(10 μg/g)混合后,按1.3.1节方法,将共混溶液滴入凹槽载玻片,加一层盖玻片且在四周涂一层指甲油防止水分蒸发后,分别放在各温度下保温成胶。激发波长543 nm,在560~700 nm范围内进行观测。
1.3.6.2 图像的分形分析
采用ImageJ 1.50i对激光共聚焦图像进行处理,阈值化所用的灰度值是根据Eduard等[20]的方法分析每幅图像的灰度直方图的中值。按式(1)和(2)的分形盒计数法计算分形维数(Dƒ):

式中:Nɛ为包含某一部分图像的某一尺度上的盒子的数量;ɛ为对应的尺度;D为分形维数;Dƒ为一个额外的维度用于真实地表示凝胶的三维特征。
1.4 数据分析
除凝胶强度测定6 次,其他均测定3 次。实验数据采用DPS和Origin 8.5软件进行统计分析,每组数据均进行单因素方差分析(ANOVA),平均值差异的统计学显著性 (P<0.05)通过LSD测试进行评估,所有结果均以±s表示。
2 结果与分析
2.1 酸化速率的分析
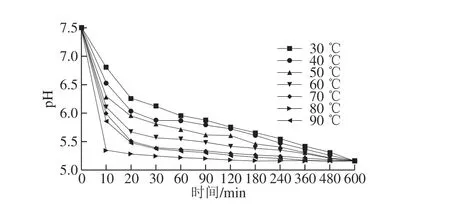
图 1 保温温度对SPI凝胶pH值的影响Fig. 1 Effect of incubation temperature on the pH value of soy protein isolate gels
2.1.1 pH值的测定结果
GDL溶于水后会逐渐分解成葡萄糖酸,释放酸性离子H+,中和蛋白质的表面电荷,降低共混体系的pH值,使蛋白质聚集、沉淀、成胶[11,21-23]。如图1所示,SPI凝胶样品的最终pH值稳定在5.17。随着保温温度的升高,SPI凝胶的pH值下降速率增加,这是因为GDL分解速率随保温温度的升高而加快,酸化速率增加[15-16]。当保温温度不大于60 ℃时,样品在10 h之后达到稳定pH值,酸化速率慢。当保温温度为90 ℃时,样品在2 h时便达到稳定pH值。由此表明,通过改变保温温度,可以显著调控大豆蛋白凝胶被酸化的速率。
2.1.2 浊度测定结果
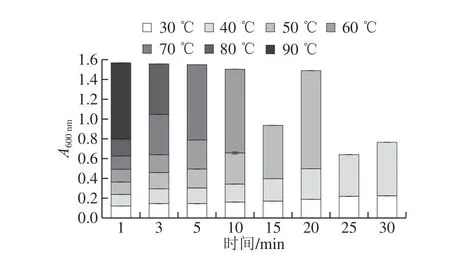
图 2 保温温度对SPI溶液浊度的影响Fig. 2 Effect of incubation temperature on the turbidity of soy protein isolate solution
当蛋白聚集的越迅速,聚集程度越高,蛋白浊度越高[17]。由图2可知,随着保温温度的升高,SPI溶液的浊度越高,形成凝胶的时间越短。当保温温度不大于40 ℃时,蛋白溶液在保温30 min后仍未形成凝胶,而当保温温度不小于50 ℃时,蛋白在保温30 min的过程中均已开始形成凝胶,SPI溶液在90 ℃保温1 min后即形成凝胶。结合SPI凝胶pH值的测定结果,不同的保温温度可以调控SPI凝胶被酸化的速率。
2.2 凝胶强度的测定
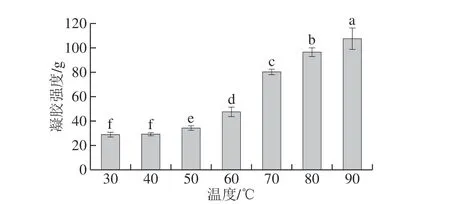
图 3 保温温度对SPI凝胶的凝胶强度的影响Fig. 3 Effect of incubation temperature on the gel strength of soy protein isolate gels
由图3可知,随着保温温度的升高,SPI凝胶的凝胶强度不断提高。30 ℃和40 ℃保温形成的蛋白凝胶的凝胶强度无显著差异,这是因为当保温温度不大于40 ℃时,酸化速率较慢,蛋白聚集程度较低,蛋白溶液在保温30 min后均未形成凝胶,凝胶结构极弱。当保温温度提高到50 ℃时,酸化速率加快,蛋白聚集加快,蛋白溶液在保温20 min后便凝固成胶,凝胶强度显著增大。当保温温度不大于60 ℃时,凝胶样品在10 h之后才达到稳定pH值,凝胶结构固化时间短,凝胶强度较低,当保温温度由60 ℃提高到70 ℃时,酸化速率显著加快,蛋白在保温10 min的过程中均已开始形成凝胶,蛋白凝胶固化时间较长,凝胶结构更为稳定,所以凝胶强度显著增大[24-25]。
2.3 频率扫描结果
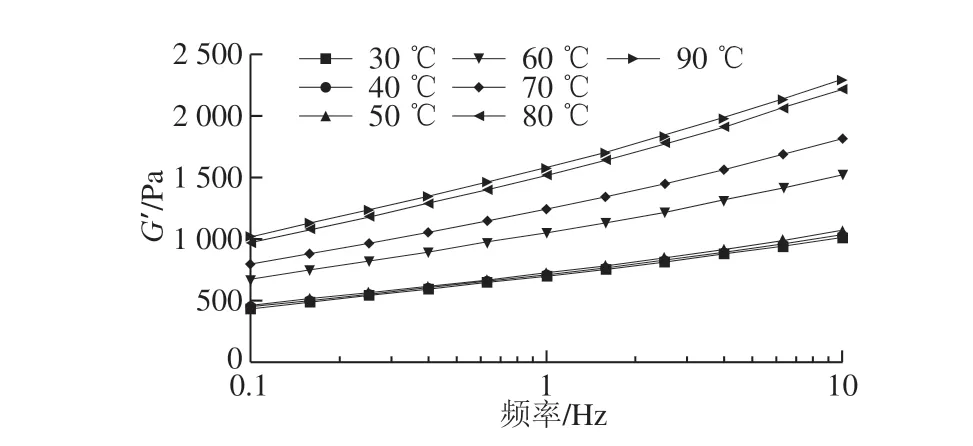
图 4 保温温度对SPI凝胶频率扫描过程中G’的影响Fig. 4 Effect of incubation temperature on the storage modulus of soy protein isolate gels during frequency sweep
由图4可知,SPI凝胶的储能模量(G’)在0.1~10 Hz范围内是频率相关的,即形成了SPI凝胶结构,具有典型的黏弹性材料属性[26-27]。当保温温度不大于50 ℃时,酸化速率较慢,SPI凝胶达到稳定pH值需较长的时间(≥10 h),蛋白聚集体之间彼此交联形成凝胶的时间长,凝胶固化时间短,因此,在30、40、50 ℃的保温温度下G’间无显著性差异。当保温温度为60 ℃时,酸化速率加快,蛋白聚集体之间迅速发生交联,蛋白凝胶在保温10 min后便固化成胶,G’增大,凝胶刚性增大。随着保温温度的升高,酸化速率不断增加,蛋白聚集和凝胶速率不断增加,凝胶刚性不断增加,90 ℃时达到最大[28]。
2.4 保水性的测定
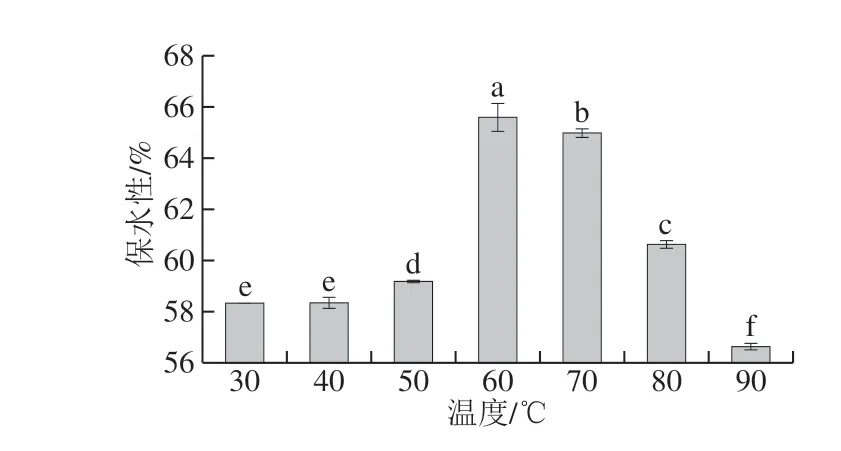
图 5 保温温度对SPI凝胶的保水性的影响Fig. 5 Effect of incubation temperature on the water holding capacity of soy protein isolate gels
如图5所示,随着保温温度的升高,SPI凝胶的保水性先增加后降低,60 ℃时达到最大。当保温温度小于60 ℃时,酸化速率过慢,pH值变化缓慢,聚集速率过慢,凝胶形成缓慢,需较长时间才可达到稳定状态,凝胶结构较弱,因而形成的凝胶保水性差。当保温温度大于60 ℃时,酸化速率过快,pH值下降过快,聚集过快,形成的聚集体较大,凝胶结构粗糙,不均匀,凝胶的保水性相较于最优的酸化速率条件下(60 ℃保温)的保水性有所下降[17]。当保温温度为60 ℃时,GDL分解速率最为适中,SPI被酸化的速率最优,因而形成的三维网络结构最为致密均匀,凝胶保水性最优。该结果与SPI凝胶的凝胶强度变化趋势不同,这是因为蛋白凝胶的保水性主要受蛋白分子网络结构的致密程度所调控,而不是凝胶强度[29-30]。
2.5 微观结构分析

图 6 不同保温温度形成的SPI凝胶的共聚焦图和对应的二进值图Fig. 6 Confocal laser scanning microscopic images and corresponding binary images of soy protein isolate gels formed at different incubation temperatures
如图6所示,当保温温度在60 ℃时,形成的SPI凝胶结构最为均匀致密,其分形维数达到最大值2.90±0.010;30 ℃保温时,分形维数为2.88±0.010,凝胶结构松散、不致密,这是因为酸化速率过低,蛋白分子聚集速率过慢,不能形成致密的凝胶结构,保水性较低;90 ℃保温时,分形维数最低2.86±0.010,这是因为在该温度下体系酸化速率过快,蛋白分子迅速聚集沉淀,形成团簇状结构,因而凝胶结构空隙较多,凝胶的致密均匀程度降低。该结果与SPI凝胶保水性的结果相同,这也进一步表明蛋白凝胶的保水性主要受蛋白分子结构的致密程度调控[29-30]。
3 结 论
本实验研究酸化速率对GDL诱导的SPI凝胶结构的影响,pH值和浊度的测定结果表明,通过改变保温温度可以显著调控蛋白凝胶的酸化速率。当保温温度不断升高,GDL凝固剂的释放速率越来越快,SPI凝胶的pH值的下降速率越来越大,同时,蛋白溶液的浊度不断增加,表明蛋白聚集速率的增加,凝胶形成速率的加快。随着酸化速率的增加,SPI凝胶的凝胶强度和刚性不断提高,但是,保水性先增加后降低,在60 ℃时达到最大值。微观结构的测定结果显示,在60 ℃保温的SPI凝胶的结构最为均匀致密。综上所述,GDL的酸化速率可以调控SPI凝胶的质构特性,制成质构各异的SPI凝胶。

