基于16S rRNA技术分析α-乳白蛋白对 大鼠肠道菌群的影响
李梦寒,王志勇,盛 雪,崔东影,席恩泽,汤梦琪,张惠恺,许晓曦,,马春丽,
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江农业工程职业学院,黑龙江 哈尔滨 150088)
婴儿时期肠道菌群尚未完善,免疫系统不够成熟,肠道、呼吸道等极易被感染。母乳或婴儿配方奶粉作为婴儿首先摄入的食物,对婴儿的健康产生重要影响[1]。研究发现,母乳喂养的婴儿患哮喘、肥胖症、儿童期白血病、婴儿猝死综合征和坏死性小肠结肠炎等疾病的患病风险偏低[2],这是因为母乳中含有丰富的生物活性物质有助于婴儿肠道菌群的良好稳态及免疫系统的发育,如 α-乳白蛋白(α-lactalbumin,α-LA)、母乳低聚糖、分泌的抗体、乳铁蛋白等。
α-LA是母乳中的生物活性蛋白之一,占总蛋白质的20%~25%,在成熟母乳中的质量浓度为(2.44±0.64)g/L[3]。 它能为婴儿提供丰富的必需氨基酸,如色氨酸和半胱氨酸[4],并促进矿物质吸收[5];参与乳糖合成以促进乳的分泌[6];其熔球状态能抗病毒感染并促进癌细胞凋亡[6]。在α-LA消化过程中,会生成各种生物活性肽,其中一些生物活性肽具有调节免疫、抗病毒、抑制血压升高等 活性[7],更重要的是,已有报道表明在α-LA体外消化过程中产生抗菌肽和刺激双歧杆菌生长的肽链,它们很有可能作用于肠道细菌并调整肠道菌群保持动态平衡,从而进一步影响婴儿的免疫系统与生长发育[8]。因为肠道菌群的紊乱不但与哮喘、湿疹、小儿肥胖、坏死性小肠结肠炎等婴幼儿疾病相关[9],还有可能影响成年后炎性肠病、肠易激综合征、心血管疾病[10]、精神疾病[11]、I型糖尿病,甚至是癌症的发病风险[12]。
婴儿配方奶粉是在牛乳的基础上,调整和强化蛋白质、脂肪、维生素等营养素加工而成的,并且在设计上要尽可能接近母乳[13]。牛乳和母乳中乳清蛋白的构成不同,母乳中的乳清蛋白以α-LA为主,而牛乳中以β-乳球蛋白为主,并且这种蛋白不存在于母乳中。这就导致婴儿配方奶粉中添加了母乳中不存在的β-乳球蛋白,而主要的α-LA相对缺乏[14]。α-LA作为母乳中重要的免疫蛋白,除了能为婴儿提供必需氨基酸等各种营养物质外,还可能具有调整肠道菌群的作用,可帮助肠道有益菌快速稳定地定植在婴儿肠道中,减少有害菌的黏附繁殖,它们的定植有助于婴幼儿先天免疫系统的形成。所以,在婴儿配方奶粉中补充α-LA对于婴儿的生长发育意义重大。然而,添加过少的α-LA可能不能对婴儿的肠道菌群起到调整的作用,添加过多的蛋白质则会增加婴儿的氮负荷,造成肾脏负担[15]。因此,探究α-LA在婴儿配方奶粉中的适宜添加量,在保证其最大程度的发挥生物活性的同时减少用量,意义十分重大。
在前期体外实验中,探究不同添加量的α-LA对肠道益生菌和有害菌的增殖或抑制作用,以此为基础,参考母乳中α-LA添加量,本实验再次筛选出高添加量α-LA(200 mg/kg)、中添加量α-LA(100 mg/kg)、低添加量α-LA(20 mg/kg)3 个剂量,以SD大鼠为动物模型,采用16S rRNA测序技术探讨α-LA对肠道菌群多样性及物种组成的影响,重点分析不同添加量α-LA对肠道益生菌、潜在有害菌的促进或抑制作用,从而选择出调节婴儿肠道菌群的最佳添加量,为进一步的婴儿喂养实验提供研究基础,最终为婴儿配方奶粉中α-LA科学的添加量提供理论支持。
1 材料与方法
1.1 试剂与实验动物
α-LA(WPC-8800) 美国Hilmar Ingredients公司。
实验选用4 周龄清洁级雄性SD大鼠,体质量150 g左右,购自北京维通利华试验动物技术有限公司。许可证号:SPF级 90~110 g SCXK(京)2016-0026。饲养期间给予自由采食和饮水。维持室内温度(23±2)℃、相对湿度40%~70%、12 h昼夜循环采光。饲养大鼠所用的鼠笼、饮用水瓶等用具均用稀释后的84消毒液浸泡30 min后,用自来水清洗干净、自然晾干。饮用水经高压灭菌后自然降至室温供大鼠饮用。垫料每隔3~4 d更换一次,其他操作严格遵守鼠房规范。
1.2 仪器与设备
DSX-280B手提式压力蒸汽灭菌器 上海申安医疗器械厂;BPG-9070A鼓风干燥箱 上海一恒科技有限 公司;BSA224S分析天平 德国Sartorius公司;MX-S可调式混匀仪 美国Scilogex公司;VD-1320型无菌操 作台 北京东联哈尔仪器制造厂;DW-86L490J型 -80 ℃超低温冰箱 青岛海尔集团。
1.3 方法
1.3.1 分组及取样
大鼠适应3 d后正式开始实验,40 只大鼠随机分为4 组,对照组(A组)、高添加量组(B组)、中添加量组(C组)、低添加量组(D组),每组各10 只大鼠。A、B、C、D四组大鼠分别灌喂0.5 mL的生理盐水,200、100、20 mg/kg的α-LA。每天灌喂时间固定,灌喂持续整个实验周期28 d。
分别于实验的第14、28天每组随机选取3 只大鼠,心脏取血。转移至超净工作台内解剖,使用75%的乙醇溶液擦拭大鼠腹部,消毒后的手术剪打开大鼠腹腔将肠道完整分离出来,在结肠末端取1~2 颗大鼠粪便保存于灭菌后的EP管中,液氮速冻后在-80 ℃冰箱保存。样本分组情况如表1所示。
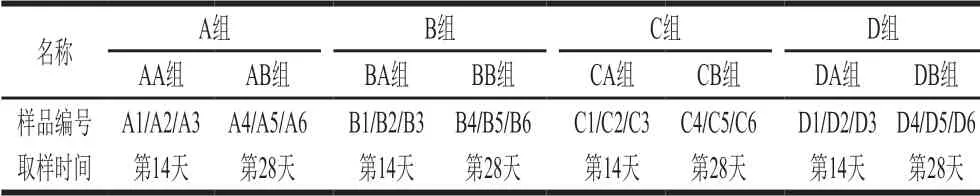
表 1 样品分组表Table 1 Grouping of experimental rats
1.3.2 大鼠肠道菌群分析
1.3.2.1 大鼠粪便测序实验过程
大鼠粪便样品从-80 ℃冰箱取出后立刻放入干冰内寄送到北京奥维森基因科技有限公司,然后进行如下测序实验过程:首先用粪便组基因DNA提取试剂盒提取大鼠粪便DNA,1%琼脂糖凝胶电泳检测合格后进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。选择扩增16S rRNA基因的V3-V4区域,合成带有错位碱基的融合引物。同时保证样本的扩增循环数一致,使绝大多数样本能够扩增出浓度合适的产物。混合同一样本的3 份PCR产物后用2%琼脂糖凝胶电泳检测,再用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物。使用酶标仪对PCR产物检测定量,并进行相应比例的混合。构建MiSeq PE文库后采用Illumina Miseq PE 300平台进行高通量测序。
1.3.2.2 生物学信息分析
Miseq测序得到的是双端序列数据,下机数据PE reads去除barcode和primer拼接后得到raw tags,raw tags经进一步去除嵌合体、短序列后得到优质序列clean tags。在0.97相似度下利用qiime(v1.8.0)软件进行可分类操作单元(operational taxonomic units,OTUs)聚类和物种注释。将OTU代表序列与相应的微生物数据库比对,得到每个样本的物种分类信息,并在各个水平上注释。一方面,基于聚类结果,进行α多样性分析和β多样性分析;另一方面,基于注释结果,可以得到各水平的物种组成信息。
1.4 数据处理
α多样性指数数据使用Statistix 8进行显著性分析后用OriginPro 8.5.1软件作图,显著水平P<0.05。
2 结果与分析
2.1 大鼠肠道菌群多样性分析
2.1.1 α多样性分析
在微生物扩增子测序中,α多样性分析了样品中两个因素,丰富度(物种类别的多样性)和均匀度(物种组成多少的整体分布)[16],本实验以稀释性曲线、物种数目饱和度曲线、α多样性指数3 个角度评估α多样性。
稀释性曲线是基于OTU聚类结果利用mothur做稀释性分析,利用R语言工具制作的曲线图。它可以用来评估样本的测序数据量是否合理,也可以用来比较不同样本的物种丰富度[17]。由图1可知,大鼠肠道菌群的稀释曲线随样品序列数目增加趋于平坦,说明测序数据量足够大,更多的数据量只会产生少量新的OTU,测序结果可以反映样本中绝大多数的微生物信息。在测序深度相同的情况下,B4、B6、C5、B5、C4的丰富度明显高于其他样品,说明第28天时高添加量组、中添加量组提高了大鼠菌群的丰富度。
物种数目饱和度曲线也是分析样本中微生物多样性的一种方法,它可以从物种丰富度和物种均匀度两个方面解释多样性[18]。由图2可知,24 个样品的曲线趋势相似。在水平方向上,各样品曲线宽度反映丰富度,曲线在横轴上的范围较大,体现出不同样品的物种丰度可能有较大差异,其中B4、B5丰富度最高,A2、A3丰富度最低。另一方面,曲线形状反映了样本中物种的均匀度,图中各个样品曲线平滑程度较好,仅末端有部分曲折,整体趋势平缓,说明物种分布均匀。
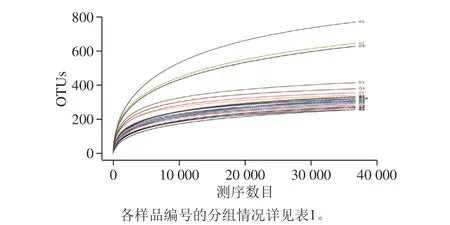
图 1 基于OTU总数的稀释曲线Fig. 1 Rarefaction curves
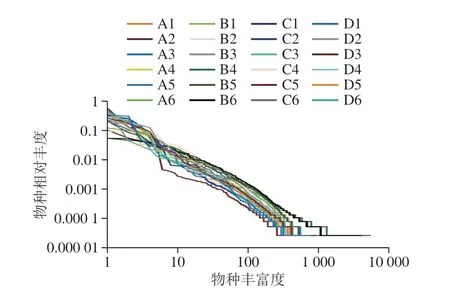
图 2 基于OTU总数的物种数目饱和度曲线Fig. 2 Rank abundance curves
α多样性指数包括一系列统计学分析指数,通过单样品的多样性分析可以反映微生物群落的丰富度和均匀度。本实验采用Chao1指数、Observed species指数、Shannon指数、PD whole tree指数评估各样本的α多样性,进而分析各实验组的多样性。Chao1指数、Observed species指数评价物种丰富度,数值越大丰富度越高;Shannon指数、PD whole tree指数均可基于丰富度和均匀度两个方面评价多样性,数值越大说明该环境的物种越丰富,同时各物种分配越均匀。
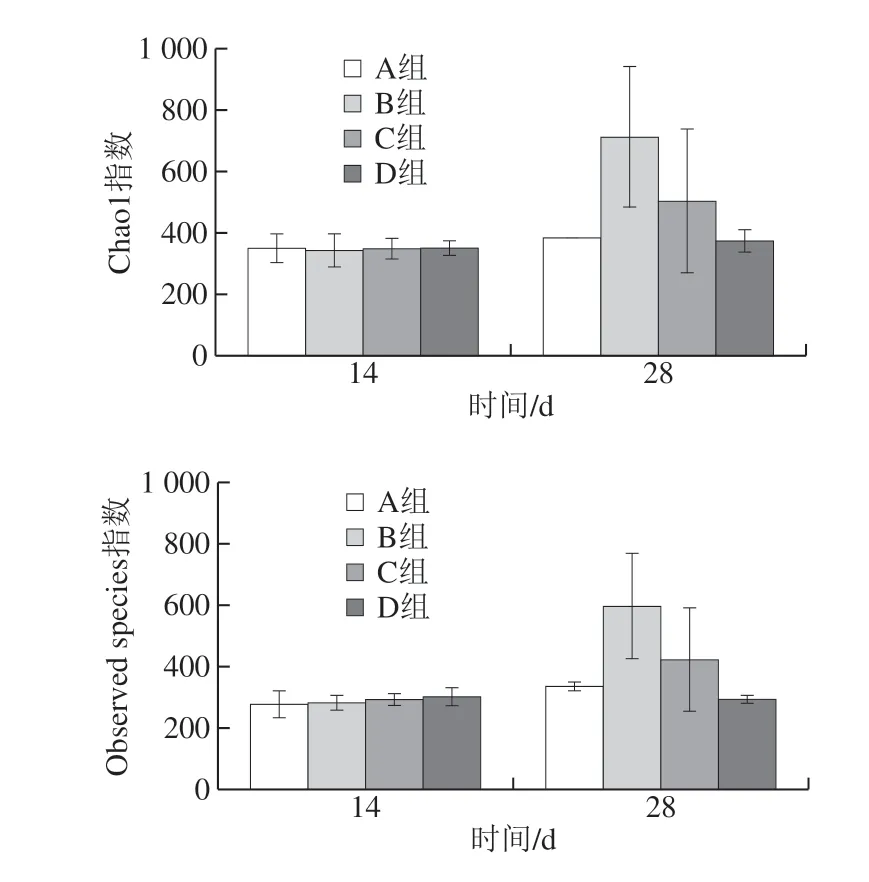

图 3 基于OTU总数的α多样性指数图Fig. 3 α-Diversity indexes based on the total number of OTUs
由图3可知,Chao1指数、Observed species指数、Shannon指数、PD whole tree指数变化趋势相似。在大鼠饲喂第14天时,各多样性指数柱形图几乎持平,不同添加量的蛋白对提高大鼠粪便菌群α多样性效果不显著 (P>0.05);饲喂第28天时,高添加量组、中添加量组各多样性指数均高于对照组,在Shannon指数中,高添加量组多样性显著高于对照组(P<0.05)。低添加量组多样性与对照组无显著差异(P>0.05)。说明第14天时各蛋白浓度组不能提高菌群多样性,第28天时高添加量、中添加量蛋白发挥出生物活性,显著提高了大鼠肠道菌群的丰富度和均匀度。
2.1.2 β多样性分析
β多样性主要分析了样本与样本间微生物群落组成的相似性[19]。NMDS法是评估β多样性的方式之一,它以点的形式将样本包含的物种信息反映在多维空间上,通过点与点之间的距离体现样本间的差异程度[20]。由图4可以看出,在大鼠饲养第14天时,每组内各个样品点分布区域比较密集,样品个体差异性较小,每组内3 个样品微生物群落结构相似,平行度较好。AA、BA、CA、DA各组形成的圆圈两两均有交集,说明组间差异性较小,此时不同添加量的α-LA对肠道菌群的群落结构无显著影响。饲养第28天时,AB、DB两组所形成的圆圈面积小,样品平行度好,BB组、CB组稍差,这可能与大鼠的个体差异相关。第28天时各组的圆圈交集较少,群落组成出现差距,此时α-LA发挥出了生物活性,对肠道菌群群落结构产生影响,使实验组与对照组区分显著。
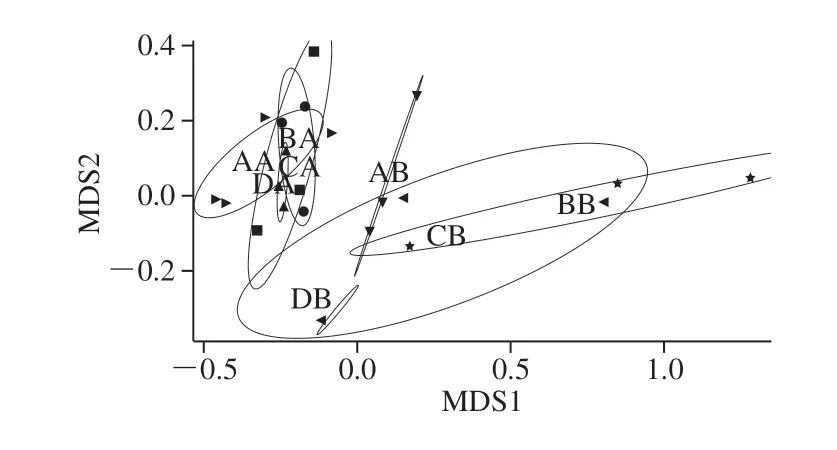
图 4 大鼠肠道菌群NMDS分析图Fig. 4 NMDS analysis of rat intestinal flora
综合α多样性和β多样性分析可知,本实验测序量足够大,结果可以反映样本中绝大多数的微生物信息。在大鼠饲喂第14天时,各组AA、BA、CA、DA在丰富度、均匀度、群落结构上均无显著差异,此时各蛋白添加量组并未完全发挥生物活性;在饲喂第28天时,BB (P<0.05)、CB(P>0.05)组的多样性明显提高,群落结构与对照组AA组相比差距很大,此时α-LA完全发挥出了生物活性,它对于肠道菌群的调整是一个温和的渐进过程。王瑞[21]分析了不同月龄婴幼儿肠道菌群OTU数量及α多样性。D1W为0~6 月龄婴儿样品;D2W为6~12 月龄较大婴儿样品;D3W为12~36 月龄幼儿样品。结果发现D1W样品OTU数量和丰富度均显著低于D2W、D3W(P<0.05),而D2W、D3W的Observed species指数、Chao1指数无显著差异(P>0.05)。由此可推测6~12 月是婴儿肠道菌群繁衍的关键时期,在此时期长时间补充高添加量α-LA、中添加量α-LA可更好的提高婴儿肠道菌群多样性,调整菌群结构,促进更多种类的益生菌在肠道内定植繁衍,减少肠道有害菌的黏附占位,使婴儿肠道菌群健康发展。
2.2 物种组成分析
2.2.1 基于门分类水平的分析
经物种组成分析可得知一个或多个样本在各分类水平上的分类学比对情况。采用统计学的分析方法,能观测样本在门、纲、目、科、属5 个水平的群落结构[16]。本实验重点分析了门水平和属水平。
探究不同添加量的α-LA对门水平上肠道菌群组成的影响,结合图5可知,各组样本生成的OTU主要由5 个门构成:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia),其中厚壁菌门和拟杆菌门占绝对主导地位。此外,由图6可以看出,其他相对丰度较高的门还有柔膜菌门(Tenericutes)、蓝菌门(Cyanobacteria)等。第28天时BB、CB组出现了浮霉菌门(Planctomycetes)、绿 湾 菌 门( C h i o r o f l e x i ) 、 芽 单 胞 菌 门(Gemmatimonadetes)、醋酐菌门(Acidobacteria)、装甲菌门(Armatimonadetes)、异常球菌-栖热菌门(Deinococcus-Thermus)、硝化螺旋菌门(Nitrospirae)等新菌门,说明高添加量α-LA和中添加量α-LA在第28天时有效提高了大鼠肠道菌群的多样性,与上述α多样性分析相符合。

图 5 大鼠肠道菌群门水平物种组成分析柱状图Fig. 5 Analysis of intestinal flora composition at the phylum level
补充不同添加量的α-LA会影响大鼠门水平上肠道菌群组成,且随时间变化,如图6所示:第14天时,相比于对照组,各添加量蛋白组提高了放线菌门的相对丰度,蛋白添加量由高到低分别提高0.49%、0.49%、1.44%;BA组降低了厚壁菌门丰度并提高拟杆菌门相对丰度,CA、DA组对厚壁菌门、拟杆菌门整体影响不大。第28天时,随α-LA添加量提高,厚壁菌门相对丰度不断提高,同时拟杆菌门、变形菌门相对丰度不断下降。高添加量BB组、中添加量CB组、低添加量DB组分别使拟杆菌门下降9.49%、20.61%、27.88%,使变形菌门分别下降0.9%、1.8%、2.08%,使厚壁菌门分别提高5.46%、18.97%、25.88%。不同蛋白添加量组对放线菌门相对丰度均有不同水平的提高,对疣微菌门影响不显著。拉姆卓嘎[22]探究了婴儿在不同喂养方式下对肠道菌群的影响,研究发现母乳喂养的婴儿肠道菌群呈动态变化:从出生后的14 d~4 个月这段期间,厚壁菌门相对丰度从33.3%增至53.4%;变形菌门从53.4%下降至17.5%,放线菌门从8.6%增至27.3%。这个趋势与大鼠肠道菌群在28 d时的变化十分相似,由此可以推测,母乳中的α-LA对肠道菌群门水平的影响十分显著。
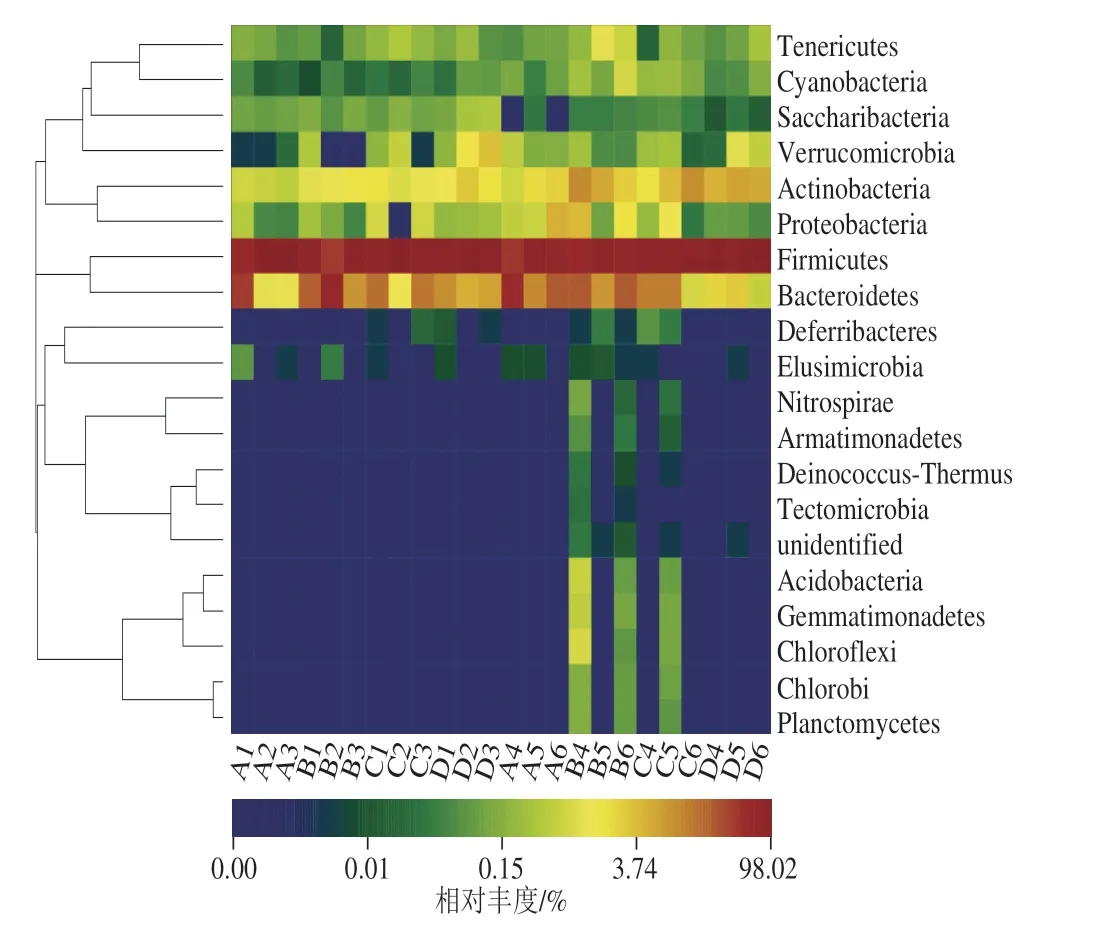
图 6 大鼠肠道菌群门水平热图Fig. 6 Heatmap of the intestinal flora at the phylum level
2.2.2 基于属分类水平的分析
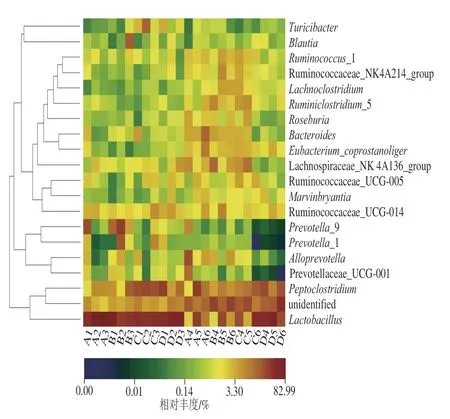
图 7 大鼠肠道菌群属水平热图Fig. 7 Heatmap of the intestinal flora at the genus level
由图7可知,乳杆菌(Lactobacillus)、瘤胃菌科(Ruminococcaceae)下的未知属Ruminococcaceae_UCG-014、Ruminococcaceae_UCG-005、Ruminococcus_1、阿克曼氏菌(Akkermansia)、木质真菌(Eubacterium xylanophilumgroup)、毛螺旋菌科(Lachnospiraceae)下的未知属Lachnospiraceae_NK4A136_group、Lachnospiraceae_UCG-006、Marvinbryantia、布劳特氏菌(Blautia)、梭菌科下的未知属Clostridium sensu stricto_1、普氏菌科(Prevotellaceae)下的未知属(Prevotella_9、Prevotella_1、Prevotellaceae_UCG-001)、拟杆菌(Bacteroides)等为大鼠肠道中相对丰度较高的菌属。比较第14天与第28天时的热图发现,第14天时各样本微生物主要分布在特定的几种属上,其余属分布丰度较低,而第28天时大量属的丰度均有提高,样本分布均匀度提高,这再次印证了上述α多样性分析。
由图8可知,灌喂α-LA会影响大鼠肠道菌群属水平上的组成。实验结果显示,第28天时中添加量、低添加量蛋白使乳杆菌相对丰度分别提高9.89%、26.29%,而高添加量蛋白使其丰度下降3.29%。乳杆菌是一种优质的益生菌,已有大量文献资料表明其促进肠上皮细胞增殖、参与调解结肠粘液层、重塑黏蛋白糖基化等功能[23]。第28天时蛋白添加量由高到低分别使木质真菌相对丰度提高0.31%、0.18%、0.45%;高添加量蛋白降低布劳特氏菌的相对丰度,而中、低添加量蛋白维持或提高其相对丰度;各蛋白添加量组均能维持毛螺旋菌科成员Lachnospiraceae_NK4A136_group、Lachnospiraceae_UCG-006、Marvinbryantia以及梭菌科下的未知属Clostridium sensu stricto_1相对丰度保持恒定。毛螺旋菌科能将复杂的多糖降解为乙酸、丁酸和丙酸[24],布劳特氏菌是醋酸盐生产者、木质真菌、梭菌科下的未知属Clostridium sensu stricto_1是丁酸盐生 产者[25],这些短链脂肪酸被胃肠道中的上皮细胞迅速吸收,参与细胞的调节过程,如基因表达、趋化性、分化、增殖和凋亡[26]。此外,短链脂肪酸还能影响细胞因子的产生,调节免疫系统,在炎症反应中发挥作用[27]。第14天时高添加量蛋白降低阿克曼氏菌的相对丰度,中、低添加量蛋白对其有一定的促进作用。对于瘤胃球菌科成员Ruminococcaceae_UCG-014、Ruminococcaceae_UCG-005、Ruminococcus_1,各蛋白组有维持其相对丰度的趋势。阿克曼氏菌是新兴的益生菌,具有改善糖尿病大鼠的肝功能、减少糖毒性和脂毒性、缓解氧化应激反应、抑制炎症、恢复正常的肠道菌群等功能[28]。瘤胃球菌科成员可抑制霍乱弧菌感染,移植到发育不良的小鼠体内可改善其生长和代谢异常[29]。阿克曼氏菌和瘤胃球菌科在长寿老人粪菌中相对丰度均较高,可能成为长寿信号之一[30]。

图 8 大鼠肠道菌群属水平物种组成分析柱状图Fig. 8 Analysis of intestinal flora composition at the genus level
此外,α-LA可降低普氏菌科成员相对丰度,蛋白添加量由高到低分别使普氏菌科下的未知菌属Prevotella_9丰度下降2.01%、2.26%、2.3%;使普氏菌科下的未知菌属Prevotellaceae_UCG-001相对丰度下降3.89%、3.97%、4.26%。普氏菌科丰度会在早期类风湿性关节炎患者体内增加,并被证明参与了关节炎的发病机制[31];由于它是负责支链氨基酸生物合成和胰岛素抵抗的主要物种,因此也与缺血性心血管疾病和2型糖尿病的风险相关[32]。α-LA呈浓度依赖的趋势降低了拟杆菌属相对丰度,蛋白添加量由高到低分别使其丰度分别下降3.33%、4.78%、6.68%。研究表明,拟杆菌属的细胞表面脂蛋白BtuG2与VB12的亲和度高于内源因子,因此其丰度提高可能导致VB12缺乏[33];该物种与多种疾病相关,包括结肠直肠癌、肝病的发病风险[34]。除此之外,α-LA对大肠杆菌-志贺菌属(Escherichia-Shigella)体现出极强的抑制作用,中添加量蛋白组抑制效果最好,将其相对丰度由1.90%降至0.01%。
婴儿肠道菌群的定植是一个连续而复杂的动态过程。有研究报道,婴儿期是肠道菌群定植的最佳时期,到1 岁时肠道内微生物接近于成人,属于相对成熟及稳定期[35]。不同喂养方式对婴儿肠道菌群的影响产生较大差异,母乳喂养能提高婴儿肠道中双歧杆菌科(Bifidobacteriaceae)、韦荣球菌科(Veronococcidae)、毛螺旋菌科、永荣氏球菌属(Veillonella)等肠道益生菌的相对丰度,同时降低大肠杆菌-志贺菌属、克雷白杆菌属(Klebsiella)等肠道有害菌的相对丰度[36]。母乳喂养儿肠道优势益生菌的维持时间长,促进了菌群稳态的建立。
在本实验中,不同添加量的α-LA起到了与母乳相似的作用,它同样促进肠道优势益生菌的繁殖,并抑制肠道有害菌的生长。从益生菌的角度分析,中、低蛋白组提高了益生菌乳杆菌、布鲁克士菌、阿克曼士菌相对丰度,而高添加量蛋白组作用相反;高、中、低蛋白组均能提高木质真菌并维持瘤胃球菌科成员、毛螺旋菌科成员、梭菌科下的未知属Clostridium sensu stricto_1相对丰度保持恒定。从有害菌角度分析,α-LA使普氏菌科成员、拟杆菌属相对丰度有不同程度的降低,作用效果随浓度降低而提高;对有害菌大肠杆菌-志贺菌属体现出极强的抑制作用,中添加量组抑制效果最好,将其相对丰度由1.90%降至0.01%。由此可知,不同添加量的α-LA均能维持或促进肠道益生菌繁殖,中、低添加量蛋白效果更好;对肠道中潜在有害菌起到抑制作用,高、中添加量蛋白效果更好。
3 结 论
经实验探究,中添加量α-LA(100 mg/kg)为调节肠道菌群的最佳添加量,主要实验结论如下:1)第14天时不同添加量的α-LA对大鼠肠道菌群的多样性无明显影响,第28天时高添加量蛋白组、中添加量蛋白组在提高物种多样性的同时兼顾了均匀性。第14天时各浓度组聚集成团,交叉区域范围广,区分不明显;第28天时各组圆圈交集较少,实验组与对照组区分显著,蛋白对群落结构产生影响。大鼠肠道菌群以厚壁菌门和拟杆菌门为主,各浓度蛋白组对于门水平的调节与母乳相似。中、低蛋白组能提高乳杆菌、布劳特氏菌、阿克曼氏菌的相对丰度;各浓度组均能使普氏菌科成员、拟杆菌相对丰度有不同程度的降低,作用效果随浓度降低而提高;各浓度组均能提高木质真菌相对丰度并维持瘤胃球菌科成员、毛螺旋菌科成员、梭菌科下的未知属相对丰度保持恒定。2)中添加量α-LA能在提高菌群多样性的同时温和的提高益生菌相对丰度,降低潜在有害菌的相对丰度,有利于长期维持肠道的健康。本实验结果可为婴儿喂养实验提供参考值,最终为婴儿配方奶粉中α-LA科学的添加量提供理论支持。

