响应面法优化乳酸乳球菌KLDS4.0325 产叶酸的培养基成分及发酵条件
焦雯姝,关嘉琦,史佳鹭,李柏良,陆婧婧,闫芬芬,李 娜,占 萌,霍贵成
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
乳酸菌是能够利用可发酵碳水化合物产生大量乳酸的无芽孢、革兰氏染色阳性细菌的总称,呼吸方式主要为兼性厌氧、耐氧性厌氧和严格厌氧。乳酸菌并不是微生物在分类学上的名称,而是一种惯用叫法。研究证实,乳酸菌能够抑制肠道病原菌的生长,缓解腹泻、乳糖不耐症和便秘,降胆固醇,增强机体免疫力[1-2],乳酸菌发酵后所产生的叶酸、核黄素、γ-氨基丁酸、色氨酸等物质对于人体健康有很高的价值。
随着全基因组测序方法的快速发展,使研究人员可以从基因水平上了解微生物的遗传结构和组成,进而挖掘和控制其生物学功能[3]。乳酸乳球菌KLDS4.0325的全基因组序列已经上传到了GenBank数据库中,登录号为:CP006766。通过对KLDS4.0325基因组序列的比较分析,发现在嘌呤代谢途径和苯丙氨酸合成叶酸途径中,KLDS4.0325在基因水平上均表现出了较强的叶酸合成能力[4]。
叶酸是一种水溶性维生素,又称VB9,是大多数生物体内一碳单位的供体,在维持人体机能和代谢活动中发挥着不可或缺的作用[5],它参与了人体中两种至关重要的反应,分别是核酸的生物合成和与DNA合成和修复有关的甲基化反应[6-7],同时,叶酸在同型半胱氨酸再生蛋氨酸的过程中发挥重要作用[8]。然而,人类是无法从头合成叶酸的[9],叶酸摄入量不足会引起一系列的疾病[10]。目前,工业上合成叶酸的方法以化学合成法居多,但有研究发现,天然叶酸的低摄入和合成叶酸的过摄入均与结直肠癌风险的增加有关[11-12],同时过多地摄入化学合成的叶酸会间接地引起VB12缺乏症[13]。近些年来,利用食品级微生物通过发酵的方法强化食品中天然叶酸的含量被广泛研究[14-15]。因此,一株高产叶酸的益生菌的发现和应用对于人体健康和天然叶酸的产业化生产都有着举足轻重的作用。在乳酸菌发酵代谢产生叶酸的过程中易受发酵培养基的组成、对氨基苯甲酸(p-aminobenzoic acid,pABA)的添加量、温度及pH值变化等因素的影响[16],因此探究乳酸菌叶酸发酵培养的最佳发酵条件是乳酸菌大量制备叶酸的关键。为了使乳酸乳球菌KLDS4.0325能够合成更多的叶酸,本研究采用M17培养基为基础培养基,通过单因素试验确定其最佳的氮源和碳源,通过响应面法优化乳酸乳球菌KLDS4.0325的前体物质添加量及发酵条件,以期为该菌株的产业化应用提供一定的实践基础。
1 材料与方法
1.1 材料与试剂
乳酸乳球菌(Lactococcus lactis)KLDS4.0325,来自东北农业大学乳品科学教育部重点实验室工业微生物菌种保藏中心(KLDS-DICC)。
M17肉汤培养基 青岛海博生物技术有限公司;甲醇(色谱纯) 天津市大茂化学试剂厂;培养基各组分均购于北京博奥拓达有限公司;磷酸缓冲盐溶液(phosphate buffered saline,PBS) 北京索莱宝科技有限公司;叶酸标准品(色谱级,纯度≥98%) 天津阿尔法生物科技有限公司;纯净水 娃哈哈集团有限公司。
1.2 仪器与设备
G L-2 1 M 高速冷冻离心机 上海市离心机械研究所;2996高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Waters公司;ODS-3 C18色谱柱(4.6 mm×250 mm,5 μm) 日本岛津公司。
1.3 方法
1.3.1 HPLC法检测发酵液中的叶酸含量
1.3.1.1 样品前处理
将乳酸菌发酵液振荡混匀后离心(10 000×g,4 ℃,10 min),取上清液,冻干浓缩10 倍后,用0.22 μm滤膜过滤,备用。将叶酸标准品配制成质量浓度0.05 mg/mL。
1.3.1.2 色谱条件
待测发酵液样品和0.0 5 m g/m L 叶酸标样前处理后进行液相色谱分析:固定相为O D S-3 C18柱(4.6 mm×250 mm,5 μm);紫外检测器(波长280 nm);流动相甲醇-PBS(pH 7.2~7.4)为10∶90(V/V); 流速1 mL/min;柱温30 ℃;运行时间12 min;流动相经0.45 μm有机膜过滤后超声波脱气30 min[17-18]。
以没有接种的M 1 7 培养基作空白对照,测定KLDS4.0325在30 ℃培养24 h后,发酵上清液中叶酸含量。结果以每毫升发酵液中叶酸的质量表示。乳酸菌产叶酸量按下式计算:

式中:Y为乳酸菌的胞外叶酸产量;X为发酵液中总叶酸含量;X0为空白组中叶酸含量。
1.3.2 单因素试验
对M17培养基中的碳源及氮源进行优化,确定出菌株KLDS4.0325产叶酸的最佳碳源和氮源。选择发酵初始pH值、发酵时间、发酵温度、接种量、pABA以及谷氨酸添加量为影响叶酸产量的主要因素,通过单因素试验选择Box-Behnken试验的影响因素与水平。使用筛选出的最佳碳源和氮源代替M17培养基中的碳源和氮源成分,进行4因素3水平的Box-Behnken试验。
1.3.2.1 碳源的影响
分别使用5.0 g/L的葡萄糖、蔗糖、乳糖、α-半乳糖及麦芽糖替换M17培养基原有的碳源成分,分别以不接种的相应培养基为空白组,培养温度30 ℃,培养时间24 h。发酵结束后按照1.3.1节中方法进行叶酸含量的分析,同时测定第24小时的OD600nm值。
1.3.2.2 氮源的影响
分别使用17.5 g/L的柠檬酸铵、硫酸铵、蛋白胨、酵母浸粉及牛肉膏替换M17培养基原有的氮源成分,分别以不接种的相应培养基为空白组,培养温度30 ℃,培养时间24 h。发酵结束后按照1.3.1节中方法进行叶酸含量的分析,同时测定第24小时的OD600nm值。
1.3.2.3 发酵初始pH值的影响
分别设置pH 4.2、5.2、6.2、7.2,以2%的接种量接种乳酸乳球菌KLDS4.0325,培养温度30 ℃,发酵24 h结束后,按照1.3.1节中方法进行叶酸含量的分析。
1.3.2.4 发酵时间的影响
以2%的接种量接种乳酸乳球菌KLDS4.0325,培养温度30 ℃,从0 h开始,每隔2 h取样,按照1.3.1.1节中方法离心,收集上清液-20 ℃备用。连续取样36 h后,按照1.3.1节中方法进行叶酸含量的分析。
1.3.2.5 发酵温度的影响
以2%的接种量接种乳酸乳球菌KLDS4.0325,发酵初始pH 6.5,培养温度分别设为25、30、36、42、45 ℃,培养时间24 h。发酵结束后按照1.3.1节方法进行叶酸含量的分析。
1.3.2.6 接种量的影响
分别设置1%、2%、4%与6%的接种量接种乳酸乳球菌KLDS4.0325,发酵初始pH 6.5,培养温度30 ℃,发酵24 h结束后,检测叶酸含量。
1.3.2.7 pABA和谷氨酸添加量的影响
将pABA分别以20、30、40、50、60 mg/L的量加入到液体培养基中,谷氨酸添加量分别为0、2、4、6、8 g/L, 发酵初始pH 6.5,培养温度30 ℃,发酵24 h结束后,检测叶酸含量。
1.3.3 Box-Behnken响应面试验
根据单因素试验结果,选取对KLDS4.0325叶酸产量影响显著的因素为试验因素,以叶酸产量为响应值,通过Design-Expert 8.0.6软件设计4因素3水平Box-Behnken响应面试验,如表1所示。对叶酸产量进行二次多元回归方程拟合,得到各因素与响应值之间函数关系的回归方程,根据试验生成的等高线和响应面图确定最优的发酵条件。
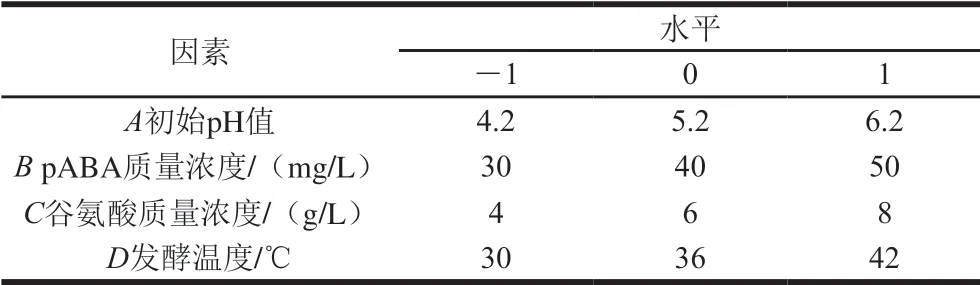
表 1 Box-Behnken试验因素与水平设计Table 1 Code and level of independent variables used for Box-Behnken design
1.3.4 模型的验证
利用响应面模型优化的最佳条件进行发酵实验,比较模型预测值与实验值,验证模型的有效性,实验重复3 次,取平均值。同时,在发酵过程中,每2 h取样测定发酵液的OD600nm值,在最优发酵时间第24小时取样进行平板菌落计数,实验重复3 次,取平均值。
1.4 数据处理
每个实验重复3 次,取平均值。采用SPSS 17.0进行单因素方差分析与显著性差异分析,运用Origin9.0软件进行作图,Design-Expert 8.0.6进行Box-Behnken试验设计。
2 结果与分析
2.1 KLDS4.0325发酵液中的叶酸含量
2.1.1 叶酸标准曲线的绘制
根据1.3.1.2节色谱条件,以叶酸标样浓度为横坐标x, 峰面积为纵坐标y,得其回归方程为:y=68 096x+941.37,R2=0.998。
2.1.2 乳酸乳球菌KLDS4.0325发酵上清液中叶酸的HPLC检测
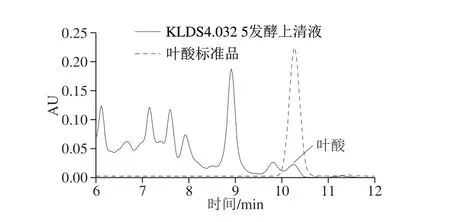
图 1 HPLC法检测乳酸乳球菌KLDS4.0325发酵上清液中 叶酸含量Fig. 1 HPLC chromatogram of folic acid present in the fermentation supernatant of L. lactis KLDS4.0325
如图1所示,质量浓度0.05 mg/mL的叶酸标准品的保留时间为10.272 min。菌株KLDS4.0325发酵上清液的液相色谱图在第10.271分钟处有峰,与标品的分析结果一致,可以定量。
2.2 单因素试验结果
2.2.1 碳源的影响
碳源是影响菌体代谢与生长的重要元素,不同碳源对乳酸乳球菌KLDS4.0325叶酸产量及生长量如图2所示。乳酸乳球菌KLDS4.0325可以利用多种碳源,方差分析结果显示不同种类的碳源对该菌株的叶酸产量和生长量均有显著影响(P<0.05)。当以葡萄糖为碳源时,叶酸产量达到(0.382±0.032)μg/mL,显著高于其他其他碳源(P<0.05)。从生长量看,以蔗糖为碳源时第24小时的OD600nm值显著高于其他碳源(P<0.05),葡萄糖其次。由于不同碳源的结构不同,乳酸乳球菌KLDS4.0325产叶酸的最适碳源为葡萄糖,这与Laiño等[19]的研究结果一致。而生长的最适碳源为蔗糖,葡萄糖仅次于蔗糖,因此确定葡萄糖为乳酸乳球菌KLDS4.0325产叶酸的最佳碳源。

图 2 碳源对乳酸乳球菌KLDS4.0325叶酸产量的影响Fig. 2 Influence of carbon sources on folic acid production of L. lactis KLDS4.0325
2.2.2 氮源的影响
氮源分为有机氮源与无机氮源,微生物可以将有机氮源酶解成小分子物质,被菌体吸收转化后进一步参与代谢,最后形成微生物所必需的营养物质;无机氮源则可以调节外部环境的pH值和菌体的代谢,但是其利用速率较有机氮源快[20]。不同氮源对乳酸乳球菌KLDS4.0325叶酸产量及生长量的影响如图3所示,当以酵母浸粉为单一氮源时,乳酸乳球菌KLDS4.0325的叶酸产量和生长量均显著高于其他组别(P<0.05)。从生长量来看,有机氮源比无机氮源更能促进该菌株的生长。
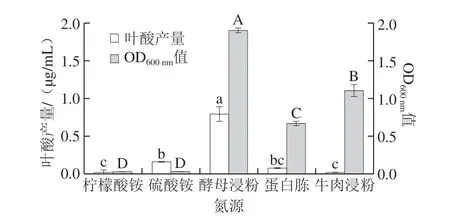
图 3 氮源对乳酸乳球菌KLDS4.0325叶酸产量的影响Fig. 3 Influence of nitrogen sources on folic acid production of L. lactis KLDS4.0325
2.2.3 初始pH值的影响
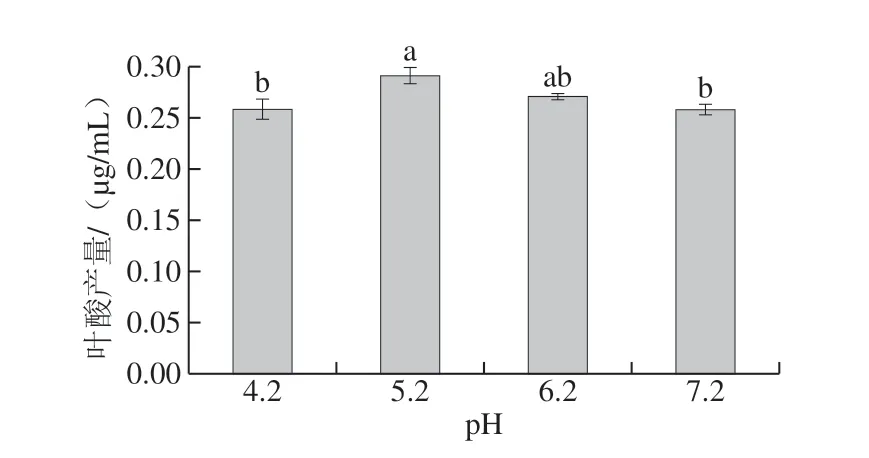
图 4 初始pH值对乳酸乳球菌KLDS4.0325叶酸产量的影响Fig. 4 Influence of initial medium pH on folic acid production of L. lactis KLDS4.0325
如图4所示,当培养基的初始pH值为5.2时,叶酸的产量最高,达到了(0.291±0.008)μg/mL,但与pH 6.2差异不显著(P>0.05),与其他组有显著差异,并且对比于使用未优化的M17培养基的结果(0.260 μg/mL)有显著提高,所以确定pH 5.2为培养基最佳初始pH值,进行Box-Behnken试验。
在乳酸菌合成叶酸的通路中,需要多种关键酶的参与,如GTP环化水解酶I,二氢叶酸合成酶,二氢叶酸还原酶,叶酰聚谷氨酸合酶等[21],培养基的初始pH值可能是通过影响这些关键酶的活性,影响菌株合成叶酸的速率,进而影响菌株单位时间内的叶酸产量,同时培养基的初始pH值也会影响微生物的生长繁殖[22]。Wilbert等[23]研究发现,较低的pH值有利于提高嗜热链球菌的胞外叶酸产量,从本实验的结果来看,某些乳酸乳球菌可能也具备这一特点。
2.2.4 发酵时间的影响
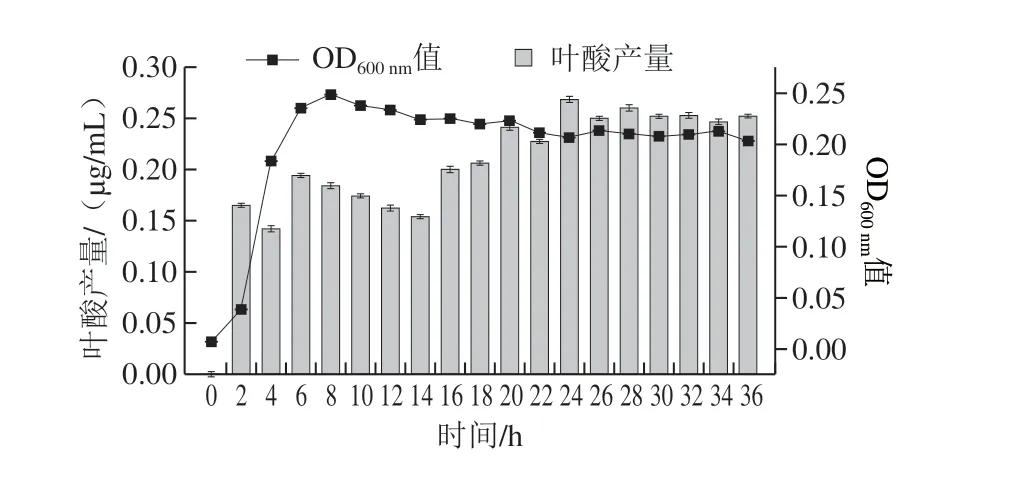
图 5 乳酸乳球菌KLDS4.0325的生长与叶酸产量曲线Fig. 5 Growth curve and folic acid production of L. lactis KLDS4.0325
如图5所示,0~2 h乳酸乳球菌KLDS4.0325的叶酸产率最高,这可能是由于菌体自身生长需要叶酸[24],刺激了叶酸合成相关基因的表达。在对数生长期时,叶酸产量略有下降,可能是因为在这一时期菌体的生长速率骤升,导致菌体消耗叶酸的速率大于合成叶酸的速率。进入稳定期后,叶酸产量不断积累,在第24小时达到最大值(0.260 μg/mL),而后略有下降。因此,在后续实验中,选择24 h为乳酸乳球菌KLDS4.0325的发酵时间。
2.2.5 发酵温度的影响
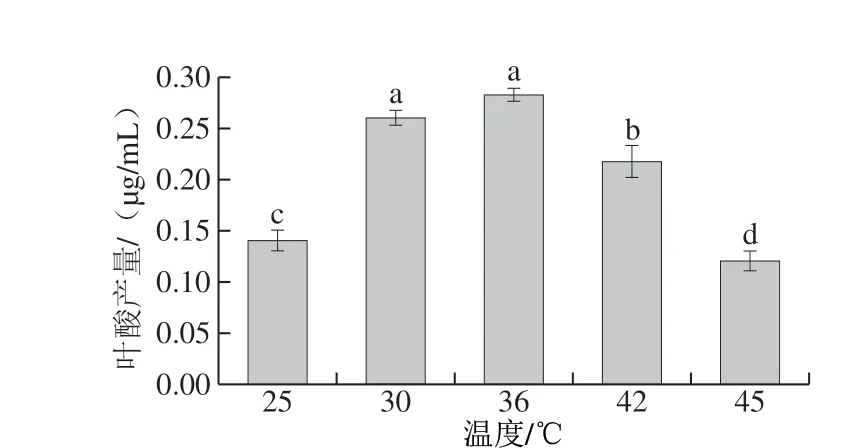
图 6 温度对乳酸乳球菌KLDS4.0325叶酸产量的影响Fig. 6 Effect of fermentation temperature on folic acid production of L. lactis KLDS4.0325
如图6所示,菌株在36 ℃恒温发酵时,叶酸的产量最高(0.283±0.006)μg/mL,但与30 ℃时无显著差异(P>0.05),与其他温度处理组具有显著差异,综合考虑,选择36 ℃为最佳发酵温度,进行Box-Behnken试验。
据报道,不同菌株产叶酸的最适温度差异较大,而且受到pH值的影响。例如,微小杆菌RB3在初始pH值为5.5、18 ℃时的叶酸产量最高,而在初始pH值为7、28 ℃时的叶酸产量最高[25]。这种现象可能是通过温度和pH值对乳酸菌生长和对酶的活性的影响而表现出来的。在后续实验中,通过响应面设计探究了初始pH值和温度对KLDS4.0325叶酸产量的影响的交互作用。
2.2.6 接种量的影响

图 7 接种量对乳酸乳球菌KLDS4.0325叶酸产量的影响Fig. 7 Effect of inoculum amount on folic acid production of L. lactis KLDS4.0325
如图7所示,在接种量为1.0%、2.0%、4.0%、6.0%的 4 组之间KLDS4.0325的叶酸产量均无显著差异(P>0.05),因此,该因素不参与响应面优化试验。
2.2.7 pABA和谷氨酸添加量的影响
pABA是乳酸菌合成叶酸的重要前提物质[26-27],尽管乳酸乳球菌KLDS4.0325合成pABA的通路是完整的[28],但Wilbert等[23]研究表明pABA是乳酸乳球菌合成叶酸的限速步骤,在培养基中添加pABA可以提高叶酸产量。
从图8A可以看出,加入适量的pABA显著提高了乳酸乳球菌KLDS4.0325的叶酸产量,当pABA添加量为 40.0 mg/L时,叶酸产量最高为(0.369±0.030)μg/mL,约是未添加pABA的1.42 倍,但与添加量为50.0 mg/L时无显著差异(P>0.05)。根据实验结果选择40.0 mg/L作为Box-Bohnken试验的中心点。
据报道,外源添加pABA可以提高乳酸菌的叶酸产量,但提高的程度和pABA添加量不同菌株有差异。张海燕[29]研究了Lactobacillus plantarumJH-M1-6-30在pABA质量浓度为20.0 mg/L时,叶酸产量达到最大值,刘友群[30]研究发现嗜酸乳杆菌CH-2在添加3% pABA的MRS液体培养基中的叶酸产量会较普通MRS培养基提高约两倍。
除了pABA外,环境中的谷氨酸也是合成叶酸及其衍生物的前体物质[31],图8B结果表明,加入适量的谷氨酸可以提高乳酸乳球菌KLDS4.0325的叶酸产量,当谷氨酸添加量为6.0 g/L时,叶酸产量最高为(0.521±0.042)μg/mL, 约是未添加谷氨酸的2 倍,但与添加量为4.0 g/L和8.0 g/L无显著差异(P>0.05)。根据实验结果选择6.0 g/L作为Box-Behnken试验的中心点。
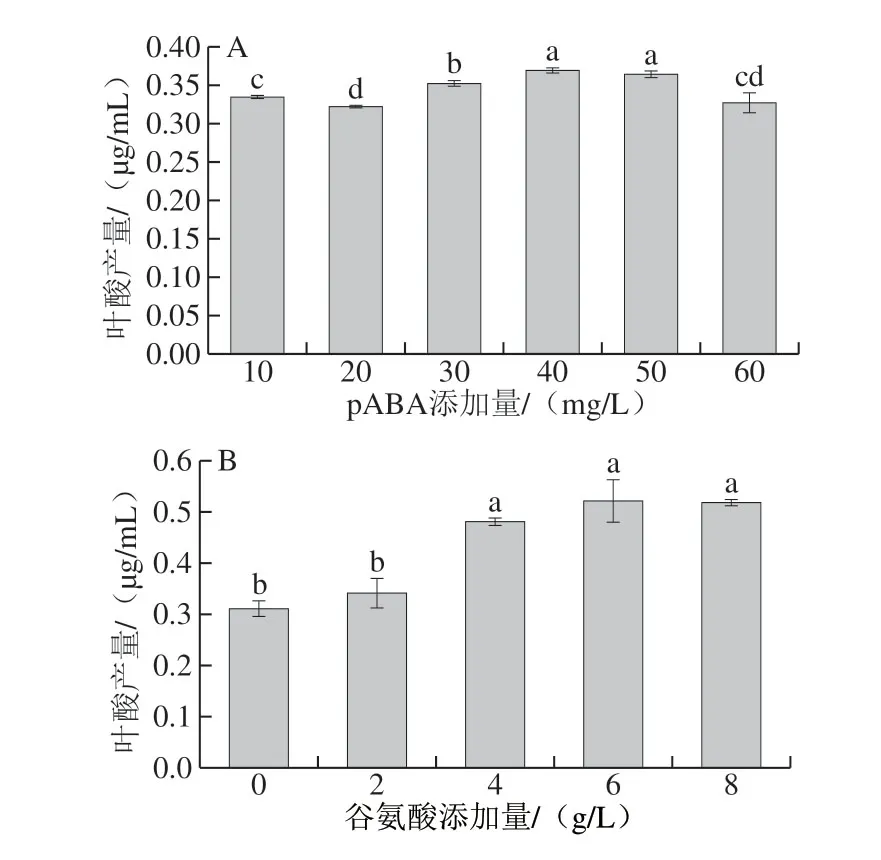
图8 pABA(A)和谷氨酸(B)添加量对乳酸乳球菌KLDS4.0325 叶酸产量的影响Fig. 8 Effect of concentration of pABA (A) and glutamate (B) on folic acid production of L. lactis KLDS4.0325
2.3 Box-Behnken响应面试验结果

表 2 Box-Behnken试验设计与结果Table 2 Box-Behnken experiment with experimental results
利用Design-Expert 8.0.6软件对发酵温度、初始pH值、pABA添加量、谷氨酸添加量设计4因素3水平的Box-Behnken试验,结果见表2,方差分析结果如表3所示。所选择的回归模型的P<0.05,表明整体模型对试验结果具有显著的影响,具有可信度;而失拟项P=0.052 6>0.05,失拟项检验不显著,说明未知因素对试验结果的影响较小,残差主要由随机误差引起,模型选择适当;该模型的相关系数R=0.957 3,校正相关系数为0.914 5,信噪比15.452>4,表明模型可信度很高。叶酸产量Y对初始pH值、pABA添加量、谷氨酸添加量、温度的多元二次回归方程为:
叶酸产量=0.80+0.19A+0.025B+0.057C-0.16D+ 0.028AB+0.020AC-0.079AD+0.034BC-0.056BD-0.088CD-0.28A2-0.086B2-0.072C2-0.25D2
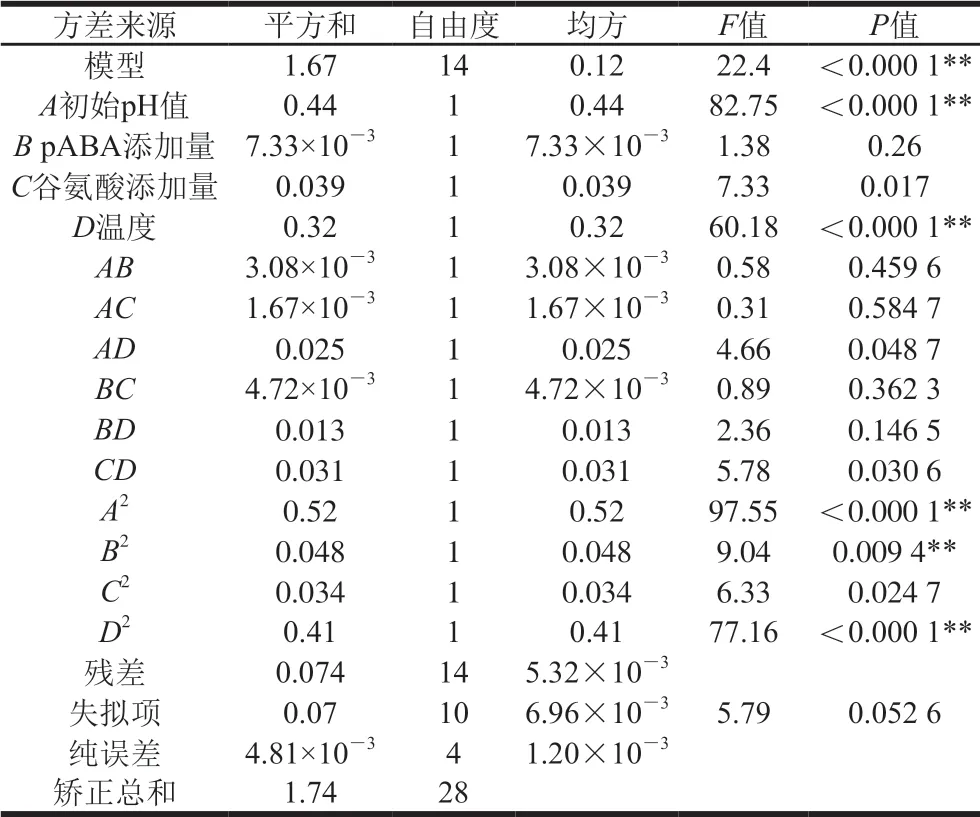
表 3 回归模型方差分析Table 3 Analysis of variance for the regression model
2.4 响应面试验结果
由回归方程所做的响应面立体图与等高线图如图9所示,主要反映了初始pH值、pABA添加量、谷氨酸添加量以及温度之间的相互作用,通过方程可知,二次项系数为负值,表明方程具有最大值。利用Design-Expert 8.0.6分析计算,最优发酵条件为初始pH 5.35、pABA添加量41.50 mg/L、谷氨酸添加量6.30 g/L、温度35.40 ℃,此时模型预测KLDS4.0325的叶酸产量为0.851 μg/mL。
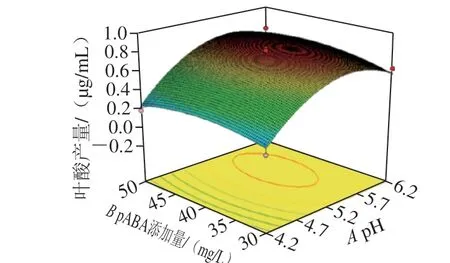

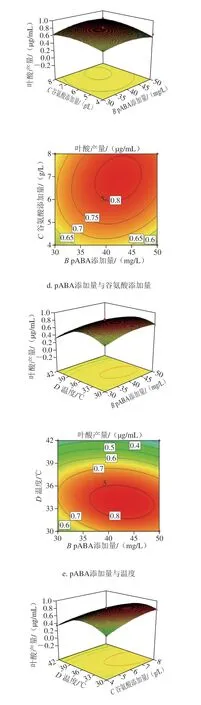

图 9 各因素交互作用的响应面与等高线图Fig. 9 Response surface and contour plots showing the interactive effects of various factors on folate production
2.5 回归模型的验证结果
根据模型优化结果,根据实际条件,设置初始pH 5.40、pABA添加量42.0 mg/L、谷氨酸添加量6.30 g/L、 温度35.40 ℃为发酵条件,对优化结果进行进一步的验证,实验重复3 次,取平均值。验证实验中KLDS4.0325叶酸产量的平均值为0.814 μg/mL,与预测值拟合度达95.65%,表明优化模型可靠。在最优发酵时间第24小时的细胞密度为2.13×109CFU/mL,在最优条件下,菌株KLDS4.0325的生长情况如图10所示。

图 10 最优条件下乳酸乳球菌KLDS4.0325的生长曲线Fig. 10 Growth curve of L. lactis KLDS4.0325 under optimal conditions
3 结 论
针对KLDS4.0325的叶酸产量,通过单因素试验,确定了M17培养基中的最佳碳源和氮源分别为葡萄糖和酵母浸粉,最佳发酵时间24 h,并筛选出了对KLDS4.0325的叶酸产量具有主要影响的4 个因素,初始pH值、pABA添加量、谷氨酸添加量和温度。利用响应面 Box-Behnken试验建立了二次多项式回归模型,最终确定发酵条件为初始pH 5.40、pABA添加量42.0 mg/L、谷氨酸添加量6.30 g/L、温度35.40 ℃,在此条件下KLDS4.0325的叶酸产量(0.814 μg/mL)比优化前(0.260 μg/mL)提高了3.13 倍。

