葡萄糖氧化酶在无孢黑曲霉中的重组 表达及酶学性质
林晓彤,潘 力,2,罗时渝,王 斌,2,
(1.华南理工大学生物科学与工程学院,广东 广州 510006;2.广东省发酵与酶工程重点实验室,广东 广州 510006)
黑曲霉(Aspergillus niger)属于丝状真菌的一种,具有旺盛的蛋白表达分泌能力以及强大的繁殖能力,普遍应用于工业重组蛋白、柠檬酸等的生产[1-2],被广泛用于重组蛋白的表达[3-5]。黑曲霉被美国美国食品药品监督管理局认证为GRAS(Generally Regarded as Safe)范围的安全菌种[6]。
葡萄糖氧化酶(EC 1.1.3.4)是一种氧化还原酶,广泛分布在自然界的微生物、植物和动物体内。当有氧气存在时,葡萄糖氧化酶可专一性地催化β-D-葡萄糖,将其分解成葡萄糖酸内酯和过氧化氢[7]。作为一种新型的绿色天然酶制剂,在食品业、医疗医药业、酿酒业、畜牧业以及纺织业等领域中应用十分广泛[8-10]。葡萄糖氧化酶最早发现于20世纪初,之后Muller[11]在黑曲霉的无细胞提取液中首次发现葡萄糖氧化酶,并对其催化机理进行较为深入的研究;Keilin等[12]首次于灰绿青霉(Penicilliumglaucum)中发现葡萄糖氧化酶。顾磊[13]使用毕赤酵母异源表达黑曲霉来源葡萄糖氧化酶,胞外酶活力达到 52 U/mL,同时通过对 HAC1、CNE1、SEC53等转录因子的改造,使酶活力达到1 972.9 U/mL,为近年来最高。
随着对葡萄糖氧化酶工业生产的研究的不断深入,其产量也不断提高,周亚凤等[14]将黑曲霉来源的葡萄糖氧化酶基因转化毕赤酵母Pichia pastoris GS115,经甲醇诱导发酵3~4 d后酶活力可达30~40 U/mL;母敬郁等[15]用黑曲霉来源葡萄糖氧化酶基因转化瑞氏木霉,其酶活力达到25 U/mL;Kapat等[16]用重组的酿酒酵母Saccharomyces cerevisiae表达葡萄糖氧化酶,酶活力达到3.17 U/mg。Gao Zhaowei等[17]采用点青霉F4的葡萄糖氧化酶基因在毕赤酵母GS115中异源表达,发酵葡萄糖氧化酶活力达到615 U/mL;陈楠等[18]在毕赤酵母SMD1168中异源表达黑曲霉PCTC的葡萄糖氧化酶基因,经筛选、产酶条件优化,最高酶活力达到32 U/mL。目前常用的高效表达菌株主要是毕赤酵母的重组改造菌[19],其通过异源表达黑曲霉来源的葡萄糖氧化酶基因达到很高的酶活力,美国Sigma公司生产的商品葡萄糖氧化酶比活力为266.82 U/mg[20]。但食品级安全的葡萄糖氧化酶工业产能仍比较低,几种食品级安全菌种都有或多或少的缺点,如黑曲霉宿主同源表达产量普遍较低且杂蛋白过多、酿酒酵母产酶糖基化修饰过多等。
针对黑曲霉本身产量低、杂蛋白多等问题,本课题利用低蛋白背景的无孢黑曲霉SH2及HL1作为宿主,以密码子优化后的黑曲霉CBS513.88来源goxC基因为基础,构建2 种启动子不同的葡萄糖氧化酶表达框,表达黑曲霉来源的葡萄糖氧化酶。通过表型板筛选、聚合酶链式反应(polymerase chain reaction,PCR)鉴定和摇瓶发酵确定葡萄糖氧化酶活力最高的转化子,以期在提高葡萄糖氧化酶产量的同时,为提高食品级安全的葡萄糖氧化酶工业产量提供理论依据和数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
大肠杆菌(Escherichia coli)Match 1T1感受态购自美国Invitrogen公司;黑曲霉菌株SH-2和HL1由本实验室改造并保存;PUC57-goxC-opt载体(含密码子偏好性优化的PCV2-cap基因)由本南京金斯瑞公司合成,表达载体pMD18-TP均由本实验室构建并保藏。
1.1.2 试剂
所有限制性内切酶(如ApaI)、DNA聚合酶 美国TaKaRa公司;NEBuilder HiFi DNA Assembly Cloning Kit 美国NEB公司;邻联茴香胺、辣根过氧化物酶 北京普博欣公司;其他试剂均为国产或进口分析纯。
1.1.3 培养基
LB培养基:1%胰蛋白胨,1% NaCl,0.5%酵母提取液;CD培养基:2%葡萄糖,0.3% NaNO3,0.2 % KCl,0.05% MgSO4·7H2O,0.1% KH2PO4,0.001% FeSO4·7H2O,2%琼脂粉,pH 5.5;发酵培养基:5%玉米淀粉,3%玉米浆,2%豆粕粉。
1.2 仪器与设备
微量移液器、高速冷冻离心机 德国Eppendorf 公司;酶标仪 美国Thermo Fisher Scientific公司;Veriti 96-Well Thermal Cycler PCR仪 美国Applied Biosystems公司;AKATA层析仪 美国通用电气公司;浸入式水平电泳系统 美国Bio-Rad公司。
1.3 方法
1.3.1 引物设计
根据PUC57-goxC-opt载体中优化后的葡萄糖氧化酶基因序列设计引物(表1)。引物对goxC1770-F/g o x C 1 8 1 8-R 用于扩增去除信号肽的g o x C 基因(GenBank:XM_001389825.2),引物对PglaA1296-F/Pgla1296-R和Pna2/tpi-F/Pna2/tpisig-R分别扩增糖化酶启动子和杂合启动子Pna2/tpi(由淀粉酶amyB基因的启动子和tpi基因的5’UTR组成),启动子3’连有糖化酶信号肽,5’具有ApaI酶切位点。
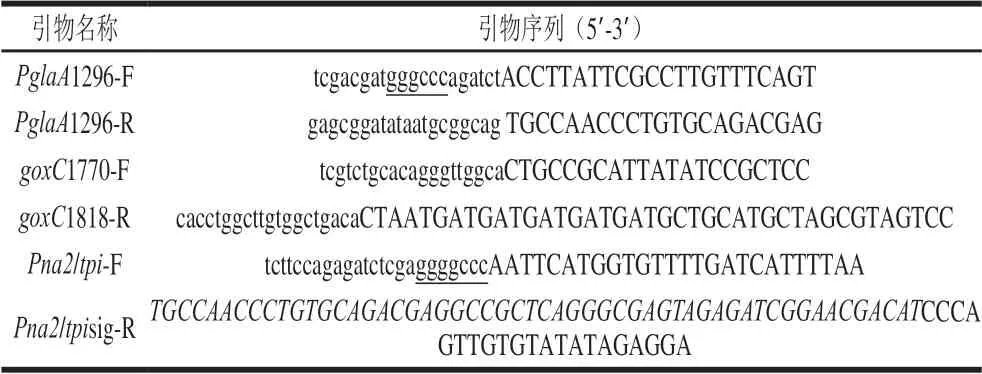
表 1 实验所用引物Table 1 Sequences of PCR primers used in this study
1.3.2 重组表达质粒的构建
以PUC57-goxC-opt载体为模板,使用特异性引物goxC1770-F和goxC1818-R扩增得到goxC基因,将目的基因goxC、启动子和改造后的pMD18线性化载体(含有筛选标记pyrG及TglaA)通过同源片段在NEB HiFi连接酶的作用下连接,转化大肠杆菌感受态细胞,经Amp抗性筛选,通过菌液电泳验证质粒大小是否正确,分别得到糖化酶启动子和杂合启动子的重组表达载体。经测序验证后,将构建正确的重组表达载体命名为pMD18-PglaAgoxC和pMD18-Pna2/tpi-goxC,如图1所示,使用ApaI单酶切线性化。
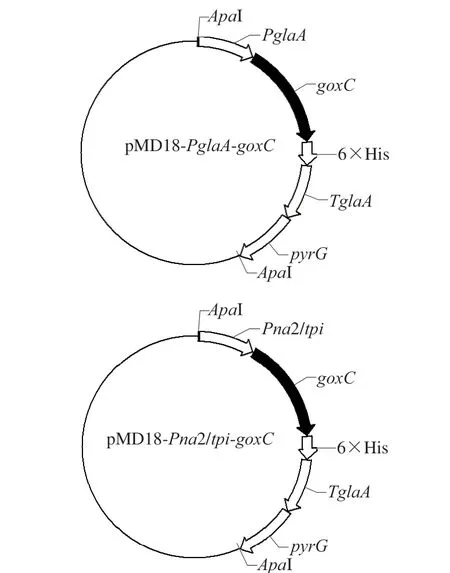
图 1 重组表达质粒pMD18-PglaA-goxC和 pMD18-Pna2/tpi-goxC的 构建图谱Fig. 1 Construction maps of pMD18-PglaA-goxC and pMD18-Pna2/tpi-goxC
1.3.3 重组表达菌株的构建
通过酶解法制备黑曲霉宿主SH2[21]和HL1的原生质体[22],将线性化的表达载体pMD18-PglaA-goxC与SH2原生质体,pMD18-Pna2/tpi-goxC与HL1原生质体相混合,利用CaCl2-聚乙二醇法诱导转化[23],涂布于高渗CD平板上30 ℃恒温培养。通过邻联茴香胺-过氧化物酶法显色和PCR定位鉴定转化子,检测goxC基因是否整合入黑曲霉宿主基因组中,得到重组菌株SH2-goxC和HL1-goxC的阳性转化子。
1.3.4 重组表达菌株的摇瓶发酵及酶活力检测
将重组菌株SH2-goxC和HL1-goxC的阳性转化子接种于液体淀粉发酵培养基中,30 ℃、250 r/min培养,按24 h间隔分别取样,8 000×g离心5 min,收集上清液。发酵液稀释至合适的倍数,用邻联茴香胺-过氧化物 酶法[24-26]检测其在540 nm波长处的吸光度,一个标准酶活力单位定义为:在45 ℃和pH 5.5条件下,每分钟将1 μmol葡萄糖分解为葡萄糖酸内酯和过氧化氢所需 的酶量[27]。
1.3.5 重组表达菌株的50 L发酵罐发酵
将构建的重组菌株SH2-goxC进行50 L发酵罐发酵。玉米淀粉8%,黄豆饼粉2%,玉米浆2%,消泡剂(聚氧乙烯聚氧丙烯季戊四醇醚)0.08%,高温淀粉酶(40 000 U/g)30 U/g。参数控制为:罐压0.05~0.06 MPa,初始罐温34 ℃,初始通风量1~6 m3/h (根据溶氧量调),转速200~800 r/min(根据溶氧量调),溶氧量前期控制在50%以上,中后期按最大通风量和转速运转,降低时补氨维持在pH 4.5。淀粉水解度降至10左右开始补料,之后控制水解度在5~10之间。
1.3.6 重组葡萄糖氧化酶的纯化和去糖基化
由于重组葡萄糖氧化酶带有6×His标签,故采用镍柱亲和层析纯化重组蛋白,重组菌株SH2-goxC经摇瓶培养7 d后,收集上清液用于纯化。使用的层析柱为HisTrapTMHP,上样量为30 mL,采用梯度洗脱法(咪唑浓度0~0.5 mol/L),流速为2.0 mL/min。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测纯化效果。同时用肽N-糖苷酶F去糖基化,再用SDS-PAGE检测。
1.3.7 重组葡萄糖氧化酶酶学特性分析
最适温度和pH值测定:在pH 5.5条件下,设置不同温度梯度25、30、35、40、45、50、55、60、65 ℃测定酶活力随温度的变化;在测得的最适反应温度条件下,测定不同pH值(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0)条件下的酶活力,以最适pH值条件下所得的酶活为100%。
在最适温度或pH值下酶活力随保温时间变化的关系:pH 5.5条件下,测在最适温度条件下保温0、1、2、3、4、5、6、7、8 h后酶液的酶活力,以保温时间0 h的酶活力为100%;最适温度条件下,将葡萄糖氧化酶置于最适pH值缓冲溶液中,测定最适温度下保存0、1、2、3、4、5、6、7、8 h后的酶活力,以保温时间0 h的酶活力为100%。
金属离子及表面活性剂对葡萄糖氧化酶活性的影响:在标准测定体系中分别加入不同金属离子及表面活性剂SDS、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)使其终浓度为10、100 mmol/L,测定酶活力,以未经处理组的酶活力为100%。
2 结果与分析
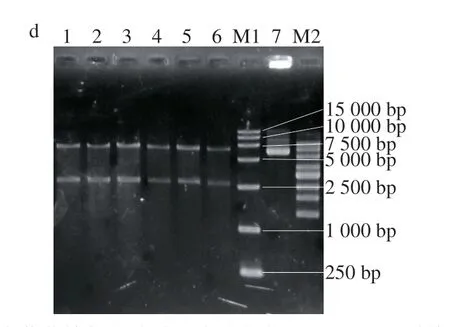
图 2 pMD18-PglaA-goxC和 pMD18-Pna2/tpi-goxC重组 表达载体转化子的验证 Fig. 2 Identification of pMD18-PglaA-goxC and pMD18-Pna2/tpi-goxC vector transformants
2.1 重组表达载体的酶切验证
pMD18-PglaA-goxC和pMD18-Pna2/tpi-goxC表达载体质粒全长分别为10 112 bp和9 623 bp,随机挑取阳性大肠杆菌转化子提取质粒,并用ApaI酶切,琼脂糖凝胶电泳验证结果如图2所示,表明挑取的大肠杆菌转化子质粒大小正确(图2a、c)。选取酶切验证正确(图2b、d)的菌株送样至Invitrogen公司测序,确定得到含有正确表达载体的大肠杆菌转化子。

2.2 重组表达菌株的筛选

图 3 SH2-goxC和HL1-goxC转化子鉴定Fig. 3 Identification of SH2-goxC and HL1-goxC transformants
先通过邻联茴香胺-过氧化物酶法显色筛选[28-29],SH2-goxC显色转化子有16 株,HL1-goxC显色转化子有5 株,使用筛选标记pyrG(1 398 bp)的扩增引物直接PCR验证重组子,琼脂糖凝胶电泳检测PCR的结果和显色筛选板如图3所示,两种转化子PCR扩增结果均为阳性,表明goxC基因成功非同源整合到宿主的基因组上。
2.3 重组表达菌株的酶活力检测结果
挑选重组菌株SH2-goxC中的4 株5、23、26、39号,以及HL1-goxC中的4 株1、4、9、10号摇瓶发酵,每24 h取发酵液上清液测葡萄糖氧化酶活力。重组菌株SH2-goxC在第7天达到最大值,如图4所示,5号表达株的葡萄糖氧化酶活力最高,可达563.8 U/mL,对照组(即宿主)无酶活力。重组菌株HL1-goxC在第3天达到最大值,如图4所示,9号表达株的葡萄糖氧化酶活力最高,可达 635.1 U/mL,对照组(即宿主)无酶活力。

图 4 SH2-goxC和HL1-goxC转化子酶活力测定Fig. 4 GOD activities of SH2-goxC and HL1-goxC transformants
2.4 重组表达菌株的50 L发酵罐发酵
选取SH2-goxC 5号转化子进行50 L发酵罐发酵。在摇瓶培养过程中,培养基的供氧不断减少,并且营养条件也不能保证菌体迅速生长。而发酵罐的连续补料、调节pH值等方式,使菌体可以快速生长。如图5所示,在179 h时,发酵酶活力达到最大,为1 128 U/mL。

图 5 SH2-goxC转化子50 L发酵罐发酵酶活力Fig. 5 GOD activity of SH2-goxC transformant in 50-L fermentor
2.5 重组葡萄糖氧化酶的纯化及去糖基化
将发酵液上清液经过亲和层析,蛋白纯化样品进行SDS-PAGE鉴定,如图6a所示。再将纯化后的葡萄糖氧化酶样品做去糖基化,如图6b所示,去糖基化后的酶样品与条带2未做去糖基化处理的酶样品相比大小降了20 kDa左右,由此可见重组葡萄糖氧化酶是糖蛋白。
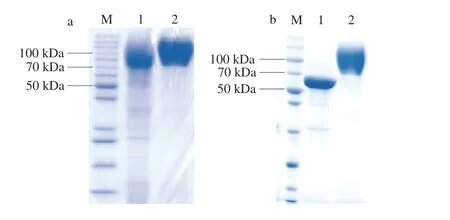
图 6 葡萄糖氧化酶表达的SDS-PAGE检测结果Fig. 6 SDS-PAGE analysis of the expression of GOD
2.6 葡萄糖氧化酶酶学性质
2.6.1 温度对纯化后重组葡萄糖氧化酶活力的影响
葡萄糖氧化酶在4 5 ℃时酶活力最高,而且在35~50 ℃时酶活力较稳定(图7a);将酶液置于最适温度下测定葡萄糖氧化酶活力,随着保温时间的延长,酶活力在0~2 h略微稳定,2 h之后酶活力略微下降,到了3 ~4 h 时趋于稳定,4 h 后急剧下 降(图7b)。
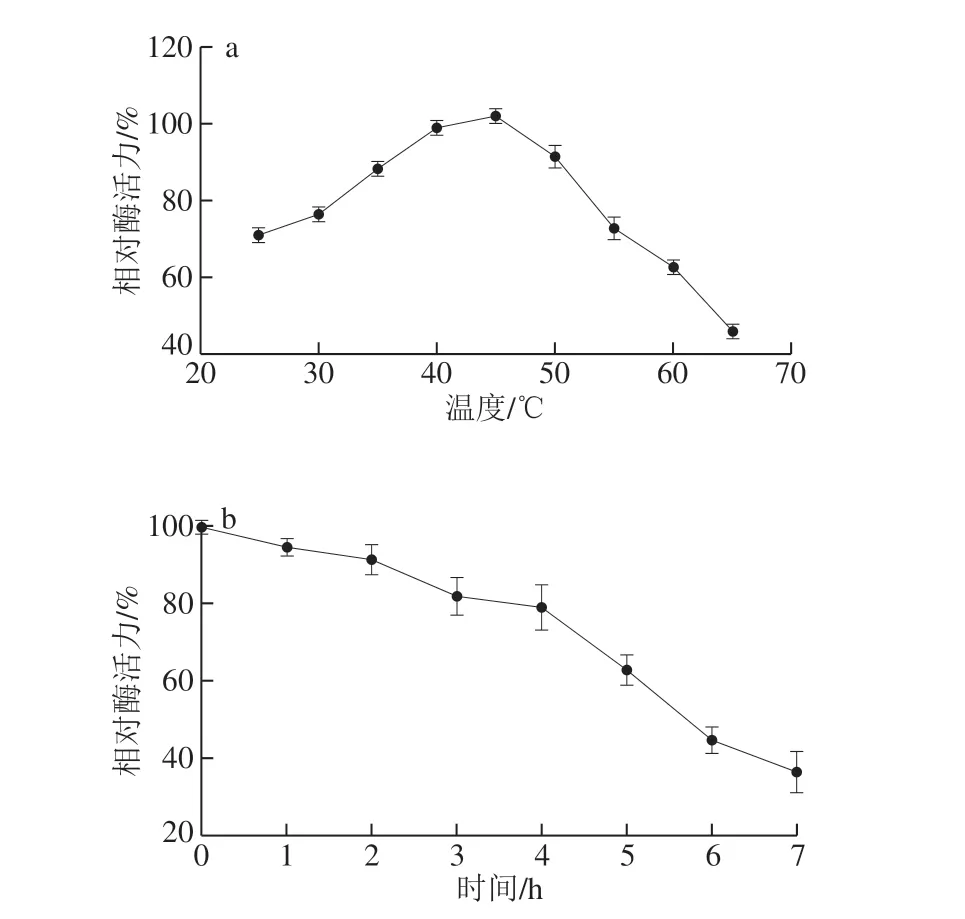
图 7 温度对纯化后重组葡萄糖氧化酶活力的影响Fig. 7 Effects of temperature on the activity of purified recombinant GOD
2.6.2 pH值对纯化后重组葡萄糖氧化酶活力的影响
葡萄糖氧化酶在pH 5.5时酶活力最高,而且在pH 4.5~5.5时酶活力较稳定(图8a);将酶液置于最适pH值下测定葡萄糖氧化酶的酶活力,随着保温时间的延长,酶活力在0~2 h略微下降,2 h之后酶活力急剧下降,到了3 h后稳定下降(图8b)。

图 8 pH值对纯化后重组葡萄糖氧化酶活力的影响Fig. 8 Effects of pH on the activity of purified recombinant GOD
2.6.3 金属离子及化学试剂对重组酶的影响
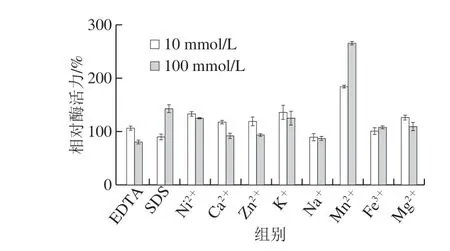
图 9 金属离子及表面活性剂对葡萄糖氧化酶活力的影响Fig. 9 Effects of metal ions and surfactants on the activity of GOD
图9表明,在10 mmol/L浓度下,Ni2+、Ca2+、K+、 Zn2+、Mg2+增加葡萄糖氧化酶的活性,其中Ca2+、Zn2+大约能提高葡萄糖氧化酶活力20%,Mg2+大约能提高葡萄糖氧化酶活力25%,Ni2+、K+大约能提高葡萄糖氧化酶活力30%;EDTA、Fe3+对葡萄糖氧化酶活力影响很小;SDS或Na+明显降低葡萄糖氧化酶活力。在100 mmol/L浓度下,SDS、Ni2+、K+增加葡萄糖氧化酶活力,提高葡萄糖氧化酶活力30%~50%;EDTA、Na+明显降低葡萄糖氧化酶活力;Ca2+、Zn2+、Fe3+、Mg2+对葡萄糖氧化酶活力影响很小。Mn2+在10 mmol/L及100 mmol/L浓度下,均对葡萄糖氧化酶活力有较大提升,在10 mmol/L浓度下提高葡萄糖氧化酶活力80%,在100 mmol/L浓度下酶活力达到标准酶活力的270%。
3 讨 论
黑曲霉作为重组蛋白表达的重要宿主,具有蛋白分泌量大、可进行蛋白翻译后修饰及高生物安全性等 优点[30]。本研究通过密码子优化、信号肽替换,优化黑曲霉CBS513.88来源goxC基因,并分别以糖化酶启动子和杂合启动子,glaA糖化酶终止子作为表达载体元件,pyrG为双向筛选标记,构建葡萄糖氧化酶重组表达载体,经过非同源重组分别转化黑曲霉SH2和HL1,使葡萄糖氧化酶基因得以高效表达。通过表型板筛选、PCR鉴定选出成功转化的重组葡萄糖氧化酶菌株,测定发酵上清液的酶活力,选出重组表达酶活力最高的转化子菌株SH2-goxC 5号和HL1-goxC 9号,分别达到563.8 U/mL和658.3 U/mL,并将SH2-goxC 5号上罐发酵,酶活力最高达到1 128 U/mL,提高了1 倍以上。对重组葡萄糖氧化酶进行亲和层析纯化,SDS-PAGE鉴定显示蛋白分子质量大小在80 kDa左右,经过去糖基化验证得到蛋白分子质量大小为65 kDa左右,表明重组葡萄糖氧化酶具有糖基化位点。同时验证了温度、pH值对葡萄糖氧化酶活力的影响,葡萄糖氧化酶在pH 5.5时酶活力最高,而且在pH 4.5~5.5时酶活较稳定;葡萄糖氧化酶在温度45 ℃时酶活力最高,30~50 ℃时酶活力较稳定。
本研究结果为食品级安全葡萄糖氧化酶的工业发酵表达量的提高提供了理论依据和数据支持。后续可以进一步研究黑曲霉宿主的改造以及葡萄糖氧化酶的定点突变研究,以得到酶活力更高的黑曲霉菌株。

