灯银脑通胶囊降血脂作用及其机制的初步探索
随着我国居民生活水平的提高及人口老龄化加剧,高脂血症的发病率呈明显上升趋势。高血脂是诱发心脑血管疾病的主要危险因素,同时可以引起高血压、高血糖、肝功能损伤等疾病[1]。目前,临床上治疗高脂血症的药物主要为他汀类药物,这类药物主要通过抑制3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)还原酶活性实现降血脂的作用[2]。HMG-CoA还原酶主要催化细胞胆固醇合成过程中的限速反应,是胆固醇合成最重要的酶之一。由于斑马鱼的组织器官与人类的器官在结构、生理、分子水平等方面高度相似,加之斑马鱼基因组与人类的基因组高度保守,斑马鱼已经被作为多种人类疾病模型广泛用于药物筛选[3-4]。灯银脑通胶囊是治疗心脑血管疾病的药物,在前期1项灯银脑通胶囊用于治疗血管性认知功能障碍的临床研究中发现,病人服用灯银脑通胶囊后总胆固醇、三酰甘油、低密度脂蛋白等指标均有不同程度的降低[5]。因此,为了深入研究灯银脑通胶囊降血脂的作用及机制,本研究采用斑马鱼高血脂模型来评价灯银脑通胶囊的降血脂作用,并通过相应的体外酶促反应平台探索其作用机制。
1 材料与方法
1.1 药物和试剂 灯银脑通胶囊(规格:每粒0.26 g粉末,药用成分0.098~0.100 g,批号:16FL,昆药集团股份有限公司),临用时胶囊内粉末用二甲基亚砜(DMSO)配制成100 mg/mL母液备用;洛伐他汀原料药(大连美仑生物技术有限公司,批号:20111002);蛋黄粉(北京天元,批号:20120612);油红O(批号:20120411)、DMSO(批号:BCBH5215V)均购自美国Sigma公司;HMG-CoA还原酶抑制剂筛选试剂盒(美国Biovision公司,批号:2I150588)。
1.2 仪器 解剖显微镜(SZX7,OLYMPUS,日本);与显微镜相连的相机(TK-C1481EC,JVC,日本);精密电子天平(CP214,OHAUS,美国);全波长酶标仪(SynergyM.HT,BioTek,美国)。
1.3 实验动物 5 dpf黑色素等位基因突变型半透明Albino系斑马鱼,由杭州环特生物科技股份有限公司提供,实验动物使用许可证号为:SYXK(浙)2012-0171,饲养管理符合国际实验动物评估和认可委员会(AAALAC)认证的要求。
1.4 方法
1.4.1 药物最大耐受浓度测定 斑马鱼幼鱼于六孔板中培养至5 dpf后,用灯银脑通胶囊以水溶给样方式处理,浓度分别为10 μg/mL、25 μg/mL、50 μg/mL、100 μg/mL、250 μg/mL和500 μg/mL,同时以养鱼用水处理正常斑马鱼为正常对照组,在28 ℃培养箱中处理72 h。统计各组斑马鱼的死亡数量与毒性情况,确定灯银脑通胶囊的最大耐受浓度。
1.4.2 模型构建与干预方法 用蛋黄粉喂饲Albino品系5 dpf斑马鱼72 h,诱发斑马鱼高血脂模型[6],油红O染色观察血液染色强度来判断造模是否成功;成模后用不同浓度的灯银脑通胶囊处理72 h,每个浓度处理30尾。阳性对照组给予洛伐他汀0.081 μg/mL,同时设置模型对照组。
1.5 观察指标 比较各组降血脂作用、HMG-CoA还原酶活性
1.5.1 降血脂作用 处理结束后,用油红O进行染色,染色后每个实验(浓度)组随机选取10尾斑马鱼在解剖显微镜下拍照并采集数据,用Image-Pro Plus 6.0软件进行图像分析,计算斑马鱼尾部血管血脂光密度总和(S),灯银脑通胶囊血脂降低率计算公式:
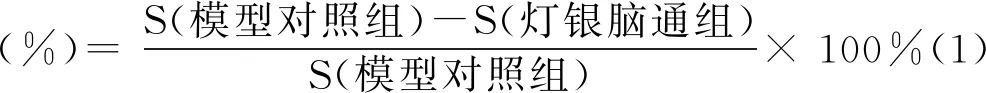
1.5.2 HMG-CoA还原酶活性 体内胆固醇合成限速反应式为:
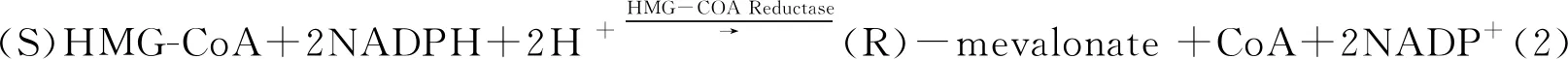
在这个反应过程中,NADPH被氧化成为NADP+,NADPH在紫外线(UV)波长340 nm下有吸收峰,但是其氧化产物NADP+在此波长下却没有吸收峰,因此通过定量加入底物NADPH,检测反应前后反应体系在340 nm的OD值变化来判断NADPH的消耗量。在反应体系中加入待筛选药物,若药物对HMG-CoA还原酶具有抑制作用,则340 nm吸收值不会下降,药物对HMG-CoA还原酶的抑制作用越强,HMG-CoA还原酶酶解底物的速率越慢,OD值下降得越缓慢,根据药物测定孔、标准加酶孔在酶促反应线性范围内两个时间点OD值的差异(-△A340 nm),换算其抑制率。抑制率计算公式为:
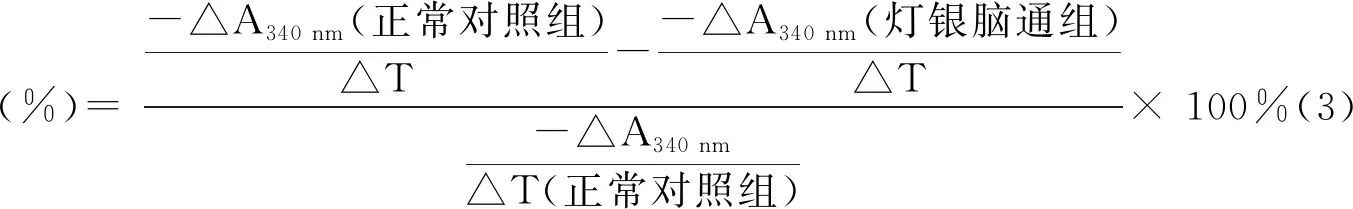
本研究中选择的灯银脑通胶囊反应浓度分别为100 μg/mL、200 μg/mL、400 μg/mL,阳性对照为0.116 μg/mL的洛伐他汀,按照试剂盒说明书进行检测。
1.6 统计学处理 采用方差分析(软件GraphPad Prism 5)、Dunnett′st检验、Fisher LSD分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 药物最大耐受浓度测定 灯银脑通胶囊在250 μg/mL和500 μg/mL浓度时,死亡率均为100%,在10 μg/mL、25 μg/mL、50 μg/mL和100 μg/mL浓度时,均不诱发斑马鱼死亡和明显毒性表型。因此,确定斑马鱼对灯银脑通胶囊的最大耐受浓度为100 μg/mL。详见表1。
表1不同浓度灯银脑通对斑马鱼的致死率
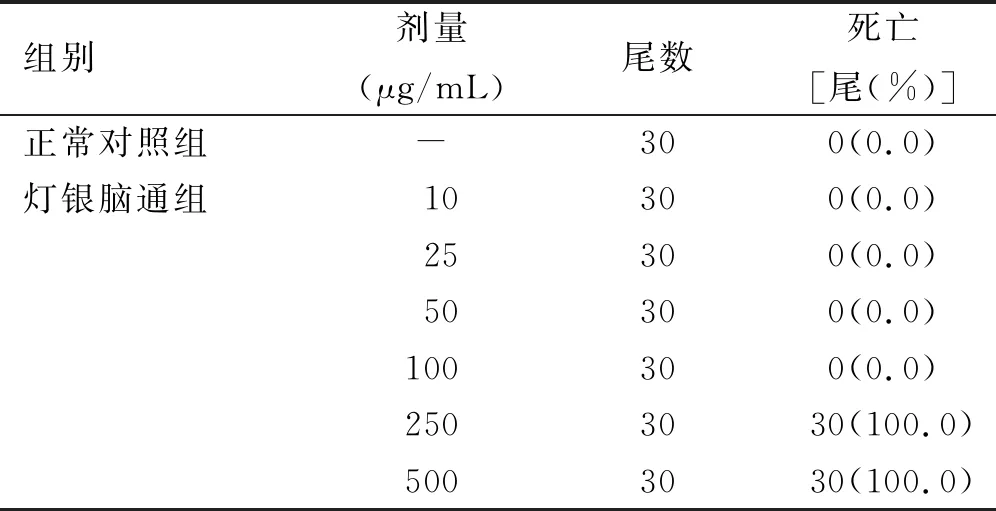
组别剂量(μg/mL)尾数死亡[尾(%)]正常对照组-300(0.0)灯银脑通组10 300(0.0)25300(0.0)50300(0.0)100300(0.0)2503030(100.0)500 3030(100.0)
2.2 斑马鱼高脂模型建立结果 用蛋黄粉饲喂斑马鱼,使其血液中的脂肪含量迅速升高,油红O染色后脂肪呈红色,从而建立斑马鱼高血脂模型,油红O染色结果详见图1。

图1 油红O染色结果
2.3 灯银脑通胶囊对斑马鱼的降血脂效果 通过对灯银脑通胶囊1.875~33.300 μg/mL 5个浓度的降血脂效果比较,在3.750~11.100 μg/mL浓度范围内斑马鱼血脂水平显著降低(P<0.05),且在7.500 μg/mL时降血脂效果最高,血脂降低率达44%。而随着灯银脑通胶囊浓度增加至33.300 μg/mL时,斑马鱼血脂降低率反而下降,因此提示灯银脑通胶囊在3.750~11.100 μg/mL浓度条件下对蛋黄粉诱发的斑马鱼高血脂模型具有降血脂作用。详见图2、表2。
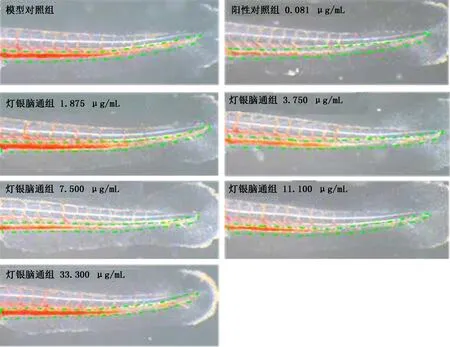
图2 灯银脑通处理后尾部血管染色结果

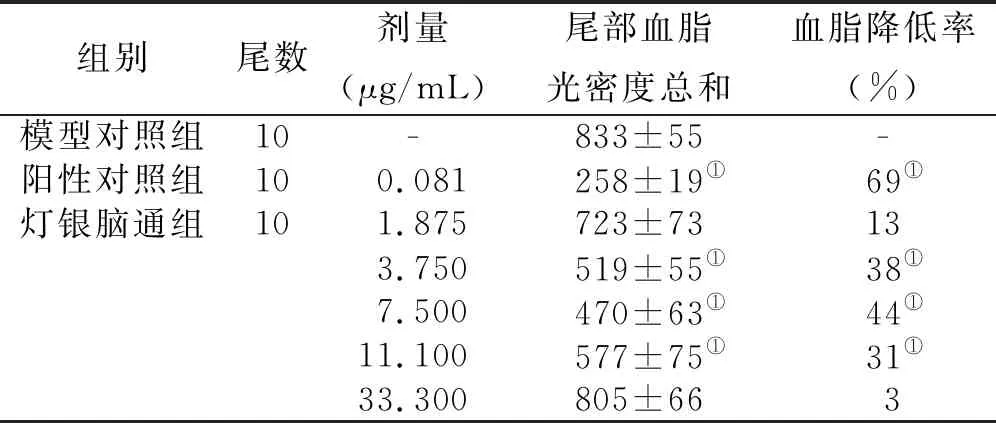
组别尾数剂量(μg/mL)尾部血脂光密度总和血脂降低率(%)模型对照组10-833±55-阳性对照组100.081 258±19①69①灯银脑通组101.875723±73133.750519±55①38①7.500470±63①44①11.100577±75①31①33.300 805±663
与模型对照组比较,① P<0.05。
2.4 灯银脑通胶囊对HMG-CoA还原酶活性的影响 灯银脑通浓度在200 μg/mL、400 μg/mL时对HMG-CoA还原酶的活性具有一定的抑制作用,且与正常对照组比较差异有统计学意义(P<0.05)。详见图3。

注:与正常对照组比较,*P< 0.05,# P< 0.001。
3 讨 论
高脂血症是由于体内脂质代谢异常引起的一种疾病,由其导致的并发症严重危害人类健康甚至生命。体内脂质代谢主要由内源性脂质合成、外源性脂质吸收、胆汁酸重吸收等多种相关靶点调控[7],HMG-CoA还原酶是其中的靶点之一,也是降血脂药物研究中最经典的靶点。目前临床上应用最广泛的HMG-CoA还原酶抑制剂为他汀类药物,此类药物在降血脂方面效果良好[8]。但是长期服用他汀类药物,仍存在一些不良反应,如血糖异常、肝酶异常、记忆和认知障碍等[9]。近年来,大量研究证实中药在降脂方面有其独特的优势,药源丰富,不良反应少;成分复杂,在体内可以通过多途径多靶点发挥降血脂作用,临床疗效明确且显著[10-11]。因此,中药降脂逐渐被临床医生和病人认可,且临床应用前景广阔。灯银脑通胶囊为中药组合物,主要由灯盏细辛、银杏叶、三七和满山香四味中药组成,有研究表明灯盏细辛、银杏叶、三七均有不同程度的降血脂作用[12-14],但由于药用成分比较复杂,作用靶点尚未明确。
斑马鱼作为一种新兴的模式生物,弥补了哺乳动物没有或难做的模型,打破了药物研发中的动物模型瓶颈。斑马鱼高血脂模型用于降血脂研究已有大量文献报道[15-16],该方法操作便捷、实验周期短、稳定可靠。本研究中,灯银脑通胶囊对斑马鱼降血脂的作用呈现“量增而效先增后减”的量效关系[17],即在7.500 μg/mL时对斑马鱼的降血脂作用达到最高,而随浓度升高,降脂作用反而下降,原因可能有以下几点:①与靶点的亲和力,随浓度升高,灯银脑通胶囊有效成分与其他靶点结合的亲和力较强,和降血脂靶点结合减弱;②成分之间的拮抗作用,由于灯银脑通胶囊成分比较复杂,浓度升高到一定程度时,其他成分与起降血脂作用的有效成分产生拮抗作用,使得降血脂作用被抵消,最终导致灯银脑通胶囊降血脂作用降低;③灯银脑通胶囊的一些成分可能影响药物在体内的吸收、代谢和作用,剂量越高对药效影响越大。因此,本研究为临床降血脂研究中灯银脑通胶囊的药物浓度选择和质量控制提供了理论依据。体外酶促反应结果表明HMG-CoA还原酶可能是灯银脑通胶囊降血脂的作用靶点之一,但由于其成分复杂,且体内调控脂质代谢的靶点较多,推测灯银脑通胶囊对其他靶点可能也有一定的调节作用。本研究是暨灯银脑通胶囊上市以来首个通过规范的动物模型和酶学模型对药物的药效学进行系统的评价,后续将循靶点药理学理论对灯银脑通胶囊降血脂的分子机制做进一步的研究。本研究也为灯银脑通胶囊的临床推广奠定了理论基础。

