糖基化终末产物诱导内皮微颗粒释放
陈英华,冯 波
血管内皮细胞在受到损伤时,发生细胞膜受损及部分细胞膜脱落,进而形成外泌的膜性小囊泡,即内皮微颗粒 (endothelial microparticle, EMP)[1]。目前临床观察性研究[1-4]显示,患有血管相关性疾病如糖尿病、冠心病、高血压、代谢综合症、高脂血症等的患者外周循环EMP水平明显增高,同时体外实验提示EMP具有抑制内皮舒张功能,促进氧化应激发生,使内皮细胞损伤增加等作用[1-5]。因此EMP不仅是血管损伤的生物学标记,其本身也参与血管损伤,故探索EMP产生机制尤为重要。糖基化终末产物(advanced glycation end products,AGEs)是持续高血糖引起体内多种蛋白质和脂类非酶糖基化后生成的多种不同物质的统称,是糖尿病患者的特点,其在糖尿病血管病变中起至关重要作用[6]。该课题拟探索AGEs对EMP分泌的影响及机制。
1 材料与方法
1.1 实验试剂与仪器胎牛血清白蛋白、D-葡萄糖、胎牛血清、EBM-2细胞培养液、0.8 μm微球、3 μm微球购自美国Sigma-Aldrich公司;抗RAGE抗体、N-乙酰半胱氨酸购自美国Abcam公司; CD31-FITC、同型对照抗体IgG1-FITC、RAGE抗人单克隆抗体、GAPDH抗人单克隆抗体购自美国BD公司;反转录试剂盒、DCFH-DA购自美国Invitrogen公司;SYBR Green RT-PCR试剂盒购自日本Takara公司。荧光分光光度计F98购自上海棱光技术有限公司;流式细胞仪FACSCalibur购自美国BD公司。
1.2 方法
1.2.1制备 将胎牛血清白蛋白与D-葡萄糖溶于PBS(pH 7.2~7.4)溶液中,使其终浓度分别为50 g/L和500 mmol/L,以0.22 μm一次性过滤器过滤除菌,于隔水式恒温培育箱中37 ℃孵育12周。实验前用pH为7.2~7.4的PBS透析,除去未结合的葡萄糖,使透析液中的葡萄糖浓度小于0.03 mmol/L。同时在荧光分光光度计上以激发波长为370 nm测定荧光强度,在440 nm处获得最大吸收峰,证实生成为AGEs。制备完毕的蛋白经低温风干后4 ℃保存。
1.2.2人脐静脉内皮细胞干预 无菌条件下取新
生儿脐带,采用胰酶消化法获取内皮细胞,用2%胎牛血清、EBM-2细胞培养液,于37 ℃ 、5% CO2培养箱内培养人脐静脉内皮细胞。取第3~4代人脐静脉细胞按1.0×105/孔的浓度加入预铺胶原的6孔板,无血清培养基培养3~5 h后。根据实验分组如下:① 对照组;② 100 μg/ml AGEs组:加100 μg/ml AGEs干预;③ 200 μg/ml AGEs组:加200 μg/ml AGEs干预;④ 400 μg/ml AGEs组:加400 μg/ml AGEs干预。以上四组分别培养12 h与24 h。⑤ 抗糖基化终末产物受体(receptor for advanced glycation end products, RAGE)抗体组:预先加入5 μg/ml抗RAGE抗体处理内皮细胞6 h,再予400 μg/ml AGEs干预内皮细胞24 h;⑥ 活性氧 (reactive oxygen species, ROS)清除剂组:预先加入10 μmol/L ROS清除剂:N-乙酰半胱氨酸预处理6 h,再予400 μg/ml AGEs干预内皮细胞24 h。本研究经同济大学附属东方医院伦理委员会批准,并获得受试者知情同意。
1.2.3流式细胞仪检测内皮微颗粒 收集细胞上清液进行离心:先常温4 300 r/min离心 5 min,再10°、200 000 r/min 离心120 min,最后取得沉淀物,用50 μl PBS重悬,加3 μl CD31-FITC 抗体或 3 μl 同型对照抗体IgG1-FITC。室温避光下孵育20 min,然后加入1 ml PBS,即可加样流式细胞仪检测。采用流式细胞仪FACSCalibur测定各样本荧光信号,检测时采用0.8 μm微球作为内参帮助内皮微颗粒定门,加进3 μm微球用于内皮微颗粒计数。同时采用同型对照消除抗体非特异性结合,减少背景噪音。测定前清理流式细胞仪的管道,所用的流式管、移液管头均经高压灭菌,PBS经0.22 μm过滤器过滤,排除杂质、细菌的影响。EMP定义为CD31+颗粒[7]。
1.2.4荧光定量RT-PCR检测 各组内皮细胞总RNA采用TRIzol法提取;应用反转录试剂盒(Applied Biosystems)将mRNA反转录为cDNA。以GAPDH作为内参照基因。引物序列如下: RAGE:Forward primer 5′-GAAACTGAACACAGGCCGGA-3′;Reverse primer 5′-CACGGACTCGGTAGTTGGAC-3′;GAPDH:Forward primer 5′-TCATCAGCAATGCCTCCTGTACCA-3′;Reverse primer 5′-TATTTGGCAGGTTTCTCCAGACGG-3′。应用SYBR Green RT-PCR试剂盒进行扩增,对各组细胞的靶基因表达进行检测。反应条件为:95 ℃(变性30 s),60 ℃ (退火30 s),70 ℃(拉伸15 s)循环40次;反应结束后,计算得出Ct值,计算RAGE基因的Ct值与GAPDH Ct值的差值ΔCt,以2-ΔΔCt作为RAGE mRNA的相对含量。
1.2.5Western blot检测 细胞裂解液提取各组内皮细胞蛋白,BCA法测定各组蛋白浓度。采用SDS-PAGE凝胶进行蛋白电泳,转至PVDF膜上,5%脱脂奶粉室温封闭1 h,加入一抗(1 ∶500)(RAGE抗人单克隆抗体、GAPDH抗人单克隆抗体)4 ℃孵育过夜,室温孵育二抗(1 ∶5 000)1 h,加入ECL显影剂并在显影仪中得到蛋白条带,计算条带的灰度值,最后以GAPDH为内参照,计算靶蛋白的相对表达量。
1.2.6流式细胞仪检测ROS水平 收集细胞后悬浮于稀释好的终浓度为10 μmol/l的DCFH-DA染液中,37 ℃细胞培养箱内孵育20 min。PBS洗涤、离心细胞3次,以充分去除未进入细胞内的DCFH-DA,流式细胞仪检测FACSCalibur。
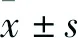
2 结果
2.1 AGEs诱导内皮微颗粒释放不同浓度AGEs干预内皮细胞12、24 h,流式细胞仪检测EMP。如图1所示,无论是干预12 h还是干预24 h,均观察到AGEs诱导内皮细胞释放EMP (12 h组:F=27.5,P<0.05; 24 h组:F=42.7,P<0.05)。EMP水平与AGEs干预时间相关性不大(P>0.05)。
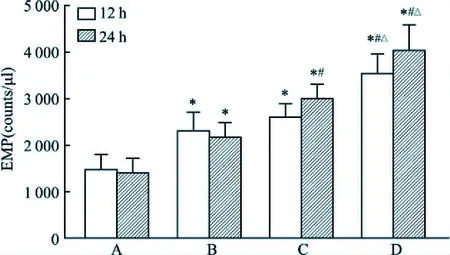
图1 AGEs浓度依赖诱导EMP释放A:对照组;B:100 μg/ml AGEs组;C:200 μg/ml AGEs组;D:400 μg/ml AGEs组;与对照组比较:*P<0. 05;与100 μg/ml AGEs组比较:#P<0.05;与200 μg/ml AGEs组比较:△P<0.05
2.2 AGEs/ RAGE参与EMP释放根据上述的实验结果,AGEs干预时间对EMP释放影响较小,故只对干预24 h的实验分组进行RAGE表达检测。RT-PCR结果显示,AGEs干预内皮细胞后,RAGE mRNA 与对照组相比明显增高,见图2。Western blot结果显示,AGEs干预内皮细胞后,RAGE蛋白表达与对照组相比明显增高,见图3。预先予抗RAGE抗体预处理400 μg/ml AGEs组,观察到RAGE mRNA表达明显受抑制(400 μg/ml AGEs组vs抗RAGEs+400 μg/ml AGEs组:t=11.1,P<0.01),见图2;RAGE 蛋白表达亦下降(400 μg/ml AGEs组vs抗RAGEs+400 μg/ml AGEs组:t=4.9,P<0.01),见图3;同时伴随EMP水平下降(400μg/ml AGEs组vs抗RAGEs+400 μg/ml AGEs组:t=5.3,P=0.01),见图4。提示RAGE参与EMP产生。
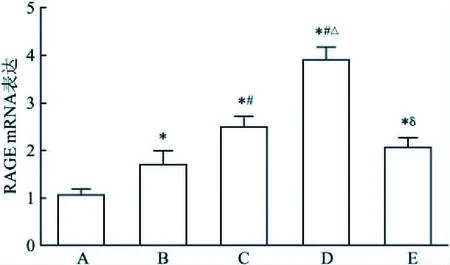
图2 AGEs干预内皮细胞引起RAGE mRNA表达变化A:对照组;B:100 μg/ml AGEs组;C:200 μg/ml AGEs组;D:400 μg/ml AGEs组;E:抗RGAE+400 μg/ml AGEs;与对照组比较:*P<0.05;与100 μg/ml AGEs组比较:#P<0.05;与200 μg/ml AGEs组比较:△P<0.05;与400 μg/ml AGEs组比较:δP<0.05
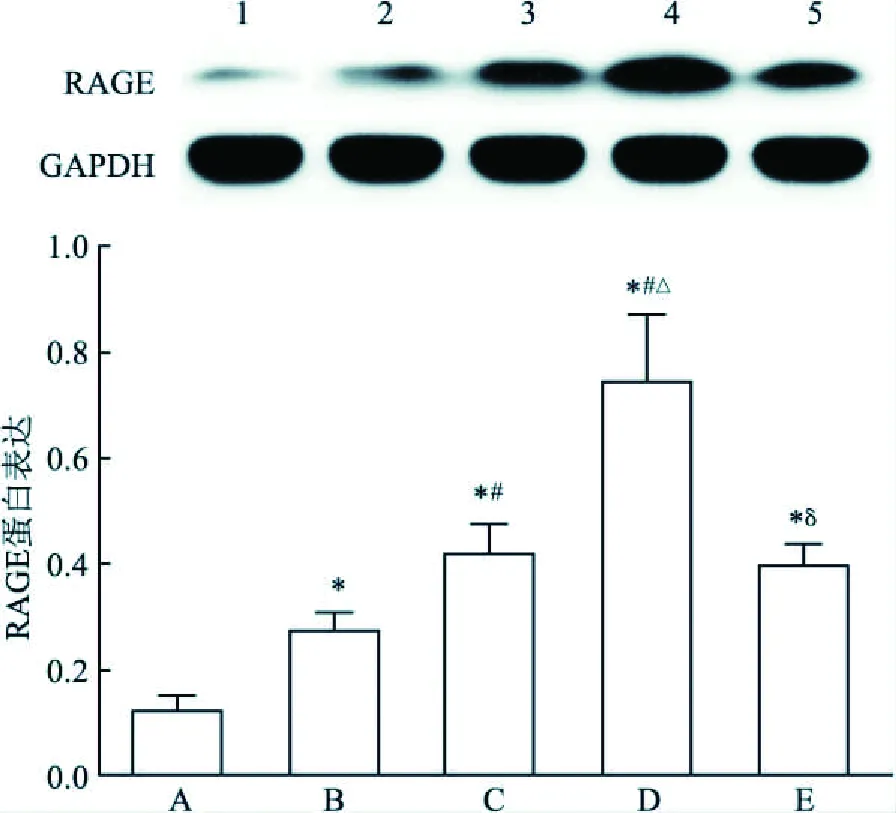
图3 AGEs干预内皮细胞引起RAGE 蛋白表达变化A:对照组;B:100 μg/ml AGEs组;C:200 μg/ml AGEs组;D:400 μg/ml AGEs组;E:抗RAGE+400 μg/ml AGEs组;与对照组比较: *P<0.05;与100 μg/ml AGEs组比较:#P<0.05;与200 μg/ml AGEs组比较:△P<0.05;与400 μg/ml AGEs组比较:δP<0.05
2.3 ROS参与EMP释放AGEs干预内皮细胞,ROS的水平随之发生变化,如表1所示,AGEs以浓度依赖方式增高ROS水平,其中在400 μg/ml AGEs组,ROS水平亦与干预时间呈正相关(t=5.6,P<0.05),但其他组间未发现干预时间与ROS相关。预先加入抗RAGE抗体处理内皮细胞,再予400 μg/ml AGEs干预细胞24 h后,其ROS表达水平下降(400 μg/ml AGEs组vs抗RAGE+400 μg/mlAGEs组:t=3.3,P=0.03),见表1,伴随EMP水平下降(t=5.3,P=0.001),见图4。预先予ROS清除剂处理400 μg/ml AGEs 组,再予400 μg/ml AGEs干预细胞24 h后,亦观察到ROS表达水平下降(400 μg/ml组vs抗ROS+400 μg/mlAGEs组:t=5.1,P=0.007),见表1,同时EMP水平下降(400 μg/ml组vs抗ROS+400 μg/mlAGEs组:t=7.1,P=0.001),见图4。提示ROS作为AGEs与RAGE下游因子,参与EMP释放。
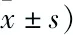
表1 人脐静脉内皮细胞ROS水平(平均荧光强度,
与对照组比较:*P<0.05;与100 μg/ml AGEs组比较:△P<0.05;与200 μg/ml AGEs组比较:#P<0.05;与12 h 400 μg/ml AGEs组比较:▲P<0.05;与24 h 400 μg/ml AGEs组比较:δP<0.05
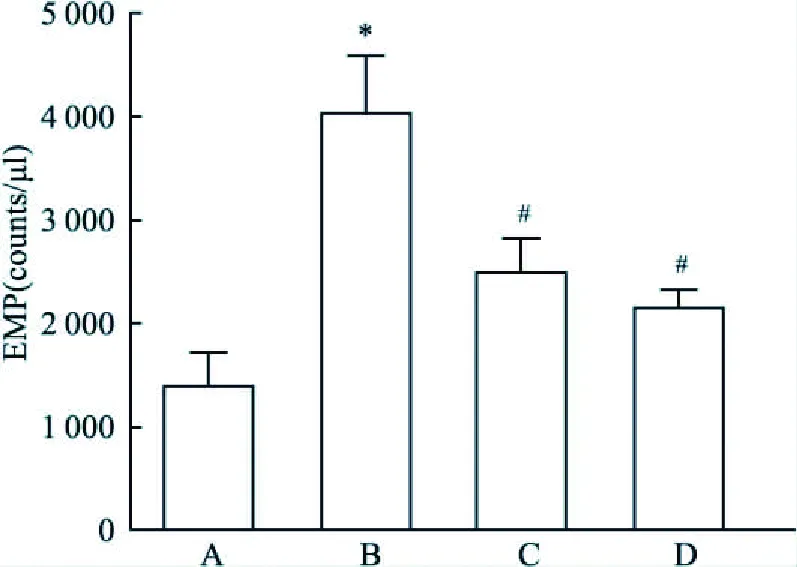
图4 抗RAGE抗体及ROS清除剂对AGEs诱导EMP释放影响A:对照组;B:400 μg/ml AGEs组;C:抗RAGE+400μg/ml AGEs组;D:ROS清除剂+400 μg/ml AGEs组;与对照组比较:*P<0.05;与400 μg/ml AGEs组比较:#P<0.05
3 讨论
我国糖尿病发病率逐步增长,大血管病变作为糖尿病的常见并发症,对糖尿病患者的健康带来严重影响。动脉粥样硬化是糖尿病大血管病变的基本病理改变,而内皮损伤是重要始动环节[8]。血管内皮细胞在受到损伤时,发生细胞膜受损及部分细胞膜脱落,进而形成EMP[1]。在众多与内皮损伤相关的疾病研究中,均观察到外周循环EMP明显升高,如糖尿病、冠心病等[1]。同时体外实验提示EMP能抑制内皮细胞增殖、血管形成,影响内皮舒张功能,促进氧化应激发生,使内皮细胞凋亡、损伤增加等作用[1-5]。目前证实多种炎症因子能诱导EMP的产生,如C反应蛋白、血管紧张素Ⅱ、肿瘤坏死因子-α、白介素6等[1-11],然而糖尿病患者EMP产生的具体机制尚不明确。
本实验组前期研究结果显示:糖尿病患者的EMP水平和糖化血红蛋白呈显著正相关,提示持续高血糖参与EMP释放[7]。持续高血糖所诱导产生的晚期AGEs是糖尿病患者独特的特点,其在糖尿病血管并发症的发生发展中起着十分重要的作用。因此为验证AGEs是否参与EMP释放,本课题组通过体外细胞方法,采取不同浓度AGEs干预内皮细胞12 h及24 h,观察到AGEs以浓度依赖方式促进EMP释放,而与干预时间相关性不大。同时,课题组观察到AGEs干预内皮细胞后EMP水平增高,伴随着RAGE表达增高,进一步采用抗RAGE抗体预处理内皮细胞,能抑制AGEs诱导EMP水平,提示AGEs通过与RAGE结合,诱导EMP的释放。
既往研究[12-14]提示AGEs与RAGE结合后可诱导多条通路的激活,如NADPH氧化酶、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、 核因子κB(nuclear factor kappa-B,NF-κB)等途径激活,参与糖尿病血管病变。本课题组观察到AGEs诱导EMP释放的同时伴随着ROS的高表达,采用抗RAGE抗体预处理内皮细胞后,ROS水平下降伴随EMP水平下降;采用ROS清除剂预处理,亦能改善EMP水平,故根据以上的实验结果推断AGEs通过与受体RAGE结合后,通过诱导下游ROS的高表达,从而参与EMP的释放。
本研究阐明AGEs诱导EMP释放主要是通过上调RAGE表达,激活氧化应激途径并诱导EMP释放。这为进一步了解AGEs在糖尿病血管病变的发生发展中的作用提供了理论支持。

