IL-1β促进肺鳞癌细胞增殖的机制研究
王 伟,罗 朋,王保龙
慢性炎症和感染是促进肿瘤发展的重要因素[1]。流行病学资料[2]显示,慢性阻塞性肺疾病、肺纤维化、吸烟、空气污染、肺炎和职业粉尘等与非小细胞肺癌(non-small cell lung cancer, NSCLC)的发生发展密切相关,提示慢性炎症在NSCLC的发病机制中发挥重要作用。白细胞介素-1β(interleukin-1β, IL-1β)作为一个重要的炎症因子,研究[3]表明其在NSCLC患者血清中高表达,且能促进肺腺癌的增殖和迁移。肺鳞癌是NSCLC较常见的病理类型,为进一步探讨IL-1β对肺鳞癌细胞增殖的影响和作用机制,现在采用平板克隆形成实验分析IL-1β对肺鳞癌细胞增殖的影响,并运用qRT-PCR、Western blot、双荧光素酶报告实验和CCK-8实验探讨IL-1β参与肺鳞癌细胞增殖的分子机制。
1 材料与方法
1.1 实验材料肺鳞癌SK-MES-1细胞株购自中国科学院上海生命科学研究院细胞中心;胎牛血清购自以色列Biological Industries公司;DMEM高糖培养基购自加拿大WISENT公司;流式CBA IL-1β检测试剂盒购自美国BD公司;重组人IL-1β购自美国R&D公司;抗体购自Proteintech公司;CCK-8细胞增殖检测试剂盒购自南京Vazyme Biotech公司;miR-223-3p mimics、Inhibitor、p27kip1的siRNA由上海吉玛公司合成;Lipofectamine 2000 转染试剂购自美国Invitrogen公司;microRNA 逆转录和荧光定量试剂盒购自大连Takara公司;miR-223-3p和U48引物由美国Gene Copoeia公司设计和合成;CDKN1B 3′UTR载体和双荧光素酶报告实验检测试剂盒购自美国Promega公司。
1.2 方法
1.2.1血浆中IL-1β含量测定 按照CBA试剂盒操作步骤进行测定:溶解标准品,进行倍比稀释,每管加入50 μl捕获微球;阳性对照品、阴性对照品和样品按照同样的操作进行,室温避光孵育3 h, 各管加入1 ml 洗液清洗,弃上清液;加入300 μl洗液上机测定;结果由配套软件进行分析。
1.2.2细胞培养 SK-MES-1细胞系用含有10% FBS的DMEM培养基培养于培养箱中,每1~2 d更换培养液并消化传代,培养箱条件为37 ℃、5% CO2。
1.2.3细胞克隆形成实验 取对数生长期的SK-MES-1细胞,以1 000个/孔接种于6孔板中,每孔加入不同浓度的IL-1β,置于37 ℃、5% CO2的温箱中培养2周,每3 d更换1次含有相应IL-1β浓度的培养基,直至出现肉眼可见的克隆时终止培养。弃培养基后用PBS清洗2次,每次3 min。4%多聚甲醛固定30 min,0.1%的结晶紫染色1 h,细流水缓慢冲洗染液,干燥后低倍镜观察细胞数大于50的克隆数并拍照。
1.2.4qRT-PCR检测细胞miR-223-3p表达 细胞作相应处理后,利用TRIzol 提取各组细胞RNA,运用Takara 逆转录和荧光定量PCR试剂盒检测miR-223-3p表达,以U48作为内参,以2-ΔΔCT计算miR-223-3p相对表达量。
1.2.5Western blot法检测p27kip1蛋白的表达 细胞作相应处理后,用PBS洗细胞3次,收集细胞,加入100 μl总蛋白提取液提取蛋白,5×上样缓冲液与总蛋白以5 ∶1混合后,95 ℃加热5 min。取25 μg蛋白质行凝胶电泳分离。10%脱脂牛奶封闭1.5 h后,加入相应一抗(p27kip1, 1 ∶1 000; GAPDH, 1 ∶1 000; β-actin, 1 ∶1 000)孵育,4 ℃摇床过夜。用TBST洗膜3次,每次5 min,对应二抗(1 ∶6 000)孵育1 h,TBST洗膜3次,每次5 min,于化学发光荧光显像仪上曝光。
1.2.6细胞转染 将对数生长期的SK-MES-1细胞接种到6孔培养板中,待细胞汇合40%~60%时进行转染。根据LipofectamineTM2000转染试剂说明书进行转染。
1.2.7CCK-8检测细胞增殖 收集转染24 h后的各组细胞,调整细胞为5×104个/ml的单细胞悬液,接种到96孔板中,100 μl/孔,每组做5个复孔。待细胞贴壁(37 ℃、5% CO2培养箱培养12 h)作为0 h,向每孔中加入10 μl CCK-8溶液,温箱孵育1 h后用酶标仪在450 nm和630 nm处测量每孔的吸光度(optical density,OD)值。细胞隔天换液,依次于培养24、48、72 h时终止培养,检测增殖状况。绘制生长曲线,以培养时间为横轴,以OD值为纵轴。
1.2.8双荧光素酶报告基因实验 按照Luciferase Assay Reagent说明书进行:事先准备好用于转染的分到96孔板中的293T 细胞和目的质粒,待细胞密度达到50%~70%为宜;将p53-3′UTR WT/MUT目的质粒以及5 pmol的miR-223-3p-mimics/mimics-NC充分混匀后室温放置(溶液A),之后将10 μl DMEM与0.3 μl 的转染试剂(转染试剂为汉恒生物产品,浓度为0.8 mg/ml)充分混匀(溶液B),室温放置5 min;将溶液A与溶液B充分混匀,室温放置20 min;转染前为细胞换取新鲜培养基,之后将转染混合物加入混匀。37 ℃、5% CO2培养;转染6 h后换取新鲜培养基,转染48 h后收集细胞检测。
1.3 统计学处理本研究应用SPSS 16.0软件进行统计学分析。血浆IL-1β含量结果以M(P25、P75)表示,两组间比较采用秩和检验。其他定量结果比较采用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 IL-1β在肺鳞癌患者血浆中高表达利用CBA试剂盒检测肺鳞癌患者和健康对照者血浆中IL-1β含量,结果显示肺鳞癌患者血浆中IL-1β含量中位数为11.96(7.55, 29.20)ng/L,高于健康对照组2.52(1.64, 3.48)ng/L,差异有统计学意义(Z=-5.06,P<0.001),见图1。
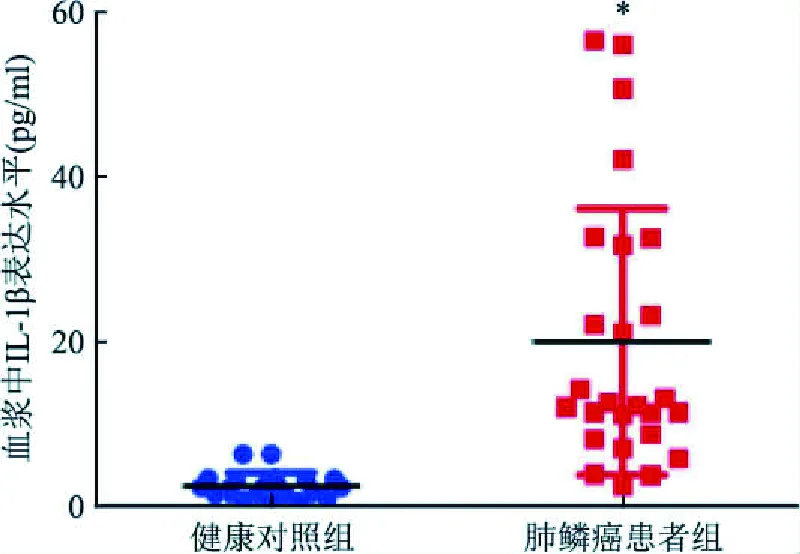
图1 肺鳞癌患者与健康对照者血浆中IL-1β含量比较(n=20)与健康对照组比较:*P<0.05
2.2 IL-1β促进肺鳞癌SK-MES-1细胞克隆形成利用平板克隆形成实验评价IL-1β对肺鳞癌细胞增殖能力的影响。不同浓度的IL-1β作用肺鳞癌SK-MES-1细胞2周后,由图2可知,IL-1β(100 ng/L)组、IL-1β(1 000 ng/L)组相比于对照组(0 ng/L),随着IL-1β浓度的增加,细胞克隆数目随之增加,表明IL-1β可以促进肺鳞癌SK-MES-1细胞克隆形成。
2.3 IL-1β能够降低肺鳞癌SK-MES-1细胞内miR-223-3p表达100 ng/L IL-1β作用肺鳞癌SK-MES-1细胞48 h后,应用qRT-PCR检测IL-1β对肺鳞癌细胞内miR-223-3p表达的影响。结果提示,与对照组相比(0 ng/L),IL-1β处理组肺鳞癌SK-MES-1细胞内miR-223-3p表达降低(t=26.76,P<0.001)。见图3。
2.4 CDKN1B是miR-223-3p直接作用的靶点运用TargetScan在线软件(http://www.targetscan.org/)预测miR-223-3p潜在的下游靶基因,发现CDKN1B的3′UTR有miR-223-3p结合位点(图4A)。为了验证在线数据库预测的CDKN1B的3′UTR能否与miR-223-3p结合,将miR-223-3p mimics或mimics-NC与CDKN1B 3′UTR 野生型(WT)或突变型(MUT)载体共转染到HEK-293T细胞株中,分别检测4组中荧光素酶活性。如图4B显示:miR-223-3p mimics与含有CDKN1B 3′-UTR端野生型质粒共转染后, 荧光素酶活性受到抑制,提示miR-223-3p能够结合CDKN1B 3′ UTR端。Western blot实验结果表明:miR-223-3p mimics组肺鳞癌SK-MES-1细胞中CDKN1B蛋白(p27kip1)表达量较mimics-NC组降低;miR-223-3p Inhibitor组细胞中CDKN1B蛋白(p27kip1)表达量较 Inhibitor-NC组增加(图4C)。综上,miR-223-3p可直接靶向作用肺鳞癌SK-MES-1细胞CDKN1B 3′-UTR抑制其表达。
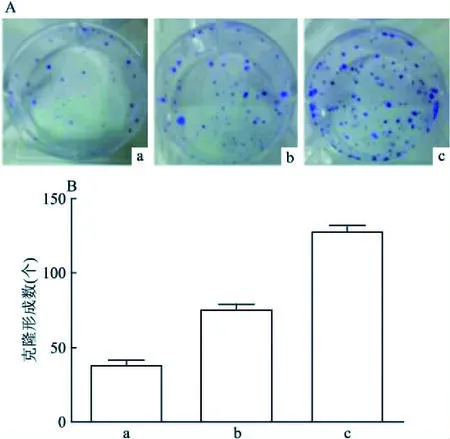
图2 不同浓度IL-1β对肺鳞癌SK-MES-1细胞克隆形成的影响A:平板克隆形成图;B:克隆形成数柱状图;a:IL-1β 0 ng/L; b:IL-1β 100 ng/L; c:IL-1β 1 000 ng/L
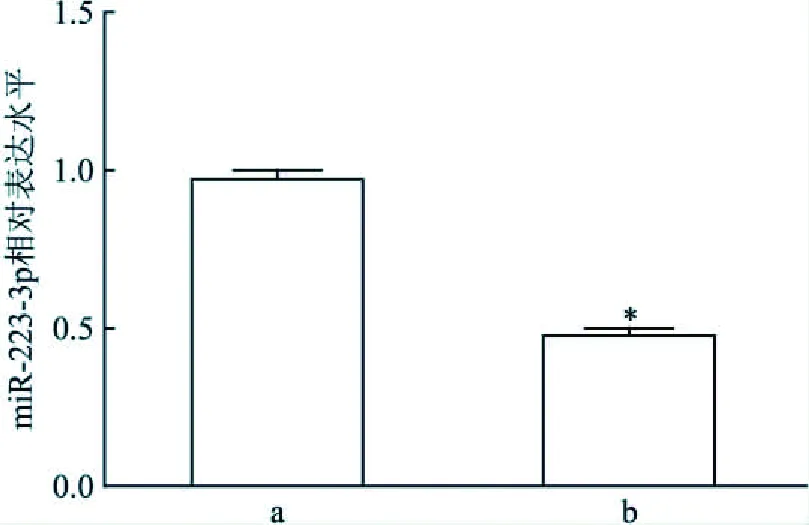
图3 IL-1β对肺鳞癌SK-MES-1细胞内miR-223-3p表达的影响与对照组(IL-1β 0 ng/L)比较:*P<0.05;a:0 ng/L; b: 100 ng/L
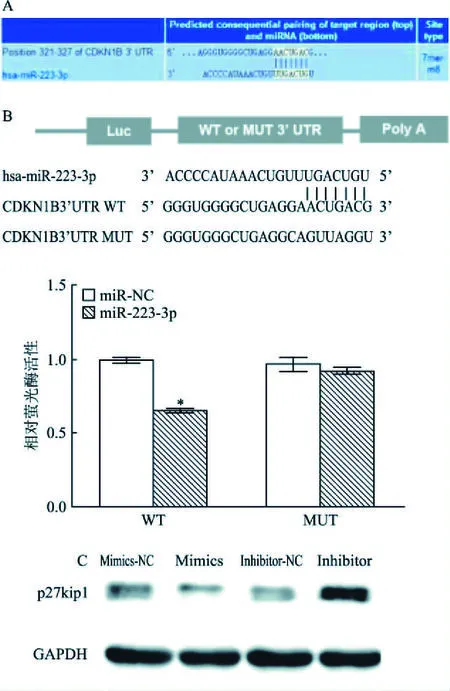
图4 miR-223-3p直接作用CDKN1B 3′ UTR抑制其表达A:TargetScan软件预测CDKN1B 3′UTR有miR-223-3p结合位点;B:双荧光素酶报告实验验证miR-223-3p与CDKN1B 3′UTR直接结合;与miR-NC比较:*P<0.05;C:Western blot检测过表达和敲低miR-223-3p后对p27kip1表达的影响
2.5 IL-1β促进肺鳞癌SK-MES-1细胞p27kip1表达Western blot检测IL-1β(100 ng/L)作用肺鳞癌SK-MES-1细胞48 h后p27kip1表达情况,由图5A可知,相比于对照组,IL-1β处理后细胞p27kip1表达随之增加。表明IL-1β可以促进细胞p27kip1表达。进一步利用共聚焦显微镜观察p27kip1分布情况,发现肺鳞癌SK-MES-1细胞p27kip1主要分布于细胞质。综上所述,IL-1β促进肺鳞癌SK-MES-1细胞增殖可通过降低细胞内miR-223-3p表达进而促进p27kip1表达。
2.6 下调p27kip1表达抑制肺鳞癌SK-MES-1细胞增殖利用siRNA下调p27kip1表达,CCK-8检测肺鳞癌SK-MES-1细胞增殖,结果提示下调p27kip1表达,细胞增殖能力降低(t=9.50,P=0.001)。见图6。
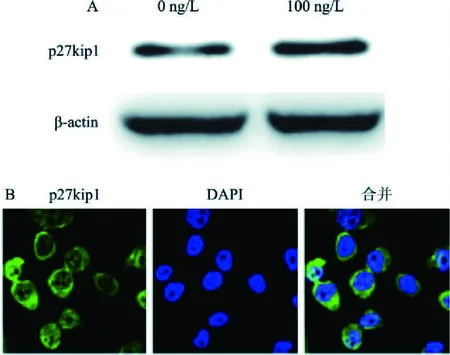
图5 IL-1β对肺鳞癌SK-MES-1细胞p27kip1表达的影响A:Western blot检测IL-1β对肺鳞癌SK-MES-1细胞p27kip1蛋白表达的影响;B:共聚焦显微镜观察肺鳞癌SK-MES-1细胞p27kip1分布情况×400
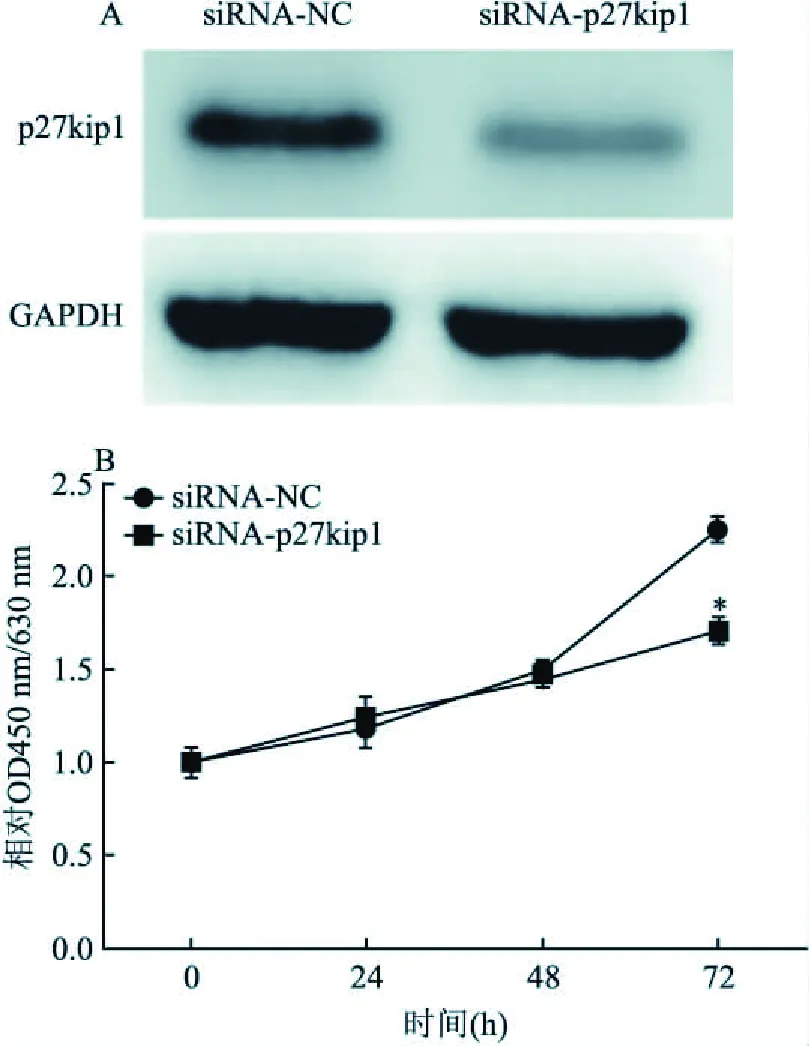
图6 p27kip对肺鳞癌SK-MES-1细胞增殖的影响A:Western blot检测siRNA干扰p27kip1后其蛋白表达情况;B:CCK-8检测敲低p27kip1后细胞增殖情况;与siRNA-NC比较:*P<0.05
3 讨论
肺鳞癌是 NSCLC常见的病理类型[4-5]。与肺腺癌相比,其发病机制的研究和治疗进展滞后[6-7]。因此,对肺鳞癌进行深入研究具有重要意义。慢性炎症可导致癌变,炎症在NSCLC发生和发展中的作用被人们所认识[8],但其潜在的分子机制尚不清楚。
越来越多的研究[9]表明miRNAs可作为联系炎症与肿瘤重要枢纽,参与肿瘤的发生发展。IL-1β作为一个重要的炎症因子,研究[3]表明其能通过环氧化酶-2/缺氧诱导因子-1α(COX-2/HIF-1α)途径抑制miR-101表达进而促进肺腺癌的增殖和迁移,但IL-1β在肺鳞癌中的作用及其机制的研究报道较少。课题组前期研究[10]发现miR-223-3p在肺鳞癌组织中表达降低,其可与突变型p53蛋白形成反馈环路促进肺鳞癌的增殖和迁移。另外,研究[11]显示:单核细胞经IL-1β和肿瘤坏死因子-α刺激后,胞内miR-223表达下调;但肺内皮细胞经IL-1β和肿瘤坏死因子-α刺激后,胞内miR-223表达上升,结果提示在不同类型的细胞中,炎症因子对细胞内miR-223的表达存在差异。本研究证实在肺鳞癌患者血浆中IL-1β高表达,外源性加入IL-1β能够促进肺鳞癌SK-MES-1细胞的增殖,且使细胞内miR-223-3p表达降低,结果提示高表达的IL-1β通过降低细胞内miR-223-3p表达促进细胞增殖。
通过软件预测、双荧光素酶报告实验和Western blot证实miR-223-3p可以直接靶向CDKN1B(p27kip1)的3′ UTR 抑制其表达。p27kip1是一种细胞周期蛋白依赖性激酶(cyclindependent kinase, CDK)抑制因子,通过与细胞周期蛋白/细胞周期蛋白依赖性激酶(cyclin/cdk)复合物结合调节细胞的增殖、迁移和凋亡[12]。研究[13]显示,分布于细胞核和细胞质中p27kip1具有不同的功能:细胞核中p27kip1主要作为CDK抑制剂调节细胞周期,而细胞质中p27kip1具有抗凋亡、促进细胞迁移作用。近期研究[14]表明,p27kip1的异常表达和亚细胞分布与恶性肿瘤的发生发展密切相关。本研究通过共聚焦显微镜观察发现,p27kip1在肺鳞癌SK-MES-1细胞中主要分布于细胞质,外源性IL-1β能够促进细胞p27kip1表达。敲低p27kip1表达后,细胞的增殖降低。
综上所述,IL-1β通过降低肺鳞癌SK-MES-1细胞内miR-223-3p表达进而使p27kip1表达增加,抑制细胞凋亡,促进细胞增殖。

