胎膜早破与阴道B族链球菌、TNF-α表达及新生儿不良结局
杨 帆 张建华 张 瑾 杨鉴冰 杨 磊*
1.西安医学院第二附属医院(710038);2.陕西中医药大学附属医院
现阶段,临床尚未完全明确胎膜早破的具体发病机制[1]。多数研究显示,胎膜早破时羊水中细胞因子活性与酶活性会出现特征性变化,感染为胎膜早破的重要风险因素之一[2-3]。各种感染病原体中,穿透性最强的为B族溶血性链球菌(GBS),但未完全明确其与胎膜早破间相关性[4]。内分泌各种因素影响会导致孕产妇阴道微生态失衡,进而出现生殖道上行性感染[5-6]。各种炎症激活多种炎症通路,促使TNF-α等多种促炎因子表达增加,进而引发胎膜早破等不良妊娠[7]。为有效预防胎膜早破,本研究对GBS 、TNF-α对胎膜早破的可能影响进行探讨。
1 资料与方法
1.1 资料
选取2016年2月—2018年9月本院诊治的胎膜早破患者55例为胎膜早破组,年龄(27.9±2.9)岁(23~35岁);年龄匹配的正常妊娠待产孕妇50例为对照组,年龄(27.9±2.8)岁(24~36岁)。研究对象均知情同意,研究通过伦理委员会批准。
1.2 检测方法
外阴常规消毒,无菌阴道棉拭子采集阴道分泌物。将1ml清洗液加入无菌涤纶拭子管中,震荡2min为标本悬浮液;将所有样品离心后,加入1ml清洗液震荡重悬,再离心去除上清液,采用聚合酶链式扩增(PCR)法检测GBS,仪器为DA7600荧光定量PCR扩增仪(广州达安基因股份有限公司生产),由普生物科学(中国)有限公司生产GBS核酸检测试剂盒。采用免疫比浊法检测TNF-α,试剂盒由上海百蕊生物科技有限公司生产。
1.3 观察指标
统计GBS、TNF-α阳性率及不良分娩结局。
1.4 统计学分析
2 结果
2.1 两组GBS、TNF-α阳性率对比
胎膜早破组GBS阳性率(27.3%,15例/55例)高于对照组(6.0%,3例/50例)(χ2=8.344,P=0.004);TNF-α阳性率(29.1%,16例/55例)高于对照组(8.0%,4例/50例)(χ2=7.556,P=0.006)。
2.2 胎膜早破组GBS、TNF-α阳性与妊娠结局
胎膜早破组中,GBS、TNF-α阳性产妇新生儿肺炎、新生儿窒息、胎儿窘迫以及早产等发生率均高于阴性产妇(均P<0.05)。见表1。
2.3 两组产妇GBS、TNF-α与妊娠结局
两组105例中 ,GBS、TNF-α阳性产妇新生儿肺炎、窒息,胎儿窘迫和早产的发生率高于阴性者(均P<0.05)。见表2。

表1 胎膜早破组不同检测指标产妇不妊娠良结局比较[例(%)]
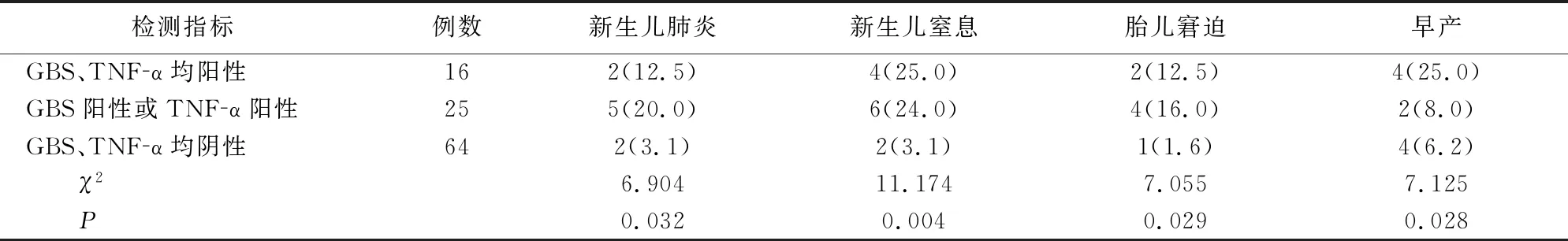
表2 阳性检测指标不同产妇不良妊娠结局比较[例(%)]
3 讨论
胎膜早破属常见产科并发症[8]。会引发不良妊娠结局,包括羊水栓塞、难产、孕产妇感染、围产儿感染、早产等,甚至对孕产妇生命安全构成威胁[9-10]。临床研究显示,在产程开始后,羊水中金属蛋白酶活性抑制因子含量降低,金属蛋白酶活性提高,胶质含量减少,进而降低产程中羊膜延展性。当子宫下段向胎膜极限延伸时会出现胎膜早破情况[11]。另有研究显示,受细菌感染等病理因素及正常妊娠成熟等生理因素影响,可使胎膜正常功能及完整性遭到破坏而导致胎膜早破[12]。
临床研究显示,B族链球菌可引发脑膜炎、新生儿肺炎与新生儿败血症等疾病,严重时甚至造成新生儿死亡[13]。感染后存活的新生儿也可能遗留耳聋、智力障碍以及脑积水等神经系统后遗症。GBS属革兰氏阳性球菌,是引发生殖系统感染的常见菌种。GBS对绒毛膜的吸附能力较强,并且具有最强穿透力,接种2h后便可在母体组织吸入,进而对绒毛膜进行侵袭,减低胎膜局部张力引发胎膜早破[14]。TNF-α是由单核巨嗜细胞进行分泌的一种促炎与免疫调节因子。研究显示,与正常足月分娩者相比,胎膜早破患者胎膜、血清以及羊水中的TNF-α表达更高。本研究结果显示,胎膜早破组GBS阳性率高于对照组,且GBS阳性产妇新生儿肺炎、新生儿窒息、胎儿窘迫以及早产发生率均高于阴性产妇,提示GBS与胎膜早破可能有关;胎膜早破组TNF-α阳性率高于对照组,且TNF-α阳性产妇新生儿肺炎、新生儿窒息、胎儿窘迫以及早产发生率均高于阴性产妇。另外,在全部105例观察对象中,GBS阳性、TNF-α阳性者新生儿肺炎、窒息,胎儿窘迫和早产的发生率高于阴性者。分析TNF-α在胎膜早破可能影响机制:TNF-α参与了机体的炎症反应过程;触发胎膜组织中CasDase基因表达,诱导胎膜细胞凋亡。本结果提示临床,对具有这些特征的孕产妇应及早采取有些治疗以改善母婴结局。

