白藜芦醇通过靶向SIRT1激活Keap1-Nrf2-HO-1途径发挥对草酸钙肾结石形成的调控作用
田 河,王志龙,张智慧,宋 静,高 强,吴 影,南锡浩,郭振海,邸彦橙
(牡丹江医学院附属红旗医院,牡丹江 157011)
肾结石是泌尿外科常见疾病之一,而草酸钙结石是最为常见的结石类型[1]。故通过研究草酸钙肾结石的发病机制具有广泛概括意义。一些研究证实,肾小管上皮细胞在高浓度的草酸和尿钙通过脂质过氧化的情况下严重受损。肾结石的形成是一个复杂的过程,其形成与肾上皮细胞损伤相关,高草酸会损伤肾上皮细胞和细胞膜,然而晶体粘附是肾结石形成的重要环节,粘附的前提一般存在肾上皮细胞的损伤,这可能与损伤的肾上皮细胞为晶体提供粘附位点有关[2]。晶体粘附后进一步诱导ROS的产生,进一步损伤肾上皮细胞。因此肾小管细胞损伤被认为是肾晶体形成的主要危险因素。减轻高草酸引起的肾上皮细胞的损伤可能对于研究肾结石的形成具有重要的意义,对于肾结石预防尤为重要[3]。
白藜芦醇化学名为芪三酚(3,5,4-trihydroxystilbene),是葡萄属植物产生的一种多酚类植物抗毒素,主要存在于葡萄、藜芦、虎杖等植物中,是天然的抗氧化剂和自由基清除剂[4]。且RSV是SIRT1的特异性激动剂,而近年来研究表明白藜芦醇作为一种具有多种生物学功能化合物,具有降血脂、抗氧化损伤、抗肿瘤、保护心脑血管、抗衰老、保肝、免疫调节及雌激素样作用。白藜芦醇可通过激活SIRT1而减少氧化应激对草酸诱导的细胞发挥保护作用。EX527是一种有效的、选择性sirt1抑制剂,EX527有效抑制SIRT1去乙酰化酶活性。对于研究白藜芦醇对于HK-2的防护性机制具有重要作用。白藜芦醇在草酸钙结石中的抗氧化应激机制及其对Nrf2-ARE途径的作用,目前国内外研究还较少。因此,研究SIRT1激动剂白藜芦醇等能否通过信号通路维持氧自由基稳定、抵抗草酸引起的氧化应激损伤为白藜芦醇等中成药在肾结石疾病的防治应用中提供理论依据。
1 材料和方法
1.1 实验材料
人肾上皮细胞(HK-2)购自于ATCC。HK-2属于贴壁细胞,细胞使用RPMI1640培养基+1%三抗+10%FBS,细胞于37℃、5% CO2培养箱中培养,24 h换液。
1.2 主要试剂
白藜芦醇、EX527、活性氧检测试剂盒、相关ELISA试剂盒购自于碧云天生物科技有限公司;Sirt1、Keap1、Nrf2、HO-1抗体购自于CST;SiRNA-Sirt1购自于Sangon Biotech;RPMI1640培养基与FBS购自于Gibco。
1.3 实验方法
1.3.1 实验分组
细胞实验:将HK-2细胞分为对照组、草酸组、草酸+RSV、草酸+RSV+EX527组。
1.3.2 白藜芦醇药物毒性的筛选
(1)细胞铺板:96孔板,每孔铺8000个HK-2细胞。(2)铺板10 h后进行药物干预,药物浓度分别为0 nM(con)、100 nM、500 nM、1 μM、5 μM。药物干预24 h后进行CCK8实验。(3)弃除上清,每孔按CCK8试剂/培养基10∶100的比例加入混合液。(4)2 h后于酶标仪进行检测。
1.3.3 RSV对于HK-2细胞增殖的作用
将HK-2细胞分为对照组、草酸组、草酸+RSV、草酸+RSV+EX527组。各组进行24 h干预后进行CCK8实验检测HK-2增殖活性,CCK8方法同前。
1.3.4 Western blot法检测RSV激动sirt1后各蛋白表达
(1)实验分组:将HK-2细胞分为对照组、草酸组、草酸+RSV、草酸+RSV+EX527组。(2)细胞铺板:每中皿铺8×105个细胞。待细胞贴壁后进行干预。(3)蛋白提取,干预处理24 h后,裂解液裂解,随后4℃,14 000 r/min 离心10 min,随后取上清按5×比例加入上样缓冲液,随后100℃水浴10 min。随后进行蛋白凝胶电泳及显像分析。
1.3.5 qPCR法检测各组HK-2中基因表达情况
运用TRIzol法提取HK-2细胞中的总RNA,随后进行逆转录。逆转录体系为20 μL∶1 μL总RNA,4 μL 5×Reaction Mix,2 μL 10×Super Script Enzyme Mix,加入ddH2O将体系补足至20 μL,混匀后离心。反应条件为:37℃ 60 min,95℃ 5 min,置于4℃保存备用。按照qPCR试剂盒说明书进行转录扩增,反应体系为20 μL。使用SYBR Green染料法进行测定,每个样本设置4个复孔。按照试剂盒说明书的反应条件进行扩增。基因的相对表达量用2-△△CT法进行计算。引物序列如下:
β-actin 正向序列:5’-CATTGCTGACAGGATG CAGAAGG-3’;反向序列:5’-TGCTGGAAGGTGG ACAGTGAGG-3’;
sirt1正向序列:5’-TAGACACGCTGGAACA GGTTGC-3’,反向序列5’-CTCCTCGTACAGCTT CACAGTC-3’;
TGF-β1正向序列:5’-TACCTGAACCCGTGTT GCTCTC-3’,反向序列:5’-GTTGCTGAGGTAT CGCCAGGAA-3’;
SMAD2正向序列:5’-GGGTTTTGAAGCCGTC TATCAGC-3’,反向序列:5’-CCAACCACTGTAGA GGTCCATTC-3’;
Nrf2正向序列:5’-CACATCCAGTCAGAAACC AGTGG-3’,反向序列:5’-GGAATGTCTGCGCCAA AAGCTG-3’。
1.3.6 流式细胞仪测定HK-2干预后活性氧水平
实验分组同前。(1)细胞铺板,6孔板每孔铺4×105个细胞。贴壁后进行干预处理。(2)24 h后进行活性氧检测,去除细胞培养液,加入适当体积稀释好的DCFH-DA。37℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞三次。(3)流式细胞仪检测。
1.3.7 ELISA法测各组中TGF-β1、Smad2、sirt1和Nrf2含量
细胞上清样品离心取上清(500 r/min,5 min),随后-80℃样品保存。采用ELISA法测量各组HK-2细胞中TGF-β1、Smad2、sirt1和Nrf2含量。
1.3.8 siRNA干扰各组sirt1表达后,Western blot法检测相关蛋白的表达
(1)胞铺板:24孔板接种5万个细胞每孔,每孔中加入约500 μL含血清的完全培养基,使转染时的细胞密度能够达到70%。(2)采取稀释后的lipo2000与稀释后的siRNA混匀孵育后感染细胞。(3)24 h后观察荧光。Western blot实验方法同前。
1.4 统计学方法

2 结果
2.1 白藜芦醇药物毒性的筛选
如图1所示,白藜芦醇药物毒性实验表明,与对照组相比,白藜芦醇对于HK-2无毒性,统计学无明显差异(P>0.05)。而其他浓度的白藜芦醇均对HK-2有着不同程度的抑制作用,而且这种抑制作用与RSV的浓度梯度相关,表明RSV大于500 nM后,对于HK-2细胞存在明显的药物毒性作用。
2.2 白藜芦醇对于HK-2细胞增殖的作用
如图2所示,CCK8实验表明,与对照组相比,草酸钠抑制了HK-2的增殖(P<0.01)。与草酸钠组相比,RSV缓解了草酸钠对于HK-2的损伤(P<0.01),但EX527解除了RSV对HK-2细胞的增殖作用(P<0.01)。
2.3 流式细胞仪测定HK-2干预后活性氧水平
如图3所示流式细胞仪检测各组活性氧水平结果表明,草酸钠刺激HK-2活性氧的产生,然而RSV干预后的HK-2,草酸钠刺激其产生活性氧的水平下降,应用sirt1抑制剂的EX527后,活性氧的产生水平恢复到原先水平。
2.4 Western blot法检测 RSV激动sirt1后各蛋白表达
如图4所示,与对照组相比,草酸钠组HK-2细胞中sirt1表达下降,Keap1、Nrf2、HO-1表达降低,Smad2表达上调。与草酸钠组相比,RSV应用后,sirt1表达上调,Keap1、Nrf2、HO-1表达上调(P<0.01),Smad2/3表达下调(P<0.01)。然而应用EX527后,sirt1上调的相关蛋白表达下降。

注:NS:无统计学意义。图1 白藜芦醇药物毒性的筛选Note. NS, not statistically significantFigure 1 Selecting of drug toxicity of resveratrol
2.5 qPCR法检测各组HK-2中基因表达情况
如图5所示,与对照组相比,草酸钠组TGF-β1、Smad2/3/4mRNA表达上调,而sirt1 mRNA表达下调(P<0.01)。与草酸钠组相比,应用RSV后TGF-β1(P<0.01),Smad2(P<0.05)、Smad3(P<0.05)、Smad4(P<0.01)mRNA表达下调(P<0.01),而sirt1 mRNA表达上调(P<0.01)。应用sirt1抑制剂后,与RSV组相比,TGF-β1(P<0.01)、Smad2/3/4(P<0.05)表达上调,sirt1 mRNA表达下调(P<0.05)。
2.6 siRNA干扰各组sirt1表达后,Western blot法检测相关蛋白的表达
如图6所示,应用siRNA-sirt1感染HK-2细胞后,Western blot 检测sirt1的表达,与NC组相比,siRNA组sirt1表达明显下调。如图7所示,与草酸钠组相比,siRNA干扰后,sirt1表达下调,Keap1、Nrf2、HO-1表达下调。沉默sirt1表达后,随后应用RSV,发现RSV并不能抑制Smad2/3的激活。这与EX527作用相同。

图2 白藜芦醇对于HK-2细胞增殖的作用Figure 2 Effect of resveratrol on proliferation of HK-2 cells
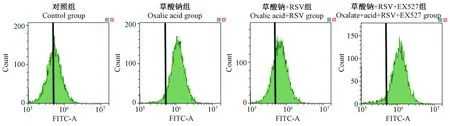
图3 流式细胞仪测定HK-2干预后活性氧水平Figure 3 Flow cytometry was used to determine the level of reactive oxygen species after HK-2 intervention
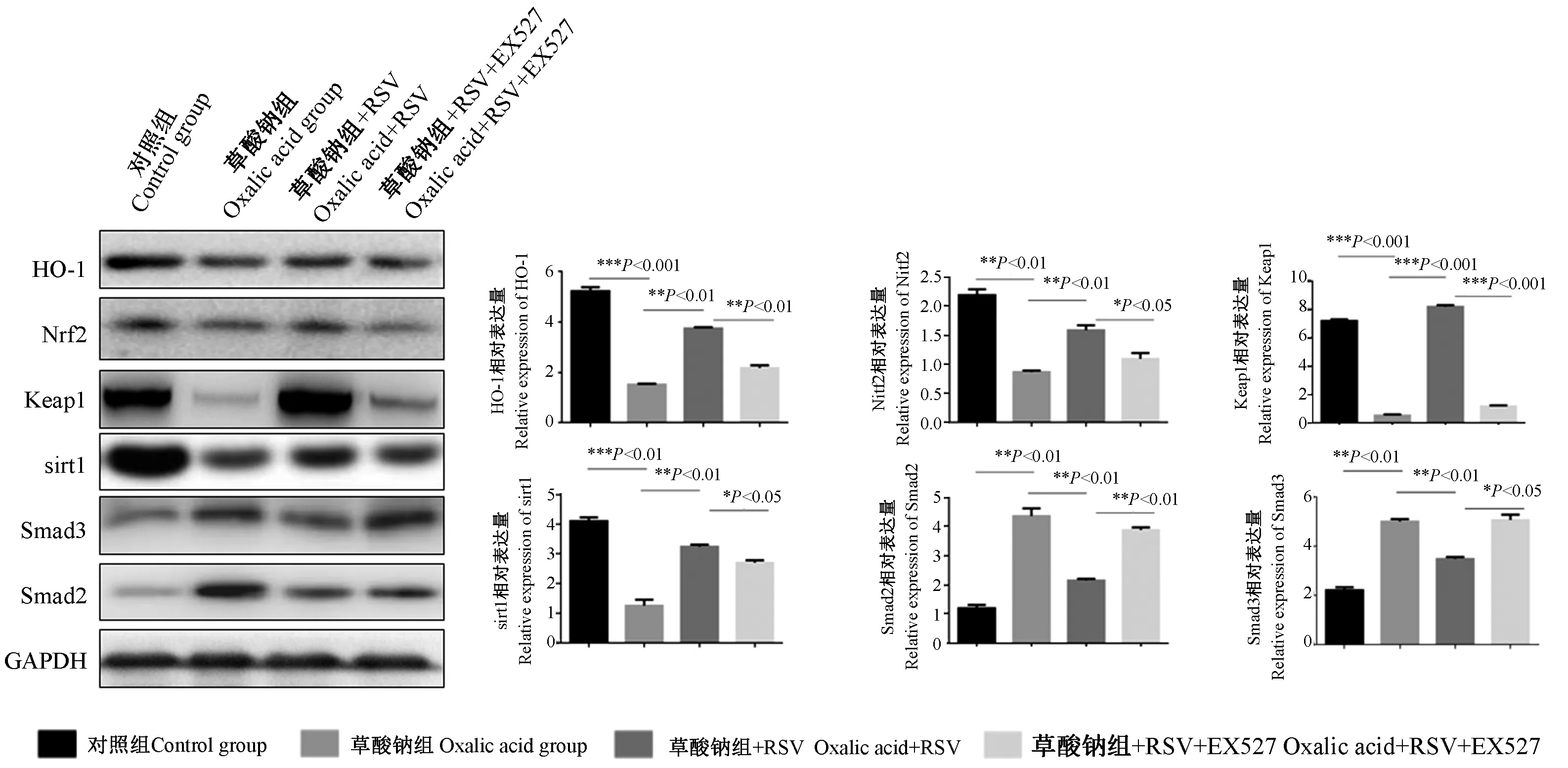
图4 Western blot法检测 RSV激动sirt1后各相关蛋白表达Figure 4 Western blot analysis of expression of related proteins after RSV activation of sirt1
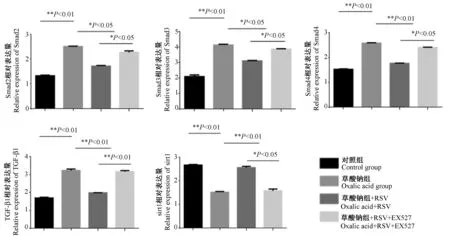
图5 qPCR法检测各组HK-2中基因表达情况Figure 5 qPCR analysis of gene expression in each group of HK-2
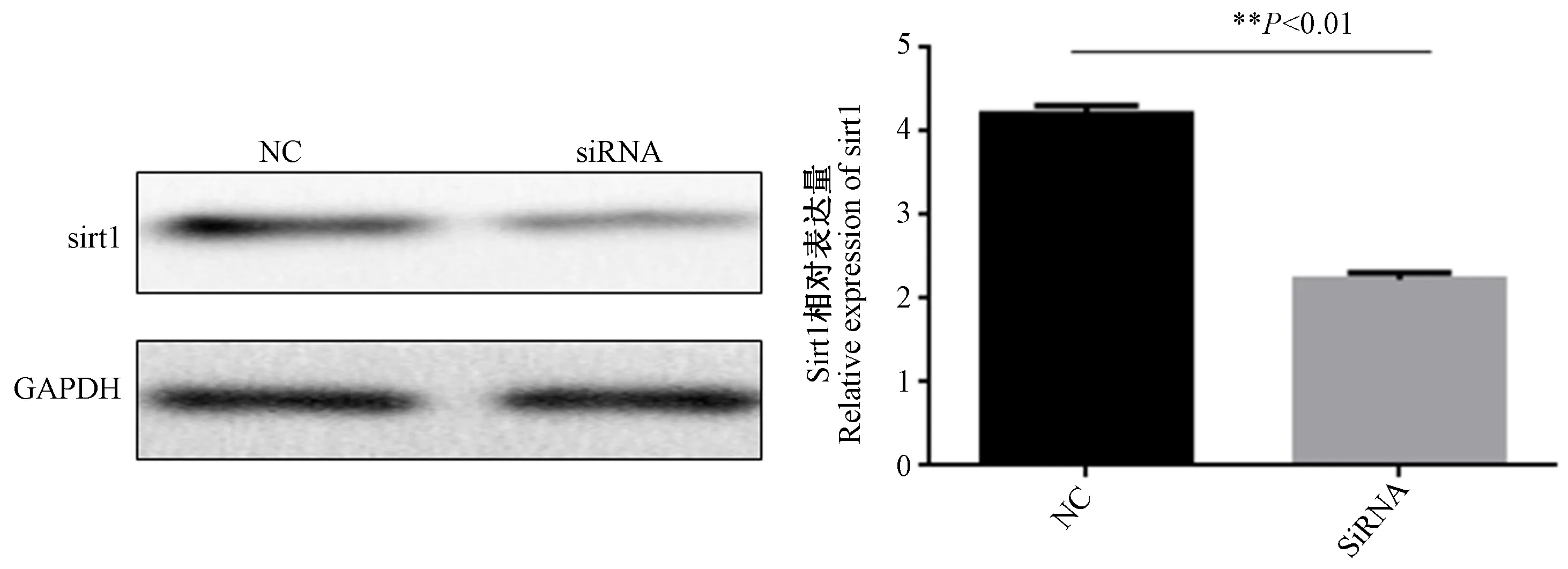
图6 siRNA干扰HK-2细胞sirt1表达Figure 6 siRNA interferes with sirt1 expression in HK-2 cells
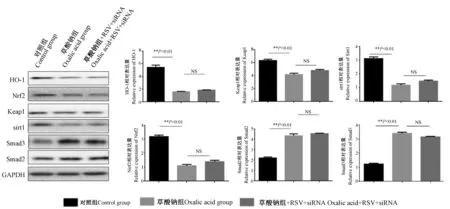
图7 siRNA干扰sirt1表达后,Western blot法检测各实验组相关蛋白的表达Figure 7 After siRNA interfered with the expression of siut1, Westem blot assay was used to detect the expression of related proteins in each experimental group
3 讨论
氧化应激是由于活性氧(ROS)产生超过机体抗氧化能力而产生的。超过90%的ROS产生于呼吸链的线粒体中[4]。此外NADPH氧化酶、黄嘌呤氧化酶、脂肪氧合酶也会增加细胞质内ROS的产生。在氧化应激存在时,机体的抗氧化能力减弱,能清除ROS的抗氧化酶如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)及过氧化氢酶(CAT)等的含量降低,导致ROS的过度积聚[5]。而NADPH氧化酶中的核心部分p22phox会促使ROS的产生[6]。草酸作用细胞后会引起细胞产生大量的活性氧,进而对细胞造成氧化应激损伤。而体外实验中加入活性氧清除剂N-乙酰基-L-半胱氨酸(NAC)可减弱草酸对细胞的损伤。
机体在应对 ROS 损害时形成一套复杂的氧化应激应答系统,自身会诱导出一系列保护性蛋白,以减轻细胞发生的氧化应激损伤[7]。近年来,有研究发现核转录因子 NF-E2 相关因子 2 (Nuclear factor E2-related factor 2, Nrf2)和它的胞质接头蛋白(Kelch like ECH associated protein 1, Keap1)是细胞抗氧化应激的中枢调节者[8]。正常情况下,Nrf2 和细胞骨架相关蛋白 Keap1 结合成二聚体的形式存在于细胞浆中,当受到外界氧化应激因子刺激后,Nrf2与 Keap1 解离并转位进入细胞核,然后通过与抗氧化应激反应元件 ARE相互作用,诱导编码抗氧化蛋白和 II 相解毒酶的表达,如γ谷氨酸合成酶(γ-GCS)血红素氧合酶 1(HO-1)等[9]。故当受到氧化应激损伤时,机体会产生相应的自身防御反应,Keap1-Nrf2/ARE 通路是近年新发现的机体抵抗外界氧化和化学等刺激的防御性转导通路[6]。Keap1-Nrf2/ARE通路下游的抗氧化酶HO-1是血红素降解过程中的限速酶,研究证明,多种生长因子、氧化刺激因素、抗氧化药物等能上调其表达[2]。而HO-1催化血红素降解的三个产物: CO、胆红素和铁蛋白, 是发挥细胞保护作用的关键分子[10]。有学者发现HO-1对细胞和组氧化损伤起着重要的保护作用。故HO-1被认为是细胞氧化应激过程中一个非常敏感的指标[11]。
SIRT1 (沉默信息调节因子1)是NAD+ 依赖性蛋白脱乙酰酶,在细胞分化、衰老、凋亡、代谢调控、转录调节、信号转到、氧化应激等多种重要的生物学过程中发挥重要作用[12]。而这种作用主要是通过去乙酰化激活NF-KB、叉头蛋白转录因子家族(FOXOs)、过氧化物酶增殖物激活受体(PPAR)及其辅激活因子PGC1等[13]。既往研究已经证实SIRT1可通过抗炎、抗氧化、减少凋亡等机制发挥细胞保护作用[2]。
本实验筛选了白藜芦醇的最佳药物剂量,同时发现不同浓度的白藜芦醇存在不同程度放入药物抑制作用。高草酸的环境对于人肾上皮细胞(HK-2)具有损伤作用,损伤可能通过抑制sirt1表达来实现的,因此应用sirt1的激动剂具有较好的防护性作用。RSV可以在适当药物浓度下明显抑制草酸钠诱导的ROS的产生水平。这可能与sirt1被激活后,通过平衡Keap1/Nrf2/HO-1与TGF-β1发挥抗氧化,抗草酸钙晶体粘附的作用有关。据研究表明心肌细胞Nrf2可以抑制TGF-β1/Smad2/3/4信号通路。因此,白藜芦醇激动sirt1后,上调了Keap1/Nrf2/HO-1蛋白的表达,然而Nrf2表达上调后进一步抑制了TGF-β1的产生水平,从而发挥抗氧化作用,进而缓解了草酸钠对于HK-2细胞的损伤作用。本实验随后又运用sirt1及抑制剂对于白藜芦醇的作用及机制进行反向验证,研究进一步表明白藜芦醇激动sirt1后具有良好的防护性效应。
综上所述,本研究表明白藜芦醇对于HK-2细胞抗氧化作用,其机制可能是sirt1激活后,促进了Keap1、Nrf2、HO-1的表达,并进一步抑制了TGF-β1产生水平,从而抑制了ROS的产生。

