5-羟甲基糠醛及其二聚体OMBF引发Ⅰ型超敏反应毒性评价与机制初探
李恩灿,范潇予,林 琳,郝瑞瑞,林 生,贺玖明,靳洪涛,3*
(1.中国医学科学院,北京协和医学院药物研究所,新药安全评价研究中心,北京 100050;2.中国医学科学院,北京协和医学院药物研究所,天然药物活性物质与功能国家重点实验室,北京 100050;3.北京协和建昊医药技术开发有限责任公司,北京 100176)
I型超敏反应又称速发型超敏反应(immediate hypersensitivity),主要由特异性IgE抗体介导,高亲和力的IgEFc受体(FcεRI)是反应发生的重要膜分子,其中肥大细胞和嗜碱性粒细胞表面含有大量的FcεRI[1]。I型超敏反应通常包含两个阶段,即致敏阶段和激发阶段。当抗原初次进入机体后,初次应答产生的IgE抗体与细胞膜表面FcεRI高亲和力的结合,使细胞处于致敏阶段。当相同的抗原再次入侵时,与细胞膜上的IgE抗体结合,致使相邻的FcεRI发生桥连,从而触发细胞内一系列的生物化学反应[1]。
5-羟甲基糠醛(5-HMF, C3H6O3)是由一个呋喃环组成的小分子化合物,六碳糖在高温的条件下发生美拉德反应可生成5-HMF[2-3]。5-HMF通常被认为是高温灭菌过程中产生的副产物[4],存在于各种含糖类的食品和药物制剂中。此外,5-HMF在高温下易通过聚合反应生成其二聚体产物,即双(5-甲酰基糠醛)醚(OMBF)。本实验室前期通过报告抗原腘窝淋巴结试验 (RA-PLNA)证实,5-HMF和OMBF可诱导小鼠发生免疫反应[5]。基于先前关于5-HMF和OMBF的研究,本研究将进一步对5-HMF及OMBF的免疫毒性进行评价并初步探讨其可能的作用机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
无特定病原体(SPF)级的6周龄雄性Brown Norway(BN)大鼠21只,(170 ± 20)g,购自维通利华生物技术公司[SCXK(京)2016-0006]。将其随机分为不同的给药组及对照组。在实验之前,使大鼠在含有玉米芯的聚碳酸酯笼中适应环境一周,并且可以自由获取通过反渗透系统净化的水和实验室动物饲料,环境温度为(23 ± 2)℃,相对湿度为(50 ± 5)%,12 h光照/黑暗循环。动物饲养于北京协和建昊医药技术开发有限责任公司动物中心[SYXK(京)2015-0021],该设施已经通过AAALAC认证。动物处理程序经北京协和建昊医药技术开发有限责任公司实验动物伦理委员会批准,伦理委员会批准文号:2018-002(研)。实验期间按实验动物使用的3R原则给予人道主义关怀。
1.1.2 细胞系
大鼠嗜碱性白血病细胞系(RBL-2H3)购自中国科学院上海生命科学研究院细胞资源中心
1.2 主要试剂与仪器
卵清白蛋白、弗氏不完全佐剂、弗氏完全佐剂、5-HMF(CAS:67-47-0;纯度:99%)、4-硝基苯-N-乙酰基-β-D-氨基糖苷酶、1,2-苯二甲醇(CAS:612-14-6;纯度:97%)、Anti-DNP-IgE、DNP-HSA、二甲基亚砜(DMSO,细胞培养级)均购自Sigma-Aldrich公司(美国);MEM/DMEM培养基、谷氨酰胺、非必须氨基酸、丙酮酸钠、胰酶溶液0.25%、胎牛血清、PBS均购自Thermo Fisher 公司(美国);甲醇、二甲苯、乙醇、盐酸(36%~38%)、氢氧化钠(≥99.8%)、碳酸氢钠(≥99.8%)、碳酸钠(≥99.8%)、柠檬酸(≥99.8%)、柠檬酸钠(≥99.8%)均购自北京化工厂(中国);ELISA试剂盒包括大鼠IgE、IgG、白细胞介素-4 (IL-4)、C5b-9、谷胱甘肽过氧化物酶-1(Gpx-1)等指标均购自深圳达科为有限公司(深圳);Western blot所用抗体购自Cell Signaling Technology (美国);PierceTMBCA蛋白检测试剂盒等其他Western blot相关试剂均来源于Thermo Fisher公司(美国)。
1.3 实验方法
1.3.1 细胞培养
大鼠嗜碱性白血病细胞系(RBL-2H3)培养在10%胎牛血清的MEM培养基中,加入100 U/mL青霉素,100 U/mL链霉素。将细胞在37℃,5% CO2的条件下在培养箱中培养。
1.3.2 OMBF的制备
使用Larousse概述的程序[6]制备OMBF,纯度大于98%,采用高效液相色谱法进行检测。OMBF: m.p. 110℃~112℃;1 hNMR (500 MHz, CDCL3) δ: 9.66 (2 H, S, 2CH=O), 7.26 (2H, d,J=3.5 Hz), 6.61 (2 H, d,J=3.5 Hz), 4.65 (4 H, S, -CH2OCH2-); ESIMSm/z235 [M+H]+。OMBF的制备与鉴定由中国医学科学院药物研究所林生研究员课题组完成。
1.3.3 剂量选择
根据中国药典,5%葡萄糖注射液中5-HMF含量不应超过11.8 μg/mL[7]。根据每天最大输注量为2000 mL,5%葡萄糖注射液中5-HMF的限量为每人每天23.6 mg。使用体表面积系数公式将人体数据转换为大鼠,大鼠的等效剂量为2.5 mg/kg。在前期实验的基础上,本研究选择5 mg/kg为低剂量,25 mg/kg为高剂量进行动物实验。
细胞实验根据MTT实验结果(数据未展示),本研究选择0.0502 mM、0.502 mM为5-HMF的低、高剂量,表示为5-HMF-L、5-HMF-H;0.0338 mM、0.338 mM为OMBF的低、高剂量,表示为OMBF-L、OMBF-H。选择作用时长为1 h,在该时间范围内,细胞存活率与正常未加药组无显著性差异。
1.3.4 Ⅰ型超敏反应体内实验设计
将21只SPF雄性BN大鼠随机按体重分为7组,分别为生理盐水对照组(NS),佐剂对照组(Adj.),卵清白蛋白组(Model),5-HMF-L,5-HMF-H,OMBF-L和OMBF-H。在适应环境一周后,于第1天、第3天和第5天,给药组每天一次尾静脉注射药物,使动物致敏。于第19天,腹主动脉采血,离心取血清,测定各项指标。对照组给予0.9%生理盐水,使用弗氏完全佐剂(FCA)对给药组BN大鼠进行第一次致敏和刺激,使用弗氏不完全佐剂(FICA)进行第二次和第三次致敏。阳性药组大鼠给予5%卵清白蛋白溶液(致敏浓度2.5 mL/kg)致敏。给药组将相应浓度的5-HMF和OMBF溶液与等体积的佐剂混合并尾静脉给药,激发剂量是致敏剂量的两倍。
给药30 min后用1%戊巴比妥钠溶液麻醉大鼠,腹主动脉采血并收集到含有凝血剂的冷冻管中。2500 r/min,4℃离心10 min,分离血清,-20℃保存,一个月内进行ELISA检测。
1.3.5 Ⅰ型超敏反应体外实验设计
大鼠含药血清的制备与I型超敏反应体内实验前期步骤相同,但是没有经过激发直接腹主动脉采集血清,并用ELISA试剂盒检测IgE浓度。
取RBL-2H3对数生长期的细胞,每毫升1×105个,接种到24孔板内。5% CO2,37℃孵化后,随机分为空白对照组,佐剂对照组,裂解组,模型组(Anti-IgE-DNP为抗体,以DNP-BSA为抗原),5-HMF组(低、高),OMBF组(低、高)。待细胞贴壁后,吸弃各组培养基,用相应的培养基稀释4倍的致敏血清刺激细胞24 h,使细胞处于致敏状态,模型组用750 ng/mL的Anti-DNP-IgE致敏。24 h后用改良台式液清洗两遍,加入改良台式液配置的不同浓度的药物,模型组加入1 μg/mL的DNP-BSA 200 μL,正常组加入200 μL改良台式液,裂解组加入200 μL浓度为1% 的TRItonx-100。在37℃,5% CO2条件下刺激1 h,取细胞上清。将细胞上清液和裂解液储存在-20℃下以用于后期实验指标的测定。
1.3.6 甲苯胺蓝染色
取对数生长期RBL-2H3细胞,调整细胞密度至每毫升1×105个,均匀铺在含有细胞爬片的6孔板内。待细胞贴壁后,将培养基配置的750 ng/mL的Anti-DNP-IgE孵育模型组细胞,佐剂对照组及各给药组分别加入培养基稀释4倍的血清孵育。24 h后用1 mL改良台式液洗涤两遍以清除残存培养基。后分别加入改良台式液配置的含有相应浓度药物的溶液200 μL,对照组用相同量的改良台式液替换,模型组加入200 μL DNP-BSA(1 μg/mL),刺激1 h后,冰浴使反应停止后,取出细胞爬片,立即置于95%乙醇中,细胞固定后取出细胞爬片滴入甲苯胺蓝染色溶液进行染色。在显微镜下观察细胞脱颗粒形态并拍照。
1.3.7 β-氨基糖苷酶(β-HEX)释放率的测定
在普通96孔板中,取50 μL各组别细胞上清,每组3个复孔,每孔加入100 μL酶底物,37℃恒温孵育箱中孵育45 min,后加入终止液(NaHCO3/Na2CO3)200 μL中止反应。使用酶标仪(DIALAB GmbH,Vienna,Austria)在405 nm的波长下测量光密度(OD)。β-氨基糖苷酶释放率(%)=(给药组OD-空白对照组OD)/(裂解组OD-空白对照组OD)×100%。
1.3.8 组胺(His)释放率测定
在全黑96孔板中,取100 μL各组别细胞上清,每组3个复孔,每孔加入20 μL NaOH溶液,20 μL组胺底物,37℃恒温孵育箱中孵育15 min,加入终止液3% HCl溶液20 μL中止反应。使用酶标仪(DIALAB GmbH,Vienna,Austria)在Ex/Em=460/350 nm的波长下测量荧光强度。组胺释放率(%)=(给药组荧光强度-空白对照组荧光强度)/(裂解组荧光强度-空白对照组荧光强度)×100%。
1.3.9 Western blot
选取对数生长期的RBL-2H3,调整细胞密度至每毫升1×105个,均匀铺在6孔板内。待细胞贴壁后,将培养基配置的750 ng/mL的Anti-DNP-IgE孵育模型组细胞,佐剂对照组及各给药组分别加入培养基稀释4倍的血清,正常组选择培养基继续培养。孵育24 h后用1 mL改良台式液洗涤两遍以清除残存培养基。模型组及各给药组分别加入改良台式液配置的1 μg/mL DNP-BSA及各浓度药物200 μL,对照组加入200 μL改良台式液。孵育1 h后用冷的PBS清洗细胞两遍,用细胞刮刮下各组细胞放入不同的1.5 mL Ep管中,离心后弃上清加入100 μL细胞裂解液在冰浴中裂解30 min,12 000 r/min离心取上清。取少量含蛋白的裂解液稀释10倍后使用BCA蛋白测定试剂盒进行蛋白定量。应用Western blot法检测在Ⅰ型超敏反应期间p-JNK,JNK,p-ERK,ERK,p-p38,p-38蛋白表达情况的改变。按照Kim描述的方法进行操作,并重复实验3次[8]。使用Image-Pro Plus分析软件(Media Cybernetics, Inc., MD, USA)进行进一步的图形分析。
1.4 统计学方法

2 结果
2.1 5-HMF和OMBF诱导的体内I型超敏反应
采用酶联免疫吸附试验(ELISA)测定血清中IgE、IgG以及IL-4的变化(见图1)。图1A显示5-HMF组和OMBF组的IgE含量与对照组相比均有显著增长。佐剂组与生理盐水对照组相比无明显变化。图1B显示,IgG水平的改变主要体现在5-HMF高剂量组以及OMBF剂量组。在图1C中,除佐剂组外,所有组均较生理盐水对照组有明显的增长。实验结果表明5-HMF及其二聚体OMBF在低、高剂量下均可诱导I型超敏反应的发生。
2.2 5-HMF和OMBF诱导的体外 I 型超敏反应
2.2.1 BN大鼠血清中IgE的测定结果
ELISA测定含药血清中IgE的含量(见图2),结果显示,除佐剂组,其余各组与生理盐水组的IgE含量相比均显著性增高,可用于后续实验对细胞的致敏刺激。

注: BN大鼠血清中IgE(A)、IgG(B)、IL-4(C)的含量测定;与NS组相比,*P<0.05。图1 BN大鼠血清中I型超敏反应相关指标的测定Note. The determination of IgE (A), IgG (B), and IL-4 (C) in the serum of BN rats.Compared with the NS group,*P<0.05.Figure 1 The determination of related indexes of type I hypersensitivity in serum of BN rats
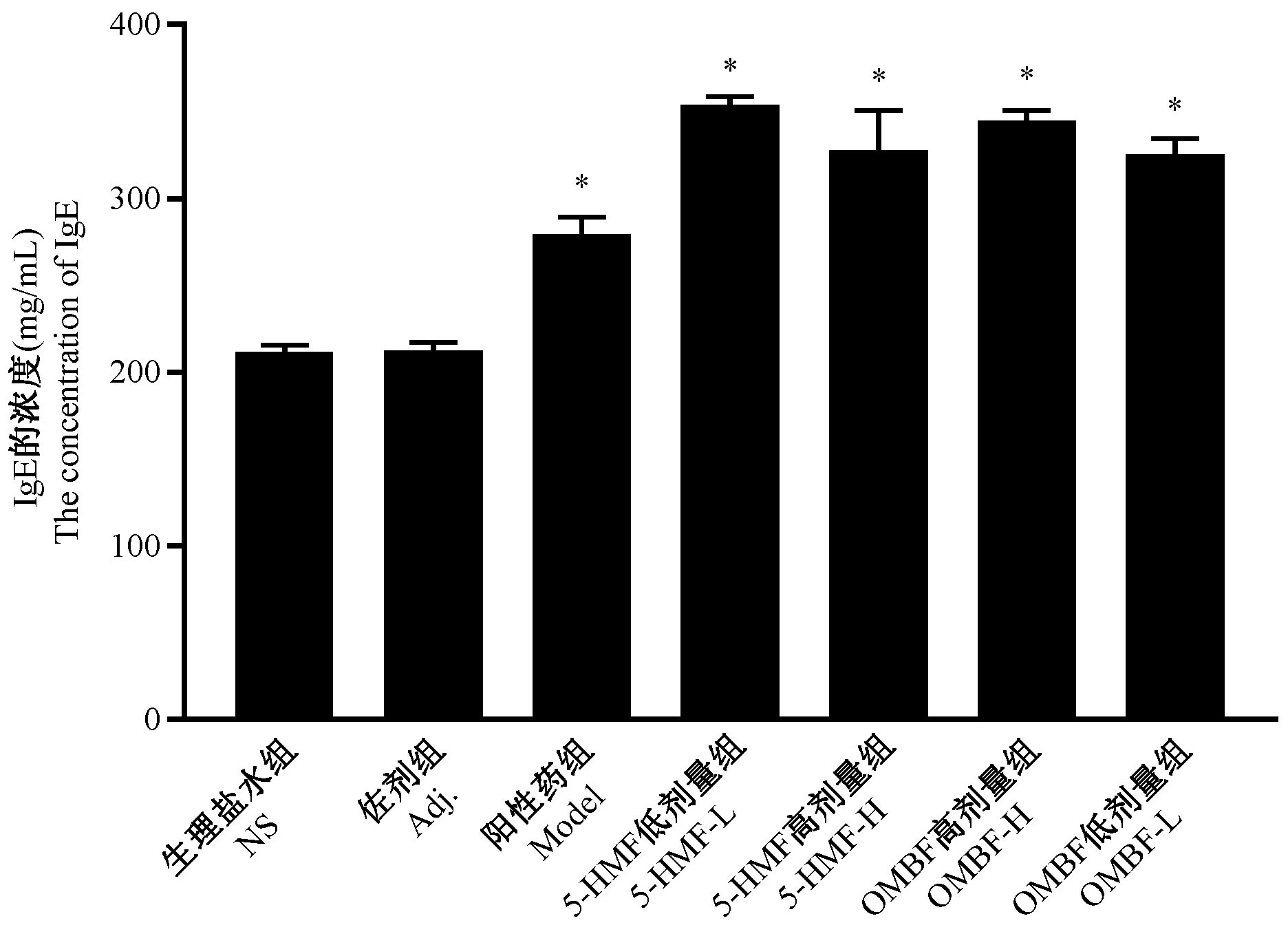
注:与NS组相比,*P<0.05。图2 含药血清中IgE含量测定Note. Compared with the NS group,*P<0.05.Figure 2 The determination of IgE in drug-containing serum
2.2.2 TB染色结果
甲苯胺蓝(Toluidine Blue O)是一种常用的人工合成染料,可以与肥大细胞的细胞质内肝素、组织胺等物质发生特异性染色[9]。
染色结果显示,佐剂组RBL-2H3细胞呈长梭形,边缘完整,结构致密,未见脱颗粒。而脱颗粒的细胞体积增大,边缘不整,出现大量的空泡或颗粒样结构。RBL-2H3细胞脱颗粒形态观察(见图3),模型组脱颗粒明显,可见大部分细胞膜破裂,有颗粒样物质渗出。5-HMF及OMBF低剂量组部分细胞结构保持完整,仍可见大量脱颗粒细胞。5-HMF及OMBF高剂量组大部分细胞均出现了脱颗粒的现象,细胞边缘不整,细胞密度减低,出现颗粒样尾状结构。由上述结果可知,RBL-2H3细胞在OMBF高剂量作用下脱颗粒较为严重,即OMBF的免疫毒性高于单体5-HMF。
2.2.3 β-氨基糖苷酶释放情况
β-氨基糖苷酶(β-HEX)被认为是间接反映细胞脱颗粒情况的重要指标[10-11]。通过测定细胞上清中β-HEX的含量,计算各给药组释放率来判断各给药组产生的免疫毒性的强弱。实验结果显示(见图4),各给药组除佐剂组外均出现了显著性差异,且OMBF高剂量组诱导细胞上清中的β-HEX的释放量高于5-HMF。
2.2.4 组胺的释放情况
组胺(Histamine)在人体中分布广泛,主要存在于肥大细胞以及嗜碱性细胞中,由组氨酸经组氨酸脱羧酶(HDC)脱羧而产生,是反映细胞脱颗粒严重程度的重要指标[10,12]。实验结果显示(见图5),给药组刺激RBL-2H3细胞,高剂量组和模型组出现了显著性差异。提示较高剂量的5-HMF及其二聚体均能诱导细胞脱颗粒产生免疫毒性。
2.3 Western blot结果
蛋白免疫印迹法检测用于研究在Ⅰ型超敏反应期间p-JNK,JNK,p-ERK,ERK,p-p38,p38在RBL-2H3细胞中的表达,结果以磷酸化蛋白和总蛋白的表达量比值呈现(见图6)。与空白对照组相比,ERK,JNK和p38的磷酸化水平表达均上调。在5-HMF和OMBF的作用下,蛋白表达上调的水平未表现出明显的剂量差异性,但从JNK和p38的磷酸化蛋白表达结果分析,OMBF比5-HMF更能促进磷酸化蛋白的表达,表现出了更强的免疫毒性。
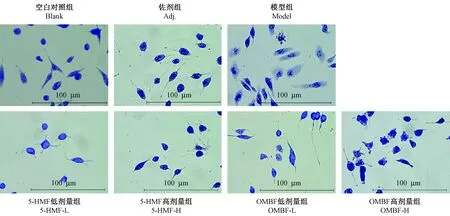
注:上行显示的是RBL-2H3细胞的正常形态及佐剂和阳性药作用后的细胞形态,下行显示的是RBL-2H3细胞经不同剂量的5-HMF及OMBF刺激后的细胞形态。图3 RBL-2H3细胞脱颗粒形态观察Note. The upper line shows the normal morphology of RBL-2H3 cells and the morphology of the cells stimulated by adjuvant and positive drugs. The next line shows the morphology of RBL-2H3 cells stimulated by different doses of 5-HMF and OMBF.Figure 3 The observation of RBL-2H3 cells

注:与Blank组相比,*P<0.05。图4 RBL-2H3细胞上清中β-HEX释放率的测定Note. Compared with the Blank group,*P<0.05.Figure 4 Determination of β-HEX release rate in supernatant of RBL-2H3 cells

注:与Blank组相比,*P<0.05。图5 RBL-2H3细胞上清液中His释放率的测定Note. Compared with the Blank group,*P<0.05.Figure 5 Determination of His release rate in supernatant of RBL-2H3 cell
3 讨论
先前的研究发现5-HMF具有抗氧化、抗组织缺氧等生理药理作用[13-15]。然而,研究表明该物质具有毒理学特性,5-HMF具有皮肤、粘膜和呼吸道刺激性[16]。此外,关于5-HMF的致突变性和致癌性尚且存在争议[17-20]。基于上述原因,中国药典和美国药典将葡萄糖注射液在加热和贮存过程中产生的5-HMF视为有害杂质。同样,在一定条件下,5-HMF会发生聚合生成其二聚体产物OMBF,已经发现部分中药注射剂中同时含有5-HMF和OMBF[21]。然而,到目前为止,关于OMBF的潜在毒性的研究很少,值得确认和探索可能的毒性与机制。
我们采用体内实验与体外实验相结合的方式,在体内实验中,采用免疫系统发达的Brown Norway(BN)大鼠作为研究对象,通过测定给药前后血清中IgG、IgE和炎性因子的含量变化探究药物的免疫毒性。除了IgG之外,还可以更精准的测定IgG1的含量,在今后的相关实验中我们将加以考虑。体外实验采用大鼠嗜碱性粒细胞(RBL-2H3)系,RBL-2H3细胞表面Fc受体大量表达,是用于研究I型超敏反应的常用细胞系。众所周知,I型超敏反应需要致敏和激发两个阶段,我们通过获取大鼠含药血清,孵育细胞24 h使细胞致敏,后加入相应浓度药物,模拟机体I型超敏反应的全过程。通过甲苯胺蓝染色观察细胞脱颗粒形态,直接反映药物免疫毒性的强弱。通过测定细胞上清中典型指标β-氨基糖苷酶及组胺的释放量,通过比较给药组与空白对照组释放率的差异来判断药物免疫毒性的强弱。MAPK信号通路的激活在I型超敏反应中起重要作用,是抗过敏药物的靶点,其特征在于活化后,磷酸化蛋白表达增多。MAPK信号通路与炎性介质的释放息息相关,而过敏反应中IL-4等炎性介质显著升高。因此,本研究在免疫毒性评价的基础上,对5-HMF及其二聚体OMBF引起的MAPK通路中p-JNK,p-ERK和p-p38这三种蛋白表达量的变化进行了研究,以此确定5-HMF及其二聚体OMBF产生免疫毒性可能的作用通路。
通过体外和体内实验模型,本研究发现5-HMF和OMBF作为小分子过敏原均可诱导I型超敏反应的发生。5-HMF及OMBF组内低、高剂量之间并未表现出显著的差异性,这可能与引发免疫反应的物质量效关系不明显有关,在今后我们的相关研究中会对其进一步观察和验证。从甲苯胺蓝染色的结果来看,OMBF诱导细胞脱颗粒的严重程度明显高于5-HMF,表现出了更强的免疫毒性。从Western blot的结果也可以看出,OMBF诱导RBL-2H3细胞p-p38以及p-JNK的表达量高于5-HMF组的表达量,从蛋白表达上进一步证实了5-HMF聚合生成OMBF后毒性增加,且二者产生的免疫毒性与MAPK家族蛋白磷酸化表达上调有关。结合本课题组前期研究结果,表明5-HMF和OMBF可同时导致过敏反应以及类过敏反应的发生,且产生相似的症状[22],于是我们提出了新的假设,认为过敏反应与类过敏反应在作用通路上存在相同的地方,我们将会进一步完善二者的机制通路,因此二者在机制上的区别和联系将会成为下一步研究的重点。

