沉香型白酒酒醅理化特性及细菌群落结构研究
杨 磊,程铁辕,吴树坤,卫春会,黄治国*
(1.沈酒集团有限公司,四川 泸州 646000;2.四川出入境检验检疫局 国家酒类检测重点实验室,四川 宜宾 644000;3.四川省泸州市酒业发展促进局,四川 泸州 646000;4.四川轻化工大学 酿酒生物技术及应用四川省重点实验室,四川 自贡 643000)
中国白酒是世界六大蒸馏酒之一。中国白酒的独特之处不仅仅是因为历史悠久,风格独特,更因为其发酵方式——“开放式固态酿造、多菌复合发酵”,这在种类繁多的世界酒林中都非常罕见[1]。根据白酒的不同风味分为浓、清、米、酱四大香型以及在此基础上衍生出的其他香型。沉香型白酒是在清、浓、酱三大香型白酒的基础上研发出的一种新型白酒,既继承了传统的酿造工艺,又在传统工艺的基础上进行了创新。沉香型白酒的酿造是以加入了26种中药材粉的高温大曲作糖化发酵剂,将粮糟堆积发酵后,再以窖池为容器进行发酵[2]。独特的工艺使得沉香型白酒兼具酱、浓、清、药等多个香型的特点,酒体沉香怡人、醇厚绵甜、圆润协调、余味爽净。
沉香型白酒作为一种新兴的酒品,被誉为中国第13大香型白酒,其独特的复合风味越来越受到消费者的喜爱,同时也引起了相关研究人员的关注。因此,想要更清晰的了解沉香型白酒独特风味的形成需要对沉香型白酒的酿造环节进行深入研究。目前,关于沉香型白酒的报道较少,吴树坤等[3]对沉香型酒醅中芽孢杆菌(Bacillus)进行了分离鉴定以及代谢产物分析,结果共分离获得产香良好的地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)等4株菌,其风味产物包含3-羟基-2-丁酮、2,3-丁二醇等典型的风味成分。此外,随着高通量测序技术的成熟应用,为研究白酒酿造过程中微生物的多样性提供了较好的研究手段[4]。郭敏等[5]采用高通量测序技术对酱香白酒酒醅中微生物多样性研究发现,不同轮次酒醅中的微生物差异较大,其中第3轮次酒醅中优势菌为细菌中的乳杆菌属(Lactobacillus)、芽孢杆菌属以及真菌中的嗜热真菌属(Thermomyces)和嗜热子囊菌属(Thermoascus aurantiacus),而第7轮次酒醅中优势菌属为细菌中的盐单胞菌属(Halomonas)和真菌中的隐球菌属(Cryptococcus)。
本研究采用上、下层沉香型出池酒醅为试验对象,对酒醅基本理化特性进行测定并提取其宏基因组,采用高通量测序技术分析其原核微生物多样性;同时采用气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪分析酒醅的挥发性风味成分。旨在更深入的了解沉香型白酒独特风味的形成和细菌群落结构组成特点,并为其发展和工艺条件的改进提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
沉香型出池酒醅;川南某酒厂,以黄水线以上为上层酒醅(编号CX01),黄水线以下为下层酒醅(编号CX1),不同酒醅均采用五点取样法,并混合均匀,4 ℃保存待用。
1.1.2 试剂
氢氧化钠、五水硫酸铜、葡萄糖、亚甲基蓝、酒石酸钾钠、亚铁氰化钾(均为分析纯):成都科龙化工试剂厂;氯仿(分析纯):重庆川东化工(集团)有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)-Na2、饱和酚、十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)(均为分析纯):北京索莱宝科技有限公司;三羟甲基氨基甲烷(分析纯):美国Sigma-Aldrich公司。
1.2 仪器与设备
HWS-12恒温水浴锅:上海一恒科学仪器有限公司;SW-CJ-1F型超净工作台:江苏苏净集团有限公司;Lynx6000高速落地离心机:赛默飞世尔科技有限公司;MyCycler型聚合酶链式反应(polymerase chain reaction,PCR)仪、JY-SP-C型水平电泳槽:美国Bio-Rad公司;DA-155高精度数显酒精浓度计:上海点将精密仪器有限公司。
1.3 方法
1.3.1 酒醅理化指标的测定
淀粉含量、还原糖含量、酸度的测定均参考文献[6]。酒精度的测定参考文献[7]的方法,并采用数显酒精计进行酒精度的测定。
1.3.2 酒醅中挥发性风味成分的测定
酒醅中挥发性风味成分的测定方法参考郎召伟等[8]的研究,并做适当调整,具体步骤如下:
样品预处理:称取酒醅2.0 g于顶空瓶中,55 ℃预热15 min,采用50/30 μm DVB/CAR on PDMS固相微萃取头萃取30 min后,230 ℃解吸5 min,进行GC-MS分析。
GC条件:DB-WAX毛细管色谱柱(60.0 m×0.25 mm×0.25 μm);进样口温度230 ℃;不分流;程序升温:40 ℃保持1 min,以6 ℃/min升至180 ℃,保持2 min,再以15 ℃/min升至230 ℃,保持15 min;载气为高纯氦气(He),载气流速为1 mL/min。
MS条件:四极杆温度150 ℃,离子源温度230 ℃,电离方式为电子电离(electron ionization,EI)源,电离电压70 eV,质量扫描范围为20~500 amu,溶剂延迟时间3 min。
定性及定量分析:质谱图通过与美国Agilent公司提供的标准谱库(NIST05a.L)比对,利用匹配度均>80%、特征离子进行定性分析,并鉴定结果予以确认[9]。以乙酸丁酯为内标加入到酒醅中,使其终质量浓度为1 mg/100 g,通过计算样品中风味物质的峰面积与乙酸丁酯峰面积之比并结合乙酸丁酯的浓度来进一步计算其含量[10]。
1.3.3 酒醅细菌多样性分析
采用酶物理化学法[11]提取酒醅总脱氧核糖核酸(deoxyribonucleic acid,DNA),具体步骤参考闫亮珍等[12]的研究。由北京百迈客生物科技有限公司完成高通量测序。
1.3.4 数据处理
酒醅理化指标的试验结果用平均值±标准差表示,使用SPSS 19.0软件对数据进行独立样本T检验,并用Excel 2010编辑作图。将高通量测序所得序列与Silva数据库进行比对,获得酒醅中微生物的物种信息。
2 结果与分析
2.1 酒醅理化指标的测定
沉香型酒醅理化指标的测定结果见图1。
在白酒发酵过程中,淀粉是酒精以及其他代谢产物的物质基础。酒醅淀粉含量的测定能有效判断原料中淀粉是否利用充分以及酒醅是否需要继续入窖发酵,进而可调节酒企的原料成本以及时间消耗。由图1A可知,上层酒醅的淀粉含量达到11.94 g/100 g,而下层酒醅的淀粉含量显著低于上层酒醅(P<0.05),仅为6.15 g/100 g。由此可得,下层酒醅的发酵更加彻底,这是由于随着发酵时间的进行,窖池底部会积累大量黄水,而黄水可作为介质能较快进行物质与能量的交换[13],微生物生长代谢更加活跃,淀粉利用更加充分,而上层酒醅在发酵过程中,水分含量相对较低,物质传动性较差,微生物生长受限,甚至淀粉酶等酶系可能随水分流动转移至下层,导致上层酒醅淀粉利用率较下层酒醅更低。有研究表明,出池酒醅的淀粉含量可达到6%~9%[7,14]。因此,可判断上层酒醅的淀粉利用并不充分,可再进行多轮次的发酵。
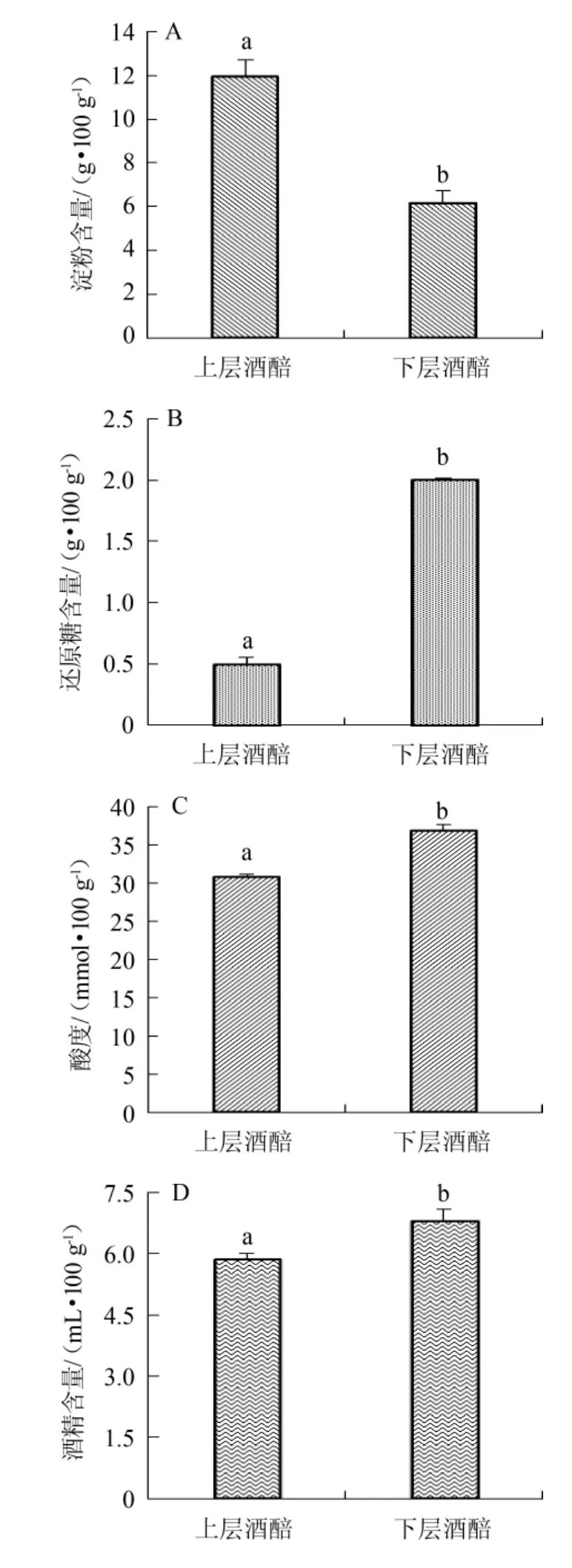
图1 沉香型酒醅理化指标的测定结果Fig.1 Determination results of physicochemical indexes of Chen-flavor fermented grains
还原糖由淀粉酶、糖化酶催化淀粉而生成,是酒醅微生物发酵的主要能量来源。而白酒酿造是边糖化边发酵的过程,酒醅中还原糖的含量,在一定程度上能反应酒醅发酵速度以及发酵情况。因此,还原糖含量是衡量酒醅发酵质量的重要指标之一。由图1B可知,上层酒醅还原糖的含量仅为0.5 g/100 g,下层酒醅还原糖的含量显著高于上层酒醅(P<0.05),高达2.0 g/100 g。该结果与黄治国等[14]对浓香型酒醅还原糖含量的研究结果相似。结合图1A可得,酒醅中还原糖含量与淀粉含量呈相反的关系,这是由于还原糖具有水溶性,在酒醅发酵过程中,淀粉被淀粉酶、糖化酶分解,生成葡萄糖,同时淀粉间吸收的水分被释放出来,并向下流动,使得下层酒醅葡萄糖含量高于上层酒醅,促使下层酒醅中微生物获得更多的能量物质及酶系,进一步解释了下层酒醅淀粉含量低于上层酒醅的现象。而下层酒醅中残留的大量还原糖使其具有进一步的利用空间。
酸度主要是由窖池内产酸菌有机酸的代谢和其他酸性物质组成。酸性环境有利于防止杂菌的污染,同时丰富的有机酸类物质作为主要风味物质的同时,也为酯类物质的生成提供丰富的物质基础。由图1C可知,下层酒醅的酸度显著高于上层酒醅(P<0.05),这是由于沉香型白酒采用窖池发酵,底部窖泥含有丰富的产酸菌,而下层酒醅充分接触窖泥,同时在黄水的传质作用下,大量的产酸微生物在下层酒醅中生长代谢,而上层酒醅为固态发酵体系,产酸菌的迁移及生长均较慢。
酒精是窖内发酵中最重要的产物,也是衡量酒醅发酵质量的主要指标。由图1D可知,下层酒醅的酒精含量达到6.82 mL/100 g,显著高于上层酒醅(P<0.05)。这是由于下层酒醅受上层酒醅的重力作用,使得其厌氧环境更加良好,而酒精是酵母在厌氧条件下主要的发酵产物。结合图1A和图1B不难发现,下层酒醅中酒精含量高与其淀粉质原料消耗的更加充分、发酵环境更加适合密不可分。
2.2 酒醅中挥发性风味成分的测定
采用GC-MS法对酒醅中的挥发性风味成分进行定性半定量分析,可初步判断酒醅中风味物质种类与含量的组成特点,总离子流色谱图见图2,挥发性风味成分的种类及含量见表1。
由表1可知,从沉香型酒醅中共检测出26种主要挥发性风味成分(乙醇不纳入分析),其中包含20种酯类物质。上、下层酒醅中总酯含量分别为69.45 mg/100 g和75.49 mg/100 g,分别占总量的94.8%和86.8%,结果表明,沉香型酒醅中酯类物质是其绝对优势风味产物,且酒醅中产异香较少。该结果基本符合沉香型白酒复合香浓郁、无异杂味的特点。典型的风味成分包括乙酸乙酯、丁酸乙酯、己酸乙酯、乳酸乙酯、己酸、丁酸,通过比较上、下层酒醅中这些成分发现,上层酒醅中乙酸乙酯含量比下层酒醅高40.4%,但下层酒醅中的丁酸乙酯含量比上层酒醅高57.6%,下层酒醅中含量最高的己酸乙酯和乳酸乙酯均高于上层酒醅;此外,下层酒醅中己酸、丁酸的含量远高于上层酒醅。综合来看,沉香型酒醅具有浓香型酒醅风味组成特点,但其又含有较丰富的十六酸乙酯、亚油酸乙酯等长碳链乙酯。
图2 沉香型酒醅中挥发性风味物质GC-MS分析总离子流色谱图Fig.2 Total ions chromatogram of volatile flavor components in Chen-flavor fermented grains analyzed by GC-MS
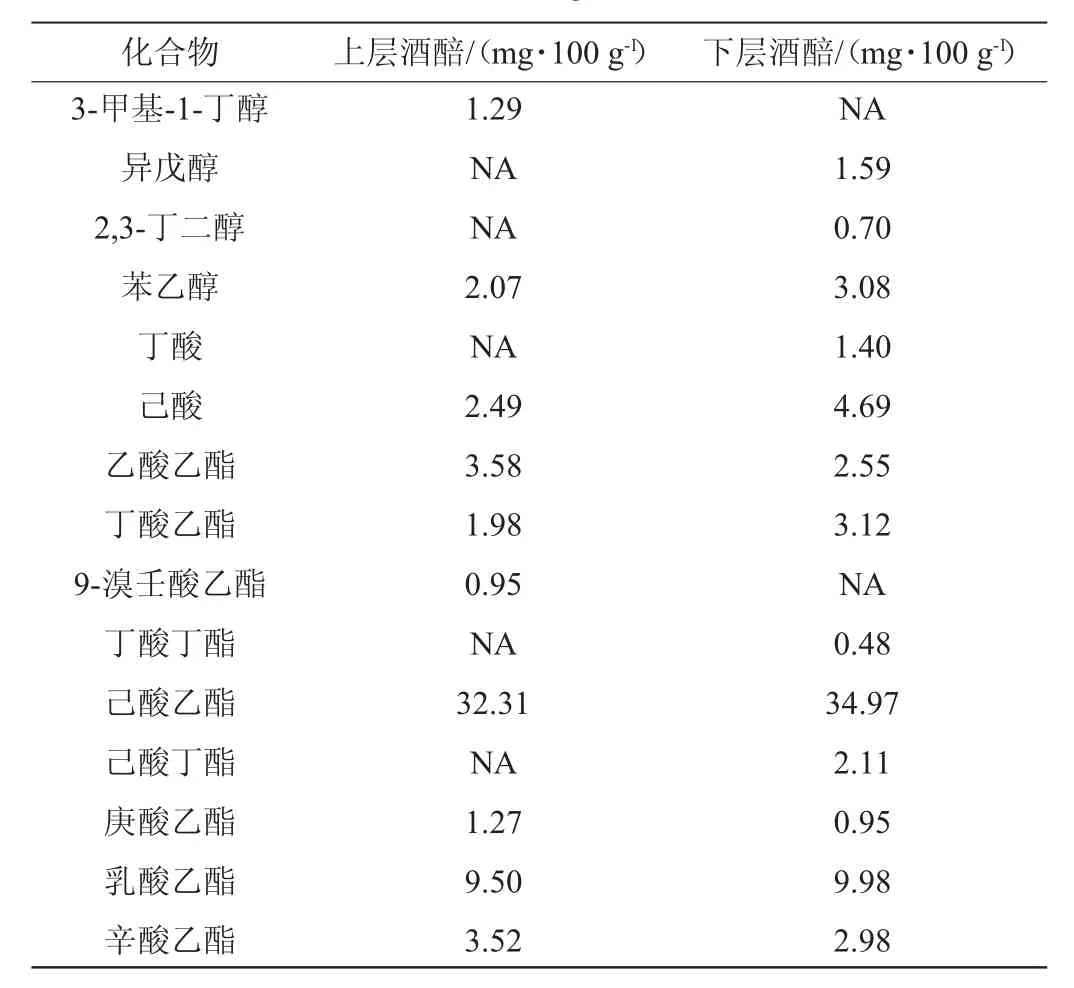
表1 沉香型酒醅中挥发性风味成分的种类及含量Table 1 Types and contents of volatile flavor components in Chen-flavor fermented grains
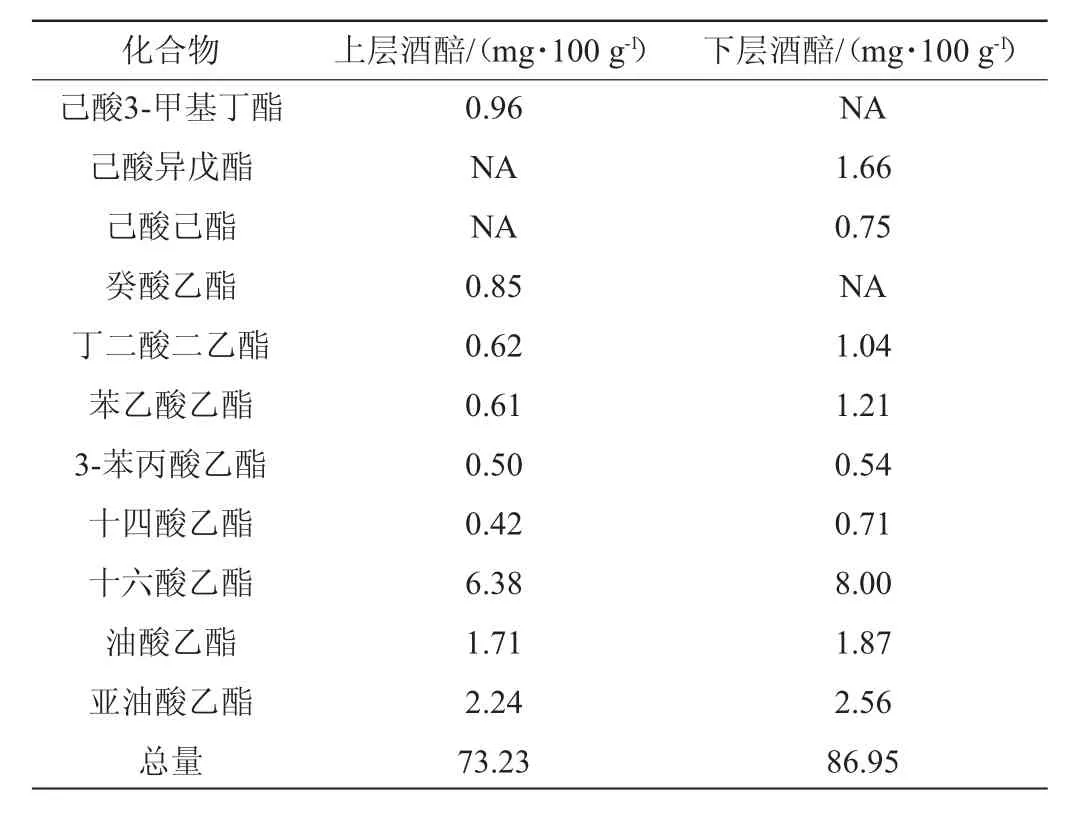
续表
2.3 酒醅细菌群落结构分析
2.3.1 酒醅总DNA的检测
采用1%的琼脂糖凝胶电泳检测酒醅总DNA,结果见图3。由图3可知,酒醅总DNA的碱基长度均在15 000 bp左右,且条带清晰单一,故提取效果较好,即可送样测序。
图3 沉香型酒醅总DNA琼脂糖凝胶电泳结果Fig.3 Agarose gel electrophoresis results of genomic DNA of Chen-flavor fermented grains
2.3.2 序列有效性分析
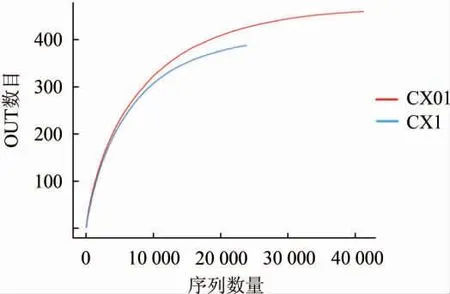
图4 沉香型酒醅样品稀释性曲线Fig.4 Dilution curve of Chen-flavor fermented grains samples
稀释曲线是用来评价测序量是否足以覆盖所有类群,从而判断测序深度是否达到测序饱和。当曲线趋向平缓时,表明测序数据量合理,更多的数据量只会产生少量新的操作分类单元(operational taxonomic units,OTU),反之则表明继续测序还可能产生较多新的OTU[15]。沉香型酒醅样品稀释性曲线见图4。由图4可知,沉香型酒醅样品的OTU数目随测序量的增加呈先上升后趋于平缓的趋势,因此可判定测序深度能够反映样本中绝大多数微生物信息,测序数据量较为合理。
2.3.3 Alpha多样性分析
上、下层酒醅样品中细菌群落在OTU水平下的分布情况见图5。由图5可知,酒醅中共获得499个OTU,其中上层酒醅含有460个OTU,明显高于下层酒醅(388个),表明上层酒醅的细菌多样性高于下层酒醅。另一方面,上、下层酒醅中共有OTU数为349个,占总数的70%,而上、下层酒醅则分别单独含有111个OTU和39个OTU,表明上、下层酒醅中大多数细菌群落是相同的,但又存在一定的差异性。
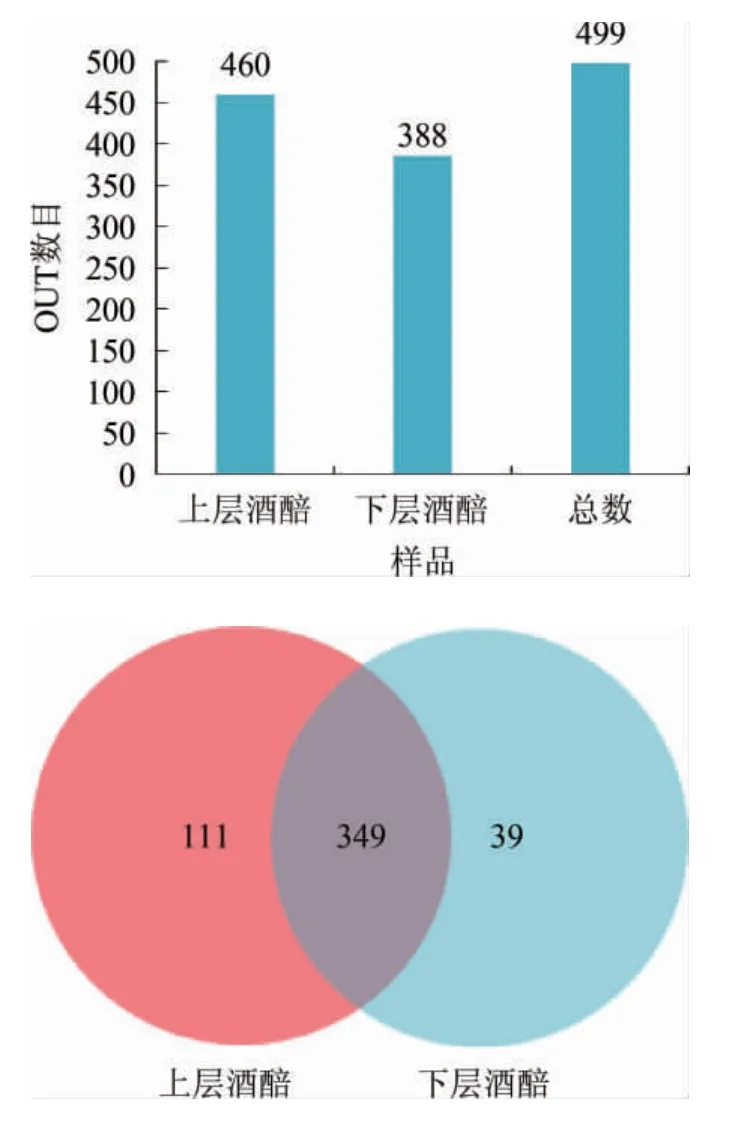
图5 OTU分类水平下细菌的分布及韦恩图Fig.5 Distribution and Venn diagram of bacteria at OTU taxonomic level
2.3.4 酒醅中细菌群落结构分析
将高通量测序所得序列与Silva数据库比对,得到序列的分类学信息,结果见图6。
由图6可知,在门分类学水平下,沉香型酒醅样品中共获得7个门类的细菌,分别是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)、梭杆菌门(Fu sobacteria)、异常球菌-栖热菌门(Deinococcus-Thermus),这与绵甜型白酒酒醅细菌群落结构相似[16]。其中,厚壁菌门为绝对优势菌,在上层酒醅中其相对丰度>65%,在下层酒醅中其相对丰度>98%;而上、下层酒醅细菌门类最大的差异在于上层酒醅中含有丰富的变形菌门,相对丰度>30%;此外,上层酒醅中的放线菌门、拟杆菌门的相对丰度也明显高于下层酒醅。
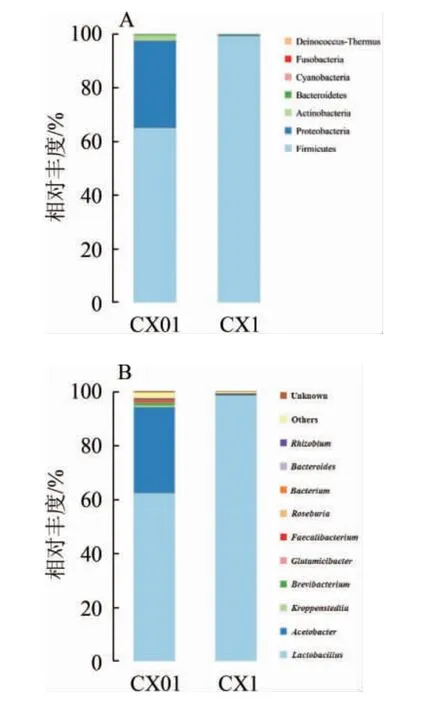
图6 门(A)和属(B)分类水平下沉香型酒醅中细菌群落结构Fig.6 Bacterial community structure in Chen-flavor fermented grains at taxonomic level of phylum (A) and genus (B)
在属分类学水平下,沉香型酒醅样品中共获得10个优势细菌属(相对丰度>1%),分别为乳杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)、根瘤菌属(Rhizobium)、Kroppenstedtia、短杆菌属(Brevibacterium)、谷氨酸杆菌(Glutamicibacter)、粪杆菌属(Faecalibacterium)、罗斯拜瑞氏菌属(Roseburia)、杆菌属(Bacterium)、拟杆菌属(Bacteroides)。其中,上层酒醅中占主导地位的是乳杆菌属和醋酸杆菌属,而下层酒醅中乳杆菌属是唯一优势菌。其二者之间最大的差异在于上层酒醅中醋酸杆菌属相对丰度>30%,而下层酒醅中相对丰度却<1%。相关研究表明[17-19],乳杆菌属、醋酸杆菌属也是浓香型、酱香型、清香型白酒酒醅中的优势细菌属。此外,沉香型下层酒醅更偏向于浓香型酒醅的细菌群落特点,二者均在发酵结束时以乳杆菌属为唯一优势菌[20-22]。通过比较发现,上层酒醅的细菌多样性明显高于下层酒醅,这是由于微生物的生长受发酵环境影响较大,结合图1C酸度的结果可得,下层酒醅的酸度显著高于上层酒醅(P<0.05),由于下层酒醅在酒醅发酵后期受黄水的包裹,pH值能降至3.2以下[23],而在这种酸性较强的环境中,绝大多数微生物是不能正常生长的,因此导致上层酒醅微生物的多样性明显高于下层酒醅。
3 结论
通过高通量测序技术初步探究沉香型酒醅的细菌群落结构,并对其理化指标以及挥发性风味成分进行分析。结果表明,理化指标方面,上层酒醅的淀粉含量显著高于下层酒醅(P<0.05),而下层酒醅的还原糖含量、酸度和酒精含量均显著高于上层酒醅(P<0.05)。挥发性风味成分方面,沉香型酒醅中酯类物质是其优势风味产物,分别占上、下层酒醅风味含量的94.8%和86.8%;其中丁酸乙酯、己酸乙酯、乳酸乙酯、己酸、丁酸等典型风味物质在下层酒醅中的含量均明显高于上层酒醅。细菌多样性方面,沉香型上层酒醅中的优势细菌属为厚壁菌门(Firmicutes)的乳酸杆菌属(Lactobacillus)和变形菌门(Proteobacteria)的醋酸杆菌属(Acetobacter),而下层酒醅中则以厚壁菌门的乳酸杆菌属为其唯一的优势菌属;此外,通过比较发现,上层酒醅中细菌的多样性较下层酒醅更为丰富。通过本研究加深了对沉香型白酒酿造的认识,从而为沉香型白酒酿造工艺的改进提供一定的理论基础,进而推进沉香型白酒的发展。

