妊娠期糖尿病孕妇孕期氧化应激水平分析
余 俊,贾 静,曾 宇,张婧怡,韦丽杰,王少帅,冯 玲
(华中科技大学同济医学院附属同济医院妇产科,湖北 武汉 430030)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指孕妇既往无明确糖尿病病史,在妊娠期间首次发生的糖代谢障碍,是妊娠期常见的并发症。全世界约15%的孕妇会合并糖尿病,其中87.5%是GDM[1]。GDM给母胎和新生儿带来了严重的不良影响,不仅增加了孕妇子痫前期、自身代谢紊乱、剖宫产的发生率,还增加了流产、早产、难产、巨大儿、胎儿宫内窘迫/死亡、新生儿窒息、新生儿肺发育不成熟、新生儿死亡、新生儿低血糖症等风险,其中新生儿肺发育不成熟是导致新生儿窒息甚至死亡的主要原因之一[2]。大多数患有GDM的妇女在分娩后可恢复正常的糖代谢,但在以后的生活中患糖尿病的风险增加[3]。因此,GDM被认为是糖尿病前期状态,两者的病理学改变明显相关。近年来的研究表明,脂代谢异常能通过介导氧化应激等信号转导通路广泛参与肥胖、2型糖尿病等一系列代谢相关性疾病的病理生理过程[4]。然而,关于氧化应激参与GDM的机制尚不明朗。炎症是氧化应激的一种表现,氧化应激可诱发产生多种炎症介质,如肿瘤坏死因子α(TNF-α)等。TNF-α拥有较强的生物学活性,作用于众多疾病的炎症反应中。TNF-α主要分布在血管内皮细胞,可直接影响胰岛细胞,造成胰岛素抵抗,并最终导致糖尿病的发生[5]。8-异前列腺素F2α(8-iso-PGF2α)是异前列腺素中性质最稳定和含量最多的一种代谢产物,能够准确、稳定地反映体内脂质氧化应激和脂质受自由基诱导后过氧化程度[6]。2型糖尿病患者循环和尿中的8-iso-PGF2α浓度升高[6-7]。此外,有研究显示8-iso-PGF2α与胎儿生长受限、胎死宫内、胎盘早剥、低出生体重、绒毛膜羊膜炎等相关[8]。通过对这些因子的特性探讨,对预测及干预GDM具有潜在的重要意义。
本研究拟通过测定GDM患者及正常孕妇中TNF-α、8-iso-PGF2α的水平差异,探讨氧化应激与GDM发病机制的相关性,为GDM患者进行孕期抗氧化治疗提供依据;同时探讨孕早期检测血清TNF-α和8-iso-PGF2α浓度,以预测GDM发生的可行性。
1资料与方法
1.1资料来源
选取2016年11月至2017年11月在华中科技大学同济医学院附属同济医院正规产检和手术分娩的孕妇作为研究对象,排除糖尿病、高血压病、慢性肝肾疾病及甲状腺等内分泌疾病。对孕11~13周经超声确认正常单胎妊娠孕妇263例,于孕24~28周行75g口服葡萄糖耐量试验(OGTT),依据GDM诊断标准[9]纳入GDM患者为GDM组,同期非GDM孕妇为对照组。所有研究对象均签署知情同意书,并取得医院伦理委员会的批准。
根据OGTT结果将研究对象分组后,收集研究对象不同孕期的血清样本。将两组研究对象根据孕周分为三期:A组(孕11~13+6周)、B组(孕24~29+6周)、C组(孕37~40+6周)。足月后,于本院分娩的研究对象在胎儿娩出后采集脐血。最终纳入25例GDM患者为GDM组,同期25例非GDM患者为对照组。
1.2诊断标准
本研究依据谢幸主编《妇产科学》:孕24~28周75g OGTT,空腹血糖≥5.1mmol/L,OGTT 1h血糖≥10.0mmol/L,OGTT 2h血糖≥8.5mmol/L,上述血糖之一超标即诊断GDM。
1.3检测方法
在早孕期测量孕妇身高(m)和体重(kg),计算身体质量指数(BMI),BMI=体重/身高2。所有入组孕妇每次空腹采集静脉血2mL,分娩时抽取脐静脉血3mL。所有血液标本缓慢贴壁注入含有肝素钠的抗凝管中,室温静置30min,3 000rpm离心10min后吸取上层血清,存于-80℃冰箱待检。
采用酶联免疫吸附试验测定孕妇外周血和脐血血清中TNF-α和8-iso-PGF2α水平。试剂盒包括纯化的羊抗兔IgG抗体包被的微孔板、兔抗人TNF-α或8-iso-PGF2α抗体和辣根过氧化物酶(HRP)标记的二抗及相关试剂组成。在酶标仪上进行定量检测。
检测前1h把试剂盒和待测样品从-80℃冰箱内取出,放在室温下复温。将标准品倍比稀释,将样品稀释液作为标准浓度0g/mL。在酶联板上依次设定空白孔、标准孔和样品孔。空白孔添加50μL样品稀释液,余孔依次加入50μL各浓度的倍比稀释标准品或待测样品。使用盖板膜覆盖酶标板,室温下置于摇床上反应。3h后弃去孔内液体并甩干,每孔加入检测工作液,放入37℃温箱内反应1h。弃去孔内液体,并洗涤3次。依次给每个孔添加200μL底物溶液,37℃避光显色45min后终止反应。使用酶标仪在405nm波长检测各孔OD值。利用标准品制作标准曲线,再根据标准曲线计算各样品OD值的对应浓度。
1.4统计学方法

2结果
2.1一般临床资料的比较
GDM组与对照组的年龄、孕前BMI、孕产次比较均无显著性差异(均P>0.05),见表1。
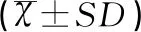
表1 孕妇的一般情况Table 1 General information of all pregnant
2.2外周血生化指标比较
2.2.1对照组各孕期血清TNF-α和8-iso-PGF2α水平的比较
对照组各孕期血清TNF-α水平分别为:A组(11.76±2.94)μg/mL,B组(19.10±4.78)μg/mL,C组(20.94±4.06)μg/mL,孕中期(B组)显著高于孕早期(A组)(t=6.544,P<0.001),孕中期(B组)与孕晚期(C组)比较无显著性差异(t=1.466,P=0.149)。
对照组各孕期血清8-iso-PGF2α水平分别为:A组(114.25±14.72)pg/mL,B组(107.38±27.06)pg/mL,C组(118.66±7.73)pg/mL,孕早期(A组)与孕中期(B组)比较无显著性差异(t=1.115,P=0.270),孕中期(B组)与孕晚期(C组)比较无显著性差异(t=2.004,P=0.051)。
2.2.2 GDM组各孕期血清TNF-α和8-iso-PGF2α水平的比较
患者在确诊GDM前血清TNF-α、8-iso-PGF2α水平已升高,并随着妊娠进展逐渐增加。
GDM组各孕期血清TNF-α水平分别为:A组(16.87±2.33)μg/mL,B组(21.67±3.30)μg/mL,C组(25.83±2.88)μg/mL,孕中期(B组)显著高于孕早期(A组)(t=5.937,P<0.001),孕晚期(C组)显著高于孕中期(B组)(t=4.746,P<0.001)。
GDM组各孕期血清8-iso-PGF2α水平分别为:A组(121.63±11.25)pg/mL,B组(150.91±30.89)pg/mL,C组(268.50±25.21)pg/mL,孕中期(B组)显著高于孕早期(A组)(t=4.454,P<0.001),孕晚期(C组)显著高于孕中期(B组)(t=14.747,P<0.001)。
2.2.3 GDM组与对照组各孕期血清TNF-α、8-iso-PGF2α水平的比较
GDM组各孕期血清TNF-α水平均显著高于对照组(A组:t=6.820,P<0.001,B组:t=2.212,P=0.032,C组:t=4.910,P<0.001),见图1;GDM组各孕期血清8-iso-PGF2α水平也均高于对照组,在孕中期(B组)和孕晚期(C组)均有显著性差异(B组:t=5.301,P<0.001,C组:t=28.414,P<0.001),而在孕早期(A组)无显著性差异(A组:t=1.992,P=0.052),见图2。

注:*P<0.05。
图1孕妇外周血TNF-α检测对比结果
Fig.1 Comparison of detection result of TNF-α in peripheral blood of pregnant women between the two groups

注:*P<0.05。
图2孕妇外周血8-iso-PGF2α检测对比结果
Fig.2 Comparison of detection result of 8-iso-PGF2α in peripheral blood of pregnant women between the two groups
2.3脐血生化指标比较
GDM组脐血TNF-α、8-iso-PGF2α水平均高于对照组,经比较均有显著性差异(均P<0.05),见表2。
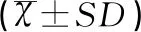
表2 对照组与GDM组脐血TNF-α和8-iso-PGF2α水平的比较结果Table 2 Comparison of serum levels of TNF-α and 8-iso-PGF2α in umbilical cord blood of the newborns between the control group and GDM
3讨论
3.1脂代谢在GDM病理机制中扮演重要角色
GDM是常见的妊娠期并发症,一直以来受到国内外医学研究者的广泛关注。GDM在不同程度上影响孕产妇及围产儿的健康,其影响程度与患者的血糖控制情况有着密切的关系。GDM会加大妇女自然流产、早产发生率,并发高血压的概率是健康孕妇的3~5倍。GDM妇女在分娩后10年内有20%~70%的概率会发展成2型糖尿病患者[3]。糖尿病的病理机制复杂,β细胞功能紊乱、神经内分泌功能异常、脂代谢异常等均参与GDM的病理发展[10-11]。目前对于GDM的治疗手段有限,仅饮食干预和胰岛素被广泛接受。然而,由于胰岛素抵抗的存在,治疗效果往往不理想。所以,深入分析GDM发病原因、机理及其治疗对策对降低妊娠并发症、新生儿患病率等方面具有重要意义。
脂肪组织作为一种重要的内分泌器官,既保证了能量的安全分配,又积极分泌循环因子,包括脂肪因子(如瘦素、脂联素等)和细胞因子[如TNF-α、白介素(IL)-6和IL-1β)],具有广泛的代谢作用,并在GDM病理机制中扮演了重要的角色[4]。本研究通过检测GDM孕妇血清及脐血中的TNF-α和8-iso-PGF2α进一步证实脂代谢与GDM患者发病机制密切相关。
3.2 GDM患者TNF-α显著升高与脂代谢密切相关,且参与GDM发病机制
TNF-α是一种重要的脂肪源性促炎介质,是参与炎症、肥胖和胰岛素抵抗相关的主要炎性脂肪因子。TNF-α与糖代谢及脂代谢密切相关,并且在胰岛素信号转导、葡萄糖转运和外周组织胰岛素抵抗等方面发挥重要作用。有研究报道TNF-α与孕前BMI呈正相关[12]。TNF-α通过降低过氧化物酶体增殖物激活受体-γ(PPAR-γ)的mRNA表达来减少其产生,而PPAR-γ具有抗炎和促凋亡的作用,同时可减少体内游离脂肪酸的生成,进而减少体内胰岛素抵抗,调节血糖平衡。TNF-α不但减少了PPAR-γ的产生,还减少脂肪细胞分化和脂联素表达,通过多种途径引起糖代谢失衡[13]。T细胞免疫球蛋白粘蛋白分子-3(Tim-3)可以通过活化核转录因子κB(NF-kB)/TNF-α通路加重糖尿病肾病,TNF-α还可诱导肝细胞凋亡[14-16]。肺损伤最早出现的异常之一是炎症细胞因子水平的升高,其中,TNF-α起着关键作用,对上皮细胞和内皮细胞产生细胞毒性,从而加重水肿[17]。本研究显示,GDM孕妇外周血和脐血中的TNF-α均高于对照组,并且随着妊娠进程持续升高,提示GDM孕妇及胎儿均存在脂质过氧化。TNF-α在GDM的发病机制及子代的肺发育不良中可能起到重要作用。
3.3 GDM患者8-iso-PGF2α显著升高,且为评价氧化应激的理想指标
8-iso-PGF2α是评价氧化应激的理想指标,8-iso-PGF2α与氧化应激造成的损伤关系极为密切,可以很好地反映机体内的氧化应激水平。相关研究报道,机体氧化应激失衡在高血压、糖尿病等血管病变中发挥着重要作用,8-iso-PGF2α水平成为国内外研究人体脂质过氧化的重点内容,也是异前列腺素中含量最多、最稳定的一种形式,可以正确反映人体的氧化应激及自由基诱导之后过氧化情况[6]。8-isoPGF2α是一种具有生物学活性的前列腺素样物质,这是细胞生物膜经过氧自由基过氧化作用之后的特异性产物,该指标能准确反映缺氧缺血再灌注患者的脂质过氧化作用[7]。8-iso-PGF2α的生成不依赖环氧化酶(COX),是氧自由基损害脂质细胞膜多不饱和脂肪酸(花生四烯酸)后的产物,其在体内的表达水平不会因使用阿司匹林等非甾体消炎药影响COX而发生改变。因此,8-iso-PGF2α是临床判断人体自由基氧化程度及其抗氧化疗效最佳的生化指标。有研究表明孕妇的外周血8-iso-PGF2α水平上升与病症的严重 程度呈正相关[8]。检查8-iso-PGF2α水平无需过于贵重的仪器,检测费用不高,检测结果具有敏感性、准确性、特异性均较高的特点[18-19]。8-iso-PGF2α水平升高会增加自闭症的风险[19-20]。有文献报道8-iso-PGF2α与呼吸系统疾病也密切相关[21]。本研究显示,对照组孕妇血清8-iso-PGF2α水平在妊娠期间保持稳定。GDM患者8-iso-PGF2α显著升高,并且随着妊娠进程持续升高。孕中期确诊GDM的孕妇在妊娠早期体内可能已存在脂质过氧化损伤,提示氧化应激与GDM的发病相关,可能是GDM的发病机制之一。
妊娠早期测定TNF-α和8-iso-PGF2α水平可能预测GDM的发生,可早期采取干预措施预防GDM的发生。本研究结果显示GDM组患者不仅血清TNF-α和8-iso-PGF2α水平较对照组升高,脐血中的表达水平也较对照组升高。有研究报道脐血中的8-iso-PGF2α水平与孕妇血清水平呈正相关[22]。因此,通过检测孕妇血清中TNF-α和8-iso-PGF2α水平,有可能帮助早期预测新生儿体内脂质过氧化损伤。通过早期检测孕妇外周血TNF-α和8-iso-PGF2α水平,预测GDM的发生,根据检测结果选择性开展抗氧化治疗,可能有利于减少GDM的发生,或减轻GDM对母亲、胎儿及新生儿的不良影响。
综上所述,GDM孕妇血清TNF-α、8-iso-PGF2α显著高于正常妊娠孕妇,且TNF-α、8-iso-PGF2α随着GDM患者妊娠进程持续升高,因此TNF-α、8-iso-PGF2α可以作为GDM检测诊断的重要指标。

