RNA甲基化酶WTAP对乳腺癌MCF-7和耐阿霉素MCF-7/ADR细胞迁移的影响
龙胜文,尹梓豪,许斐钰,丁小凤
(湖南师范大学生命科学学院, 淡水鱼类发育生物学国家重点实验室, 长沙 410081)
乳腺癌是世界上最常见的癌症之一[1]。据估计,2014年美国有40 430名女性患者死于乳腺癌[2]。尽管在乳腺癌治疗方面取得了一定的突破,但目前估计,转移性乳腺癌在5年内的生存率低于25%,10年内的生存率为5%~10%[3]。手术和化疗是治疗乳腺癌的主要两种方式,而肿瘤细胞的耐药是导致化疗失败的主要原因。因此,进一步探索乳腺癌治疗耐药的新机制对于了解乳腺癌的发展和设计治疗靶标至关重要。
在转录过程中存在不同的修饰而6-甲基腺苷(N6-methyladenosine,m6A)是真核生物中mRNAs[4],microRNAs[5],longnon-coding RNAs[6]最丰富的内部化学修饰。RNA的m6A修饰主要发生在3′UTR[7,8]和5′UTR[9],与RNA的转录、加工、翻译以及代谢过程有关。m6A的修饰是一个动态的调控过程,主要涉及三类调控蛋白,包括甲基转移酶(METLL3,METTL14,WTAP,KIAA1429)[10-15],去甲基化酶(FTO,ALKBH5)[16-18]和读取蛋白(YTHDF1/2/3,YTHDC1/2,IGF2BP11/2/3,eIF3)[9,19-25]。最近研究表明m6A相关蛋白参与了不同类型癌症的发生、发展,如胶质母细胞瘤、急性髓性白血病、肝细胞癌、直肠癌、肾细胞癌和乳腺癌[26-31]以及癌症治疗耐药发展的过程,如胰腺癌、白血病、宫颈鳞状细胞癌和胶质母细胞瘤[29,32-34]。然而,作为m6A甲基转移酶组合的关键组分,Wilms肿瘤1相关蛋白(Wilms’ tumor 1-associating protein,WTAP)在乳腺癌治疗耐药中的功能作用暂无报道,本次研究在MCF-7细胞中过表达WTAP,耐药细胞系MCF-7/ADR细胞中敲低WTAP的表达,观察其对细胞迁移的影响并初步探讨其机制。
1 材料与方法
1.1 材料
乳腺癌细胞系MCF-7购自中科院上海细胞库。MCF-7/ADR细胞系购自上海酶研生物科技有限公司。质粒构建的pCMV-Myc载体购自Clone-tech公司。siRNA购自苏州吉玛基因公司。RNA Trizol提取试剂和SYBR Green实时定量PCR试剂盒购自Takara公司。用于内参检测的GAPDH抗体购自Sigma公司。Myc-Tag抗体购自武汉三鹰公司。Vimentin、E-cadherin、N-cadherin和Snail抗体购自ABclonal公司。WTAP抗体购自Abcam公司。辣根过氧化物酶偶联的羊抗兔、羊抗鼠二抗购自KPL公司。
1.2 方法
1.2.1 细胞培养
细胞置于含10%胎牛血清和1%青霉素/链霉素的DMEM培养液中,37 ℃、5% CO2、饱和湿度恒温箱培养至对数生长期用于试验。MCF-7/ADR细胞培养于500 ng/mL Adriamycin(ADR)中,在正式试验前撤药培养2周。
1.2.2 MTT法检测阿霉素对MCF-7和MCF-7/ADR细胞活力的影响
取对数生长期细胞,按每孔6×103个细胞接种至96孔板,每孔加100 μL的细胞悬液。培养24 h后,每孔补加不同浓度的阿霉素使其终浓度分别为0、10、20、40、80、160、320、640 μmol/L。同时设空白对照(不加细胞,只加培养基),每组设5个平行孔。药物处理24 h后,弃去培养基,每孔加入5 mg/mL的MTT液100 μL。继续培养4 h后,弃去MTT液,每孔加入120 μL的DMSO并避光轻摇15 min。酶标仪测定490 nm波长处吸光度值。
1.2.3 荧光定量PCR
首先用Trizol法提取RNA,然后按照逆转录试剂盒操作说明将获得的RNA反转录成cDNA。按照SYBR GreenqPCR试剂盒步骤检测ythdf2、mettl3、mettl14、wtap和fto的表达,所用的引物见表1。

表1 引物名称及其序列Tab.1 The name and sequences of primers
1.2.4pCMV-Myc-wtap重组载体的构建
以从MCF-7细胞中抽提的RNA反转录成的cDNA作为模板,以wtapF:5′-GAATCATGACCAACGAA GAACCTCTTC-3′和wtapR:5′-GGTACCTGTACAGGGT TCAGTTTTGTAA-3′(在5′端引入了EcoRI的酶切位点,在3′端引入了KpnI的酶切位点,下划线序列为酶切位点)为引物,应用KOD FX DNA聚合酶(Toyobo)进行PCR扩增,扩增条件:94 ℃变性5 min,然后98 ℃15 s,64 ℃20 s,68 ℃60 s,共30个循环,最后72 ℃延伸5 min。获得wtap完整的编码序列。连入真核生物表达载体pCMV-Myc中,EcoRI和KpnI双酶切验证后,测序确认序列的正确性。
1.2.5 细胞转染
转染前一天取对数生长期细胞接种于6孔板中,在过表达WTAP的孔板中每孔接种4×105个细胞,用于干扰WTAP表达的孔板中每孔接种2×105个细胞。培养至24 h,按LipofectamineTM2000脂质体转染说明书操作,将脂质体与pCMV-Myc、pCMV-Myc-wtap质粒或NC siRNA、wtapsiRNA分别经无血清DMEM培养基均匀混合后,分别加至细胞中,置于37 ℃、5% CO2的细胞培养箱中继续培养24 h和48 h。
1.2.6 细胞迁移试验
按1.2.4细胞转染步骤将干扰和过表达WTAP的细胞分别培养24、48 h。消化细胞,用PBS和无血清培养基先后洗涤一次,用无血清培养基悬浮细胞,计数,调整细胞浓度为2×105个/mL。在下室加入700 μL含20%血清的培养基,上室加入150 μL的细胞悬液,置于37 ℃、5% CO2的细胞培养箱中继续培养。将MCF-7细胞培养36 h,MCF-7/ADR细胞培养24 h,取出小室,吸干上室液体,用甲醇室温固定30 min。移除固定液,用结晶紫室温染色30 min,用清水浸泡数次,取出小室,吸去上室液体,用湿棉棒小心擦去上室底部膜表面上的细胞。拍照,统计。
1.2.7 Western blot检测WTAP、Snail、Vimentin、E-cadherin、N-cadherin蛋白表达
按1.2.4细胞转染步骤将干扰和过表达WTAP的细胞分别培养24 h、48 h。用胰酶消化收集细胞,加RIPA细胞裂解液,于冰上放置30 min,抽提细胞全蛋白,进行SDS-PAGE电泳,电泳结束,将蛋白转移至PVDF膜,5%脱脂牛奶室温封闭1 h,分别加入抗WTAP抗体、Snail抗体、Vimentin抗体、E-cadherin抗体和N-cadherin抗体。4 ℃孵育过夜。次日,加HRP标记的羊抗兔或羊抗鼠二抗,室温孵育1 h,加ECL化学发光底物,在全自动凝胶成像系统中曝光显影。
1.3 试验数据统计分析
2 结果与分析
2.1 WTAP在MCF-7/ADR细胞中高表达
我们首先用MTT法检测阿霉素对MCF-7和MCF-7/ADR细胞活力的抑制。试验发现阿霉素对MCF-7和MCF-7/ADR的细胞活力都有不同程度的抑制作用,且对MCF-7细胞活力的抑制作用大于对MCF-7/ADR细胞的抑制作用,如图1a所示(P<0.01)。然后用荧光定量试验检测MCF-7和MCF-7/ADR细胞中与m6A相关基因的mRNA表达水平,与MCF-7细胞相比,RNA甲基化酶wtap和去甲基化酶fto的mRNA在MCF-7/ADR细胞中高表达,而RNA甲基化酶mettl3、mettl14和阅读基因ythdf2低表达,如图1b所示(P<0.05)。我们选取RNA甲基化酶wtap进行后续的研究,用western-blot试验进一步检测到MCF-7/ADR细胞中WTAP蛋白高表达,与mRNA表达水平一致,如图1c所示。这说明WTAP在MCF-7/ADR耐药细胞中高表达,提示wtap可能与乳腺癌细胞的耐药有关。
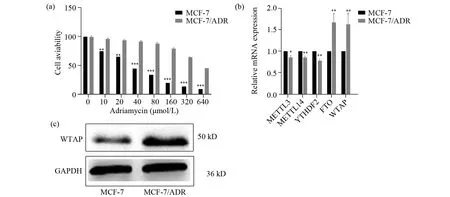
图1 MCF-7和MCF-7/ADR细胞中m6A相关基因的mRNA和WTAP蛋白表达分析Fig.1 Expression analysis of mRNA level of m6A related genes and WTAP protein in MCF-7 and MCF-7/ADR cells(a)MTT法检测阿霉素对MCF-7和MCF-7/ADR细胞活力的影响;(b)qPCR试验检测m6A相关基因在MCF-7和MCF-7/ADR细胞中的表达;(c)Western-blot试验检测WTAP在MCF-7和MCF-7/ADR细胞中的表达,星号表示组间差异有统计学意义(*P<0.05,** P<0.01,*** P<0.001)(a)MTT assay detected the effect of adriamycin on the activity of MCF-7 and MCF-7/ADR cells;(b)qPCR assay detected the mRNA expression of m6A related genes in MCF-7 and MCF-7/ADR cells;(c)Western-blot assay detected the expression of WTAP in MCF-7 and MCF-7/ADR cells, the asterisks indicate a statistically significant difference(*P<0.05,** P<0.01,*** P<0.001)
2.2 过表达WTAP对MCF-7细胞的迁移没有影响
为了进一步验证wtap在乳腺癌细胞MCF-7和MCF-7/ADR中的作用,我们构建了wtap过表达质粒。首先用PCR扩增wtap基因的全长编码序列,获得1 191 bp的片段,如图2a所示,将其插入pCMV-Myc真核表达载体中,转化宿主菌DH5α,提取质粒。将提取的质粒经EcoRI和KpnI双酶切验证,得到相应的wtap片段,如图2b所示。将质粒测序,测序结果显示pCMV-Myc-wtap构建成功。扩增正确的pCMV-Myc-wtap质粒,进行大量制备,以转染MCF-7细胞,用western blot鉴定pCMV-Myc-wtap重组质粒,如图2c所示,结果说明pCMV-Myc-wtap重组质粒已成功表达WTAP蛋白。我们在MCF-7细胞中过表达WTAP,用细胞迁移试验检测WTAP对MCF-7细胞迁移的影响。在过表达WTAP后,MCF-7细胞的迁移相比对照组没有发生显著性的变化,结果如图2d所示,2e为2d图的细胞迁移情况做量化统计。这些结果表明WTAP对MCF-7乳腺癌细胞的迁移没有影响。
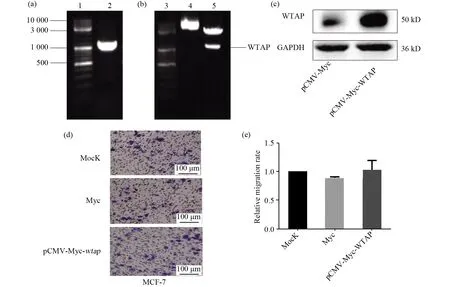
图2 pCMV-Myc-wtap重组质粒的酶切鉴定及对MCF-7细胞迁移的影响Fig.2 Identification of recombinant plasmid pCMV-Myc-wtap by the digestion and the effect of WTAP on the migration of MCF-7 cells(a)wtap的PCR片段;(b)pCMV-Myc-wtap重组质粒EcoRI和KpnI的双酶切;(c)Western-Blot检测外源WTAP的表达;(d,e)迁移试验检测过表达WTAP对MCF-7细胞迁移的影响(a)PCR fragments of wtap;(b)Recombinant plasmid pCMV-Myc-wtap by EcoRI and KpnI digestion;(c)Western-Blot detected the expression of exogenous WTAP;(d,e)Transwell assay detected the effect of WTAP overexpression on cell migration of MCF-7cells
2.3 敲低WTAP的表达会抑制MCF-7/ADR细胞的迁移
我们用WTAPsiRNA干扰片段转染MCF-7/ADR细胞,用western blot检测WTAP siRNA干扰片段的有效性,结果如图3a所示,表明WTAP siRNA的干扰片段是有效的。然后进一步用细胞迁移试验检测WTAP敲低对MCF-7/ADR细胞迁移的影响。相比较于对照组,敲低WTAP的表达会抑制MCF-7/ADR细胞的迁移,结果如图3b所示(P<0.001)。图3c对图3b细胞的迁移情况做量化统计。该结果表明敲低WTAP的表达会抑制MCF-7/ADR细胞的迁移。
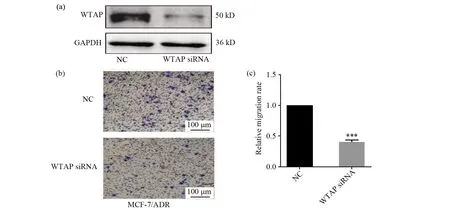
图3 敲低WTAP对MCF-7/ADR细胞迁移的影响Fig.3 Effect of WTAP knockdown on migration of MCF-7/ADR cells(a)Western-blot检测MCF-7/ADR细胞中WTAP siRNA转染效果;(b,c)迁移试验检测敲低WTAP对MCF-7/ADR细胞迁移的影响,星号表示组间差异有统计学意义(*P<0.05,** P<0.01,*** P<0.001)(a)MCF-7/ADR cells transfected with WTAP siRNA was detected by western-blot;(b,c)Transwell assay detected the effect of WTAP knockdown on the cell migration of MCF-7/ADR cells, the asterisks indicate a statistically significant difference(*P<0.05,** P<0.01,*** P<0.001)
2.4 敲低WTAP的表达会抑制上皮间质转化
我们用pCMV-Myc-wtap转染MCF-7细胞,WTAP siRNA干扰片段转染MCF-7/ADR细胞,分别培养至24 h和48 h,收集蛋白,western-blot检测WTAP、Snail、Vimentin和E-cadherin、N-cadherin蛋白水平的变化,GAPDH做内参。当在MCF-7细胞中增加WTAP的表达时,和对照组相比上皮分子标志物E-cadherin,间质细胞分子标记物N-cadherin、Vimentin和Snail的表达没有差异性的变化,结果如图4a所示。而在MCF-7/ADR细胞中敲低WTAP的表达时,和对照组相比上皮分子标志物E-cadherin的表达上调,间质细胞分子标记物N-cadherin、Vimentin和Snail的表达则下调,结果如图4b所示。这些结果表明敲低WTAP的表达能够抑制上皮间质转化。
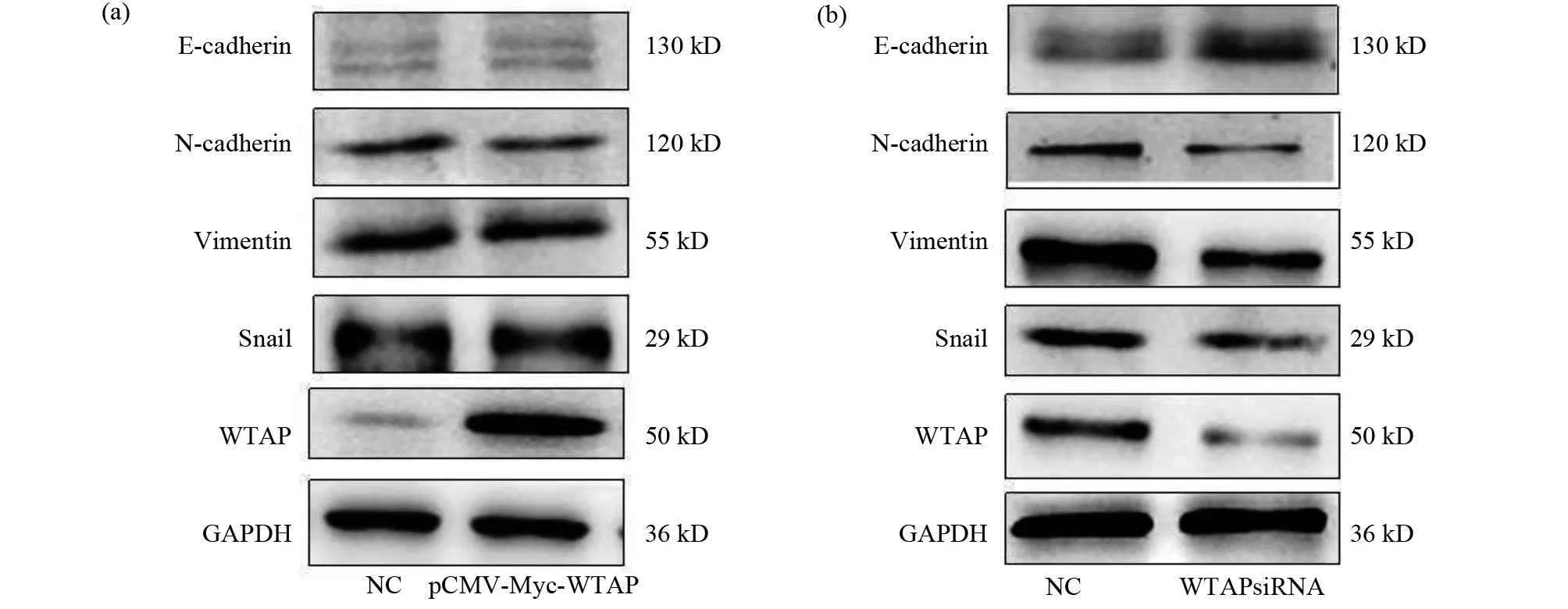
图4 Western-blot检测敲低和过表达WTAP对E-cadherin、Snail、Vimentin和N-cadherin的影响Fig.4 Effects of WTAP knockdown and overexpression on E-cadherin,Snail,Vimentin and N-cadherin detected by western-blot(a)Western blot检测pCMV-Myc-wtap转染MCF-7细胞对E-cadherin,Snail,Vimentin和N-cadherin蛋白表达的影响;(b)Western- blot检测WTAP siRNA转染MCF-7/ADR细胞对E-cadherin、Snail、Vimentin和N-cadherin蛋白表达的影响(a)Westernblot detected the effect of WTAP overexpression on E-cadherin、Snail、Vimentin and N-cadherin of MCF-7 cells;(b)Western- blot detect the effects of WTAP knockdown on E-cadherin、Snail、Vimentin and N-cadherin of MCF-7/ADR cells
3 讨论
WTAP由Little NA等首次发现,因与Wilms肿瘤抑制基因wt1特异性相互作用从而得名[35]。研究证明,wtap除了参与mRNA稳定[36]、眼睛发育[37]、m6A甲基化[38]、细胞增殖、凋亡及细胞周期调控[39]等一些基本的生理过程。在肿瘤的发生发展中也起到了重要的作用,如WTAP在胶质瘤细胞以及胶质瘤组织样本中高表达,通过EGF-EGFR-AKT信号轴参与胶质瘤细胞的增殖、迁移及侵袭[40-42]。在急性髓性白血病细胞异常增殖中wtap也起重要作用[26]。Zhang等[43]发现,在直肠癌细胞中CA4通过与WTAP发生相互作用,使WTAP多聚泛素化使其表降解进而减少WTAP/WT1复合物,增加游离的WT1,促进WT1与TBTL1发生相互作用进而降解β-catenin从而降低Wnt信号通路抑制结肠直肠癌细胞的EMT和G1/S期。对于胆管癌,过表达或者干扰WTAP会增加或减少胆管癌细胞的迁移与侵袭[44]。一系列研究证明了wtap参与了肿瘤的增殖、迁移与侵袭,但对于雌激素和孕激素受体阳性乳腺癌的发生、发展及治疗耐药有何意义,目前尚暂无报道。
为了探索wtap在雌激素和孕激素受体阳性乳腺癌耐药中的作用,本研究选取雌激素和孕激素受体阳性乳腺癌MCF-7和耐阿霉素药物的乳腺癌MCF-7/ADR细胞系进行研究。WTAP在MCF-7/ADR细胞中高表达,表明WTAP可能参与乳腺癌MCF-7细胞的耐药过程。Jeon[45]和W[46]等发现耐药的肿瘤细胞通常会伴随着许多其他细胞生物活性方面的变化,包括肿瘤细胞迁移与侵袭性的增加。为了更深入研究WTAP参与乳腺癌MCF-7细胞的耐药的作用,我们在MCF-7/ADR细胞中转入WTAP siRNA,通过迁移试验发现敲低WTAP表达后MCF-7/ADR细胞的迁移能力也随之降低,而在MCF-7细胞中过表达WTAP则对MCF-7细胞迁移没有影响。总之,本试验表明敲低WTAP的表达可以抑制MCF-7/ADR细胞的迁移能力。
有研究证明,化疗药物常导致上皮间质转化过程的增加[47,48]。上皮间质转化是指上皮细胞失去极性而重组细胞骨架,转变具有迁移能力的间质表型的过程,上皮间质转化(epithelial-mesenchymal transition,EMT)是一个多步骤的过程,伴随细胞形态学的变化和多种上皮和间充质基因的转录和水平改变有关。冀峰等[49]发现耐阿霉素药物的乳腺癌MCF-7的EMT能力比MCF-7肿瘤细胞要更强。本研究显示,wtap基因表达受到抑制后,MCF-7/ADR细胞中的EMT过程受到抑制,表现为上皮分子标志物E-cadherin表达上调,间质细胞分子标记物N-cadherin、Vimentin和Snail表达下调。这表明抑制wtap基因的表达,减弱了MCF-7/ADR细胞的迁移能力,其中的机制可能和EMT过程受到抑制有关。EMT在多种肿瘤侵袭和转移过程中扮演着重要的角色[50-52]。尽管EMT所涉及的分子机制取得了实质性的进展,但是EMT作为治疗耐药的潜在生物标志物和潜在药物靶点的临床意义值得进一步研究。WTAP作为一个癌基因,参与了不同肿瘤的增殖、迁移与侵袭[42-44]。本研究也表明WTAP通过影响EMT的发生参与乳腺癌MCF-7/ADR细胞的耐药,因此WTAP可以作为临床治疗耐药的潜在生物标志物和潜在的药物靶点之一。

