三种淡水鱼类在中国南北两个地区的肠道菌群差异比较
徐佳莹,李 演,谢芝玲,陈汉娜,潘 登,刘 峰,陈 燕,梁淑淑,丁学知,夏立秋,张友明,,涂 强*
(1.淡水鱼类发育生物学国家重点实验室, 湖南师范大学生命科学学院, 微生物分子生物学湖南省重点实验室, 长沙 410081; 2.亥姆霍兹抗感染国际实验室, 山东大学亥姆霍兹生物技术研究所, 微生物技术国家重点实验室,青岛 266237; 3.青岛科技大学, 化学与分子工程学院, 青岛 266042;4.禹城保立康生物饲料有限公司, 德州 251200)
动物肠道中都包含着一个复杂的微生物生态系统,肠道中的微生物与宿主的各项生命活动息息相关,它们可能影响着宿主的生长代谢活动,营养消化功能,免疫功能以及抵御入侵病原体的能力等[1-3]。例如,微生物产生的活性产物短链脂肪酸可以抑制某些哺乳动物肠道中有害细菌的增殖来维持微生物群动力学,而且能够增强肠道及远处组织的免疫能力[4]。肠道环境与宿主的生长代谢密切相关,体内益生菌对维持肠道环境的稳定起着非常重要的作用,其产生的抗菌肽可直接抑制病原体生长,或为宿主提供像维生素一类的有益生长底物[5]。当宿主生长状态或外界环境发生变化时,往往会引起动物的肠道微生物也发生改变,有研究表明,斑马鱼肠内的细菌群落随着宿主由幼体到成熟不断生长而变得越来越多样化[6]。在进行草鱼的肠道微生物研究中,喂养黑麦草能够显著增强肠道微生物群的碳水化合物、氨基酸和脂质的代谢作用[7]。
鱼的生长水环境中高丰度的铜绿假单胞菌会引起鱼的肠道杯状细胞增殖和肠脱落,促进炎症因子的转录,从而改变肠道菌群结构[11]。硫化物对水体的污染会引起凡纳滨对虾肠道组织损坏,炎症和免疫相关因子发生一系列的变化,使得肠道中潜在病原菌数量增加,有益菌数量减少[12]。目前,肠道微生物在生物研究领域起着越来越重要的作用,16s rDNA扩增子测序技术作为研究微生物群落的重要手段,能够鉴定出肠道中几乎所有物种,并能基于测序数据进行后续的生物分析,从而快速地推动动物肠道微生物的研究和发展。
湖南省属于我国华中地区,界于北纬24°38′~30°08′,东经108°47′~114°15′之间,多山地和湖泊,四季分明,淡水鱼种类繁多;山东省属于我国华东沿海地区,北纬34°22.9′~38°24.01′,东经114°47.5′~122°42.3′之间,气候较湖南相比更加干燥,盛产海水鱼类,两地相距1 100 km。对于两地的草鱼,鲫鱼和鲤鱼三个品种的肠道微生物的比较分析迄今尚无报道。
本试验选取湖南本土草鱼、鲤鱼和鲫鱼各6尾,山东本土草鱼、鲤鱼和鲫鱼各6尾,基于Ion S5TMXL测序平台,对以上36个样本的肠道微生物16s rRNA V4高变区进行扩增,分析肠道菌群结构,比较有益菌和有害菌的丰度差异,为淡水鱼的健康养殖提供理论基础。
1 材料与方法
1.1 样本采集及处理
本试验共采集36个生长状况良好、鱼龄为1龄的鱼样,其中禹城鱼塘和望城鱼塘的草鱼[平均体重(600±50)g]各6尾,组别为山东草鱼组(SC组)和湖南草鱼组(HC组);禹城鱼塘和望城鱼塘的鲫鱼[平均体重(170±30)g]各6尾,组别为山东鲫鱼组(SJ组)和湖南鲫鱼组(HJ组);禹城鱼塘和望城鱼塘的鲤鱼[平均体重(550±50)g]各6尾,组别为山东鲤鱼组(SL组)和湖南鲤鱼组(HL组)。超净工作台内进行解剖,取其肠道内容物置于无菌的EP管内,迅速冷冻,放-80 ℃冷冻保存,以备后续试验使用。
1.2 DNA提取和PCR扩增
使用Mobio公司PowerFecalTMDNA Isolation kit试剂盒提取36个样本中的微生物基因组,扩增16s rRNA 的V4高变区,引物名称为515F(GTGCCAGCMGCCGCGGTAA)和806R(GGACTACHVGGGTWTCT AAT)。基于Ion S5TMXL技术测序平台,利用单端测序(Single-End)的方法,完成测序,测序数据用于后续统计分析。
1.3 数据分析
为了使测序数据更加准确和可靠,需将原始数据(raw data)经过质控和过滤处理,得到的即是有效数据(clean data)。基于有效数据以97%的一致性进行操作分类单位(operational taxonomic units,OTUs)聚类,并将OTUs的代表序列进行物种注释,可获得物种分布及丰度情况。基于OTUs进行统计分析,绘制物种稀疏曲线,体现各样本的测序深度是否已达饱和。α多样性分析是对单个样本内部或组内进行分析,所得的数值可以体现样本的物种丰富度和均匀度。LEfSe分析(LED effect size)可进行两个或多个样本的比较,找到样本与样本之间的差异物种,识别不同的丰度特征线性判别分析(linear discriminant analysis,LDA)值可代表差异物种对菌群结构的影响大小。对样本中四种有益菌[链霉菌属(Streptomyces),芽孢杆菌属(Bacillus),乳杆菌属(Lactobacillus)和双歧杆菌属(Bifidobacterium)]和五种有害菌[气单胞菌属(Aeromonas),弧菌属(Vibrio),希瓦氏菌属(Shewanella),爱德华氏菌属(Edwardsiella)和黄杆菌属(Flavobacterium)]进行统计分析,探索肠道微生物群的稳定性和抗变化性,利于对鱼类病害的研究与防治。对测序数据进行以上多种分析,将两地区的样本做对应的比较,可用于研究环境对淡水鱼肠道微生物的影响。
2 结果与分析
2.1 样本质量评估及物种多样性分析
经过质控后,36个样本共得到2 455 165个高质量的16s rRNA V4扩增子序列,以97%的一致性进行OTUs聚类,共得到4 934个OTUs,6个组所共有的OTUs有543个。根据稀疏曲线可见曲线逐渐趋于平缓,表明所得数据已经覆盖样本中绝大部分物种,测序数据趋于合理且可信度高(图1a)。所有样本的Good’s coverage指数均在99.0%以上,每个样本都具有良好的抽样完整性。shannon指数可以很好地反映样本中物种丰富度和均匀度的大小,HJ和SJ,HC和SC,HL和SL进行Tukey检验结果显示,相比较的组间丰富度和均匀度无显著差异性(P>0.05)。在相似性分析(analysis ofsimilarities,ANOSIM)中,基于Bray-Curtis距离值的秩次进行组间差异显著性检验,山东草鱼组和湖南草鱼组比较中组间差异明显大于组内差异(R=0.307,P<0.05),阐明不同的环境造成同一淡水鱼品种的肠道微生物差异(图1b)。鲫鱼组和鲤鱼组的ANOSIM分析结果中差异显著性比较P>0.05,统计不具有显著性。
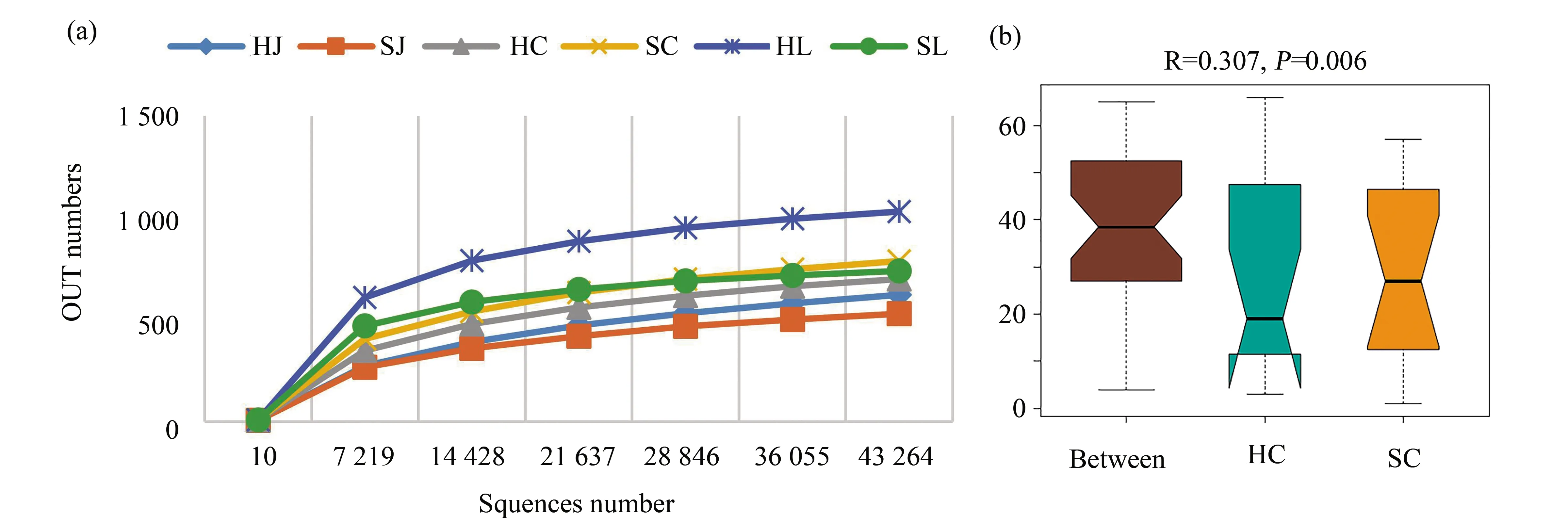
图1 样本稀疏曲线和ANOSIM组间差异分析Fig.1 The rarefaction curves and analysis of ANOSIM differences (a)36个鱼样的样本稀疏曲线;(b)HC组和SC组的ANOSIM组间差异分析(a)The rarefaction curves of 36 fish samples;(b)Analysis of ANOSIM differences between HC group and SC group
2.2 肠道微生物组成结构
在门水平上,物种相对丰度柱形图中可发现,HJ组和SJ组的最优势菌门为梭杆菌门(Fusobacteria),且在两个组中所占比例分别为(55.40±27.31)%和(38.44±19.72)%。在HJ组中,较优势菌门为变形菌门(Proteobacteria)〔(19.24±17.05)%〕>硬壁菌门(Firmicutes)〔(15.80±5.07)%〕>拟杆菌门(Bacteroidetes)(7.58±5.01)%;而在SJ组中,较优势菌门为硬壁菌门〔(31.50±26.24)%〕>变形菌门〔(13.78±10.29)%〕>拟杆菌门〔(8.14±0.94)%〕。HC组和SC组的最优势菌门为拟杆菌门,在各组中占比分别为(35.88±15.55)%和(35.76±16.47)%。在HC组中,较优势菌门为硬壁菌门〔(28.89±19.80)%〕>变形菌门〔(26.75±17.65)%〕>梭杆菌门〔(5.37±3.45)%〕;而在SC中梭杆菌门〔(22.28±18.05)%〕>硬壁菌门〔(13.28±5.10)%〕>螺旋体(Spirochaetes)(12.02±0.41)%。HL组和SL组的最优势菌门为变形菌门,在各组中所占比分别为(34.31±18.24)%和(33.70±28.58)%,HL组中,较优势菌门为硬壁菌门〔(22.96±22.83)%〕>梭杆菌门〔(16.40±14.37)%〕>拟杆菌门(11.60±2.91)%,而在SL组中梭杆菌门〔(30.77±7.53)%〕>拟杆菌门〔(14.89±8.65)%〕>硬壁菌门(9.55±4.30)%(图2a)。如图2a中所见,同一品种的鱼样中,环境不同,但肠道微生物中最优势菌门为同一菌门,随后较优势菌门相对丰度大小顺序有所变化。6个组中,变形菌门、梭杆菌门、硬壁菌门和拟杆菌门在各组中的所占比之和均在80%以上(图2a)。在属水平上,来自两不同地区的鲫鱼和鲤鱼的肠道最优势菌属都是鲸杆菌属(Cetobacterium),草鱼的最优势菌都是拟杆菌属(Bacteroides)(图2b)。因此,相对于同一品种来讲,地区差异并未造成最优势菌属的改变。

图2 各组中肠道微生物门水平上和属水平上的物种相对丰度Fig.2 Relative abundance of gut microbiome taxa on phylum category and genus category in each groups(a)HJ、SJ、HC、SC、HL和SL组的肠道微生物门水平上的物种相对丰度;(b)HJ、SJ、HC、SC、HL和SL组肠道微生物属水平上的物种相对丰度(a)Relative abundance of gut microbiome taxa on phylum category in HJ, SJ, HC, SC, HL and SL groups;(b)Relative abundance of gut microbiome taxa on genus category in HJ, SJ, HC, SC, HL and SL groups
2.3 LEfSe分析
HJ组和SJ组的LEfSe分析结果显示,气单胞菌属(Aeromonas),气单胞菌科(Aeromonadaceae),气单胞菌目(Aeromonadales)在HJ组中显著富集(LDA>2.0,P<0.05)(图3a)。且维氏气单胞菌(Aeromonasveronii)和某些未鉴定的梭菌目(Clostridiales)在HJ组中的相对丰度远高于SJ组,而在SJ组中未见显著差异的差异物种(LDA>2.0,P<0.05)(图3a)。在HC组和SC组的LefSe分析图中,弧菌科(Vibrionaceae),弧菌目(Vibrionales)和弧菌属(Vibrio)在SC组中显著密集,在SC组中硬杆菌(Firmicutesbacterium)和霍乱弧菌(Vibriocholerae)的相对丰度也高于HC组,梭菌纲(Clostridia)和梭菌目(Clostridiales)在HC组中显著密集(LDA>2.0,P<0.05)(图3b)。在HL组和SL组的LEfSe分析图中,弧菌科,弧菌目和弧菌属在SL组中显著密集,而HL组中未见显著差异的差异物种(LDA>2.0,P<0.05)(图3c)。
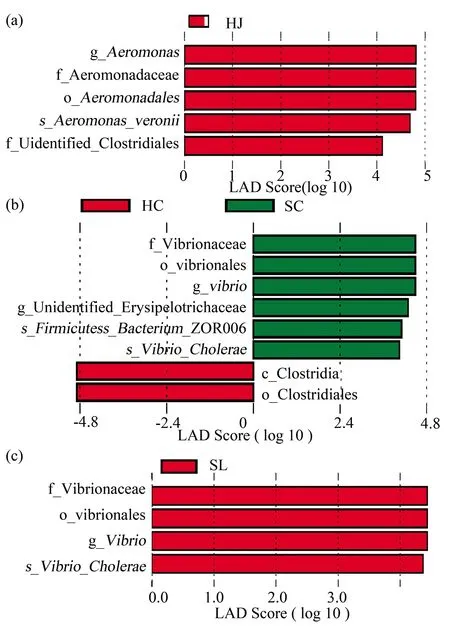
图3 LDA值分布柱状图Fig.3 Histogram of LDA value distribution(a)HJ和SJ组的LDA值分布柱状图;(b)HC和SC组的LDA值分布柱状图;(c)HL和SL组的LDA值分布柱状图(a)LDA value distribution histogram of HJ and SJ groups;(b)LDA value distribution histogram of HC and SC groups;(c)LDA value distribution histogram of HL and SL groups
2.4 4种有益菌和5种有害菌的分析比较
将4种有益菌和5种有害菌的相对丰度绘制成柱状统计图,4种有益菌的相对丰度柱状图中可见,3个品种的鱼肠道中,4种有益菌的相对丰度所占比之和在两地比较下差异不大(图4a);在5种有害菌的相对丰度柱状图中,相对丰度所占比之和在两地比较下差异很大,其中HC组的气单胞菌属丰度远高于SJ组,HL组的气单胞菌属相对丰度远高于SJ组,而SC和SL的弧菌属丰度远高于对应的HC组和HL组(图4b)。值得注意的是,爱德华氏菌属不存在SJ组,SL组和SC组中,而在HJ组,HL组和HC组中都有较低丰度(图4b)。这可能是因为在山东地区少有爱德华氏菌属的存在,不易在淡水鱼类中定植,或者山东地区的淡水鱼中存在某些抑制该菌属生长的条件。
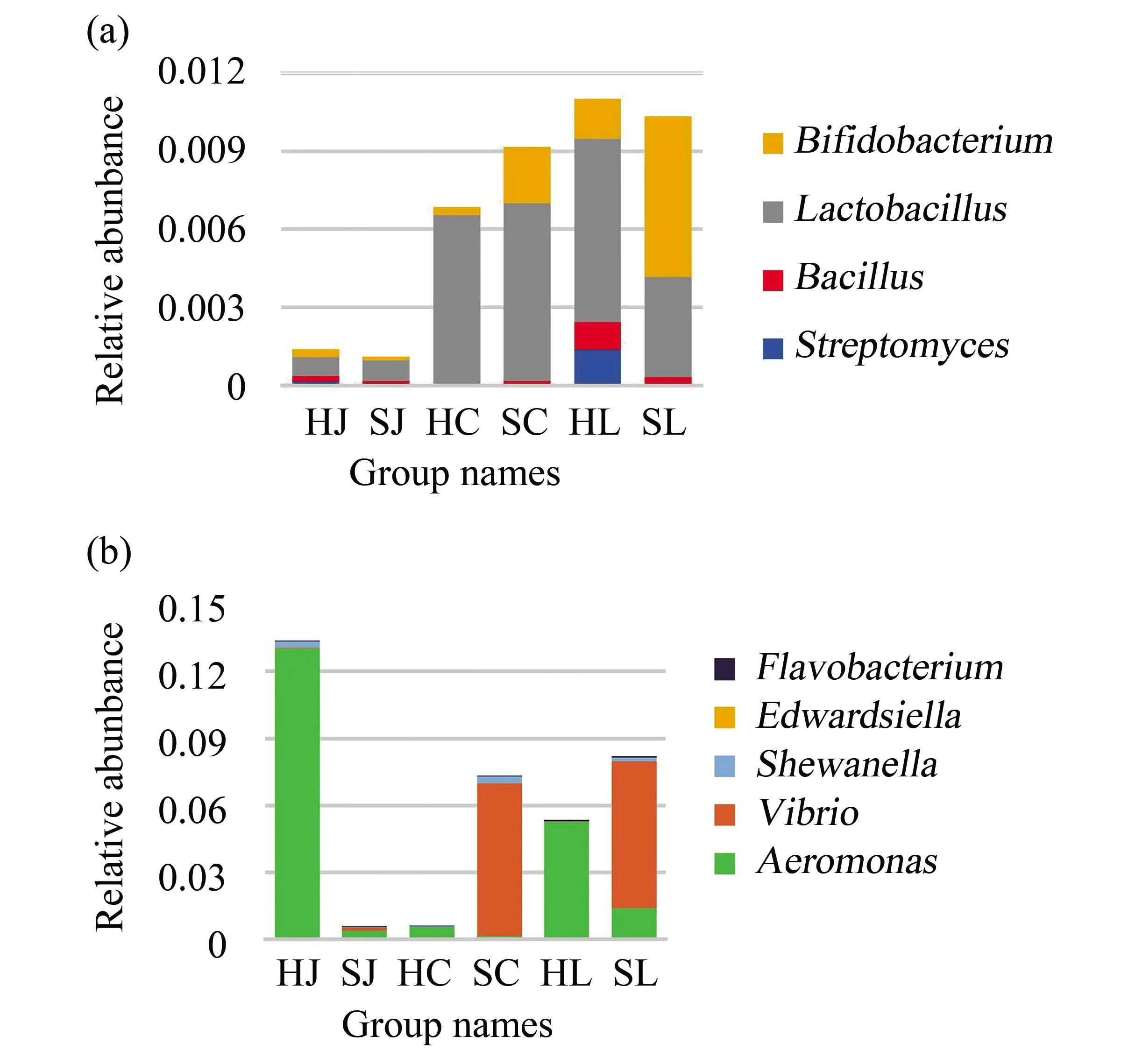
图4 各组中4种有益菌的相对丰度和5种有害菌的相对丰度Fig.4 Relative abundance of four beneficial bacteria and five harmful bacteria in each groups(a)HJ、SJ、HC、SC、HL和SL组中4种有益菌的相对丰度;(b)HJ、SJ、HC、SC、HL和SL组中5种有害菌的相对丰度(a)Relative abundance of four beneficial bacteria in HJ, SJ, HC, SC, HL and SL groups;(b)Relative abundance of five harmful bacteria in HJ, SJ, HC, SC, HL and SL groups
3 讨论
本研究36个样本包含3个淡水鱼类品种,分别是草鱼,鲫鱼和鲤鱼。在肠道微生物丰度分析中,除了SC组的变形菌门相对丰度不在前四,其他各组的鱼肠道微生物均以变形菌门,梭杆菌门,硬壁菌门和拟杆菌门为主,同一菌门包含许多菌种,菌门的丰度大小受菌种丰度大小的直接影响,不同的环境可影响菌种丰度,菌门丰度也随之发生改变。SC组中物种相对丰度排第四的是螺旋体,在HC组中也存在一定丰度的螺旋体,且少数螺旋体具有降解纤维素的能力[15,16],如嗜热螺旋体。草鱼是一种典型的草食性鱼类,肠道较长,需要更多的纤维素降解细菌来有效的摄取营养,因此推测本研究中的两个草鱼组均富含有较多螺旋体的原因与其肠道消化有关。许多优势菌群对宿主的生长代谢至关重要,如硬壁菌门的芽孢杆菌属可提高消化酶活性,变形菌门中的假单胞菌可抑制弧菌生长,它们共同作用维持肠道环境稳定。在LEfSe分析中,HJ组中气单胞菌属的相对丰度远高于SJ组,SC组和SL组的差异物种都是弧菌科,可见,相比于山东水环境,气单胞菌属更易定植在湖南水环境的鲫鱼肠道中,而弧菌更易在山东水环境的草鱼和鲤鱼肠道中定植。
有报告指出,食草性鱼类肠道微生物群的数量随季节变化而变化,在更密集的喂养季节(如夏季)微生物数量更高,这是因为夏季营养物质更多,环境温度更高,有利于微生物的增殖[17]。然而本研究与以上研究的结论不同,两地气温差异并未造成肠道菌群丰富度的明显改变,可能是因为采样的时间为八月份,虽然北方整体气温要比南方低,但是两地气温都在适宜微生物生长的区间内,所以肠道中物种丰富度和均匀度无显著差异。进行β多样性比较时,SC组和HC组的组间差异大于组内差异,这可能是受到外界环境因素综合的影响。很多环境因子都能够对肠道微生物产生不同的影响[13,18],湖泊中常常不可避免的存在农药和重金属污染问题,比如杀虫剂五氯酚和抑霉唑均会显著地引起鱼体肠道菌群成分变化[19],铅和镉会造成肠道菌群结构的变化[20,21],水体中氨气浓度影响鱼类肠道微生物群落结构,过量硝酸盐或氨氮还会损害宿主免疫功能[8]。本试验两湖泊所处地区不同,也必定存在不同的水质和环境问题,组间差异大于组内差异的试验结果能够反映环境差异对鱼类肠道菌群的影响,但还无法将具体的环境因子与造成的差异结果一一对应。
本研究中选取的是生长状况良好的淡水鱼,在各组肠道环境中都存在一定丰度的病原菌,但并未表现出病理特征。鱼类体内存在免疫系统,当遭受少量病原菌侵害时,鱼体免疫机制会起到保护作用,调节肠道环境,抵制病原体入侵。当致病菌达到一定条件会爆发鱼类疾病,给养殖业带来损失。使用抗生素是鱼类养殖部门控制疾病暴发的常见做法,然而抗生素的使用并非长久之计,耐药菌的出现迫使研究者寻找新的抗生素替代品。有研究表明中草药提取物可以对鱼类的生长繁殖有益,如紫苏籽提取物可以显著提高水产动物的生长和饲料利用率[22]。但是中草药的使用也存在一些效果不明显且成本较高的难题,因此鱼类益生菌的筛选是也逐渐成为了学者研究的热点。潜在益生菌一般都具有非致病性,可调节肠道酸碱平衡,抑制病原菌生长,并通过不同途径调节免疫[23],饲喂乳杆菌能够显著提高牙鲆的免疫细胞吞噬活性和溶菌酶活性[23,24],日粮中补充链霉菌增强了草鱼免疫基因的表达,双歧杆菌可提高肠上皮组织完整性[25],枯草芽孢杆菌作为饲料补充剂可以增强石斑鱼的固有免疫,降低虹膜病毒感染的死亡率[23,26]。有学者的研究报告中显示鲫鱼的芽孢杆菌属相对丰度在(0.308 2±0.526 4)%,气单胞菌属和希瓦氏菌属的相对丰度分别为(0.039 1±0.038 8)%和(0.121 1±0.104 9)%[27],本试验中芽孢杆菌属的丰度在该区间内,各组的希瓦氏菌属均高于该区间。虽然受到不同丰度的有害菌影响,定植在肠道中的链霉菌、乳杆菌、芽孢杆菌和双歧杆菌可能通过增强鱼的固有免疫抵抗有害菌的入侵,保证鱼体的正常生命活动。
本研究可以为淡水养殖业提供重要的理论参考,通过进行不同地方同一品种淡水鱼的肠道微生物分析可以看出,α多样性比较无显著差异,宿主自身因素对肠道菌群起主要调节作用。HC和SC组的组间差异大于组内差异,可能是受环境差异影响。潜在有益菌和潜在致病菌在肠道内存在某种平衡,虽然相对丰度不一样,但并未致病。因此,为了保持肠道微生物间的平衡,后续还需要进行更多的研究,从中寻找和制造更多的有益因素,减少有害因素的出现频率,创造更大的收益。

