林下参叶片愈伤组织的诱导
李雨桐,刘子嘉,闫丁榕,雷秀娟
(1.吉林市第一中学,吉林1320011;2.吉林农业大学人参新品种选育与开发国家地方人参联合工程中心,长春130118)
林下参是指在天然林下模拟野山参的生长条件培育而成的人参[1]。在这种新型栽培模式下生长的人参,既能保证其有效的药用价值,又能在很大程度上缓解野山参资源枯竭带来的产业难题[2]。然而由于目前人们对林下参生长关键因子的认识尚不够全面,在栽培中仍存在许多问题需要解决[3]。
植物组织培养即通过体外无菌操作,将植物的器官、组织、细胞等直接接种在适宜的培养基上,发育成完整植株的方法[4]。该技术不仅可以在短时间内生产大量种苗,也能有效应用于种质资源的长期保存,同时也为野生濒危植物资源的保护做出了巨大贡献。因此,建立林下参组培快繁体系势必能为有效解决在栽培中存在的问题提供帮助。本研究以林下参叶片为外植体,探讨消毒方式、外源激素浓度和不同年生对其愈伤组织诱导的影响,旨在为林下参组培快繁技术体系的建立奠定方法基础,为林下参产业的可持续发展提供优质原材料。
1 仪器与材料
1.1 仪器
超净工作台(ZHJH-C1115),上海智城分析仪器制造有限公司;高压灭菌器(GF54-DA),致微(厦门)仪器有限公司;电子天平(ME104T),梅特勒托利多仪器有限公司;PH 计(Seven Compact-S210),梅特勒托利多仪器有限公司。
1.2 材料
林下参(3、5、10、15 年生),经吉林农业大学王英平研究员鉴定为抚松长白县林下参;MS基本培养基(国药集团,分析纯);蔗糖(国药集团,分析纯);琼脂(北京奥博星生物技术有限公司,生化纯);2,4-D(Sigma,生化纯);BA(Sigma,生化纯);水解乳蛋白(Sigma,生化纯);升汞(国药集团,分析纯);次氯酸钠(北京化工厂,分析纯)。
2 实验方法
2.1 不同消毒方式的选择
以展叶期的10年生林下参掌状复叶的第一片小叶为外植体,选用4种不同的消毒方式进行消毒处理,切成0.5 cm×0.5 cm小块,接种在2.4-D 1.5 mg/L+BA 0.5 mg/L+水解乳蛋白1g/L的培养基中,每皿接种5块,共接种20皿,30天后调查污染情况和愈伤组织诱导率。
2.2 不同激素配比的选择
以展叶期的10年生林下参掌状复叶的第一片小叶为外植体,经75%酒精1min,2%NaClO 20 min消毒处理后,切成0.5 cm×0.5 cm小块,接种在四种不同激素配比的培养基中,每皿接种5块,共接种20皿,30天后调查愈伤组织诱导率和生长情况。
2.3 不同年生林下参愈伤组织形成的比较
以不同年生展叶期的林下参掌状复叶的第一片小叶为外植体,经75%酒精1min,2%NaClO 20 min消毒处理后,切成0.5 cm×0.5 cm小块,接种在2.4-D 1.5 mg/L+BA 0.5 mg/L+水解乳蛋白1g/L的培养基中,每皿接种5块,共接种20皿,30天后调查愈伤组织诱导率和生长情况。
2.4 培养条件
培养室温度控制在22~25℃,空气湿度保持在30%~40%,弱光培养(100 lx)。
2.5 统计分析
利用SAS软件进行Duncan显著性方差分析。相关指标计算公式如下:
污染率 (%)=污染的小叶片块数/接种小叶片总块数×100%
愈伤组织诱导率 (%)=产生愈伤组织块数/非污染的小叶片总块数×100%
3 实验结果
3.1 不同消毒方式对林下参愈伤组织诱导的影响
利用四种不同消毒方法对林下参叶片进行消毒时,外植体的污染率和愈伤组织诱导率都有显著差异。其中使用75%酒精30 s,0.1%HgCl210 min的消毒方式,外植体污染率最低,为3.6% ,同时愈伤组织的诱导率也最低,为71.9%;采用75%酒精1min,2%NaClO 10 min的消毒方式消毒时,污染率最高,为15.1%,但同时诱导率也最高,为91.6%,详见表1。

表1 不同消毒方法对林下参愈伤组织诱导的影响
3.2 不同激素配比对林下参愈伤组织诱导的影响
四种不同的激素配比,对林下参愈伤组织的诱导及生长都有较大影响,详见表2。外植体接种在2.4-D 2.0 mg/L+BA 0.5 mg/L的培养基上时,愈伤组织诱导率最高,为93.4%,并且愈伤组织生长快,颜色呈淡黄色,质地松软;接种在不同的培养基,愈伤组织生长状况差异很大;当外植体接种在2.4-D 2.0 mg/L+BA0.5 mg/L的培养基上时,其诱导率最低,为36.1%,并且褐愈伤组织化严重。
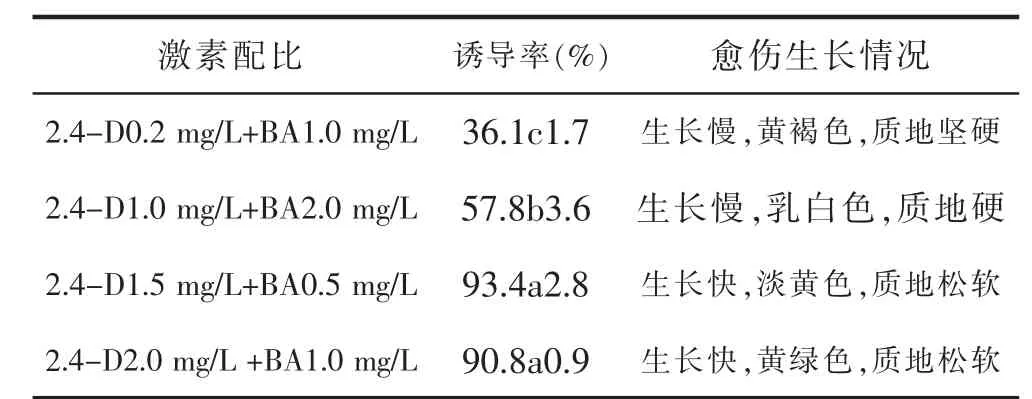
表2 不同激素配比对林下参愈伤组织诱导的影响
3.3 不同年生对林下参愈伤组织诱导的影响
以不同年生的林下参叶片为外植体诱导愈伤组织时,诱导率没有显著差异,但愈伤组织生长状况稍有差异,15年林下参愈伤组织生长比3、5、10年的生长缓慢,并且质地较硬,颜色呈乳白色或淡黄色,详见表3。
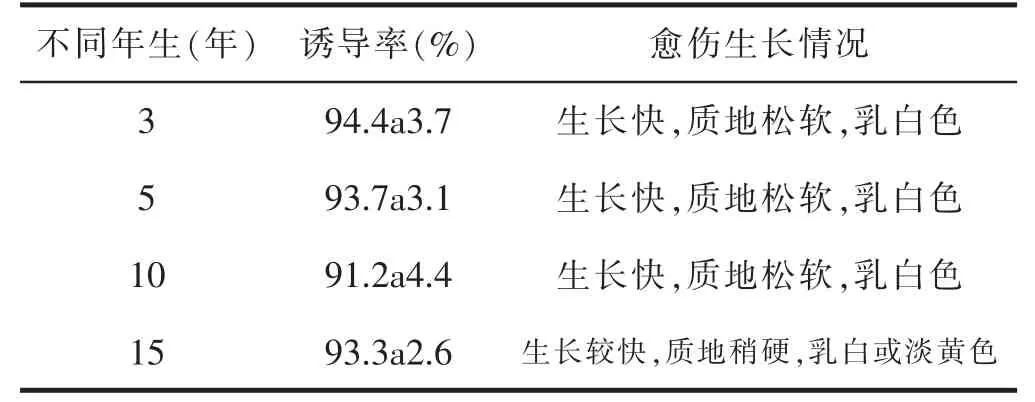
表3 不同年生对林下参愈伤组织诱导的影响
4 讨论
外植体的消毒,是植物组织培养的首要关键步骤。外植体消毒的好坏,直接影响到材料的脱分化和再分化能力。HgCl2和NaClO是常用的组培消毒剂[5],本试验以两者为消毒剂,配合不同的消毒时间,共设计四种消毒方式,对外植体进行处理。试验结果表明,HgCl2组的污染率和诱导率普遍低于NaClO组,这说明HgCl2的消毒能力强于NaClO,但是HgCl2在起到良好杀菌效果的同时,对外植体也有一定伤害,这与易双双等的研究结果一致[6]。兼顾污染率较低,诱导率较高的筛选原则,我们在后续试验中采取了75%酒精1min,2%NaClO 20 min的消毒方式对外植体进行处理。同时,我们在试验中还发现,使用同一种消毒方法,对不同年生的叶片进行消毒时,污染率有较大差异(结果未显示),这可能与不同年生林下参的带菌量不同有关。
激素是影响外植体分化的主要因素,不同的激素配比,对外植体的脱分化能力起决定性作用[7]。一般来讲,生长素/分裂素比值高,较易形成愈伤组织[8]。图1所示为利用四种培养基诱导出的质地和长势均不相同的愈伤组织,经过三次继代后的生长状况(仍能保持第1代的生长性状)。本试验结果表明,2,4-D浓度在 1.5~2.0 mg/L,BA 浓度在 0.5~1.0 mg/L 的范围时,林下参愈伤组织诱导率高,且长势良好,适合于林下参愈伤组织的诱导。在试验中,可以根据不同的试验目的,选择最佳的培养基配方。
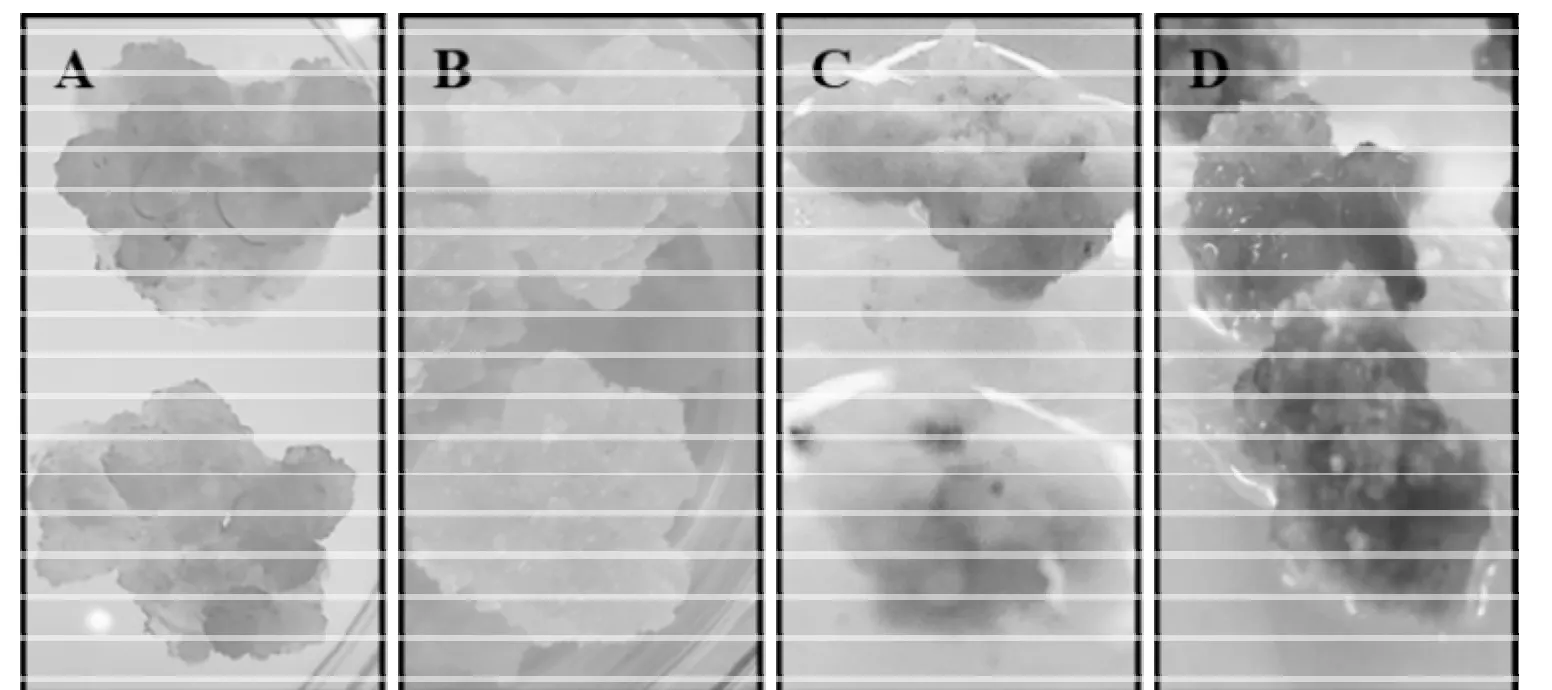
图1 不同生长情况的愈伤组织
许多研究结果表明,不同年生的外植体,其愈伤组织形成能力有很大差别[9],本试验中却发现林下参的生长年限与其叶片愈伤组织诱导率没有明显关系,3~15年的叶片均保持有比较稳定的诱导率 (91.2%~94.4%),这可能与本试验的取材时期和部位有关。试验以展叶期的幼嫩叶片为外植体,尽管其参根的生长年限不同,但叶却为当年新发嫩叶,不会对愈伤组织的诱导造成影响。

