一株引起清溪乌鳖(Pelodiscus sinensis nigrum)“摇头病”致病菌的分离鉴定与药敏分析*
李延利 张海琪 吕孙建 林 锋 刘 莉 袁雪梅 苏胜齐
一株引起清溪乌鳖()“摇头病”致病菌的分离鉴定与药敏分析*
李延利1, 2张海琪1①吕孙建1林 锋1刘 莉1袁雪梅1苏胜齐2
(1. 浙江省淡水水产研究所 湖州 313001; 2. 西南大学动物科技学院 重庆 400715)
从患“摇头病”清溪乌鳖()的肝脏、脾脏、肾脏、肺组织中分离得到1株细菌。菌落为圆形乳白色凸起, 融蜡状, 表面光滑, 边缘清晰整齐; 对该菌进行染色镜检可见其为革兰氏阳性杆菌, 呈单个或链状排列。结合生理生化检测结果、16S rDNA基因和基因和基因序列分析以及系统进化树结果, 该菌株为蜡样芽孢杆菌群(group)内新种。用不同浓度的分离菌腹腔注射感染健康的清溪乌鳖, 观察发现死亡的清溪乌鳖出现与自然发病鳖相似的症状且从病鳖内脏中可分离得到同样的菌; 经统计和计算, 其LD50为2.42×105CFU/kg体重。应用纸片扩散法对14种常用抗菌药物进行药敏试验, 结果显示, 分离菌对头孢氨苄、氟苯尼考、强力霉素、恩诺沙星、氧氟沙星五种药物敏感; 对利福平、头孢他啶则耐药。本研究为清溪乌鳖细菌性病原的报道, 旨在为该病的确诊与防治提供科学依据和参考。
清溪乌鳖(); 蜡样芽孢杆菌(); 分离鉴定; 药敏分析
清溪乌鳖()为全国水产原种和良种审定委员会审定的中华鳖国家水产新品种, 品种登记号为GS01-003-2008 (何中央, 2015; Gui, 2018)。该品种的育种基础群体为1992年在浙江德清野外采集到个别中华鳖腹部呈深浅不一的灰黑色个体, 经多年收集、培育形成一定数量的群体。1998年项目单位开始挑选360只腹部灰黑色的中华鳖构建基础群体, 应用个体选择、家系选择, 并辅以分子标记基因型选择等技术进行选育。经5代选育腹部灰黑色性状稳定遗传, 体色不再分化, 育成腹部灰黑色、营养丰富的清溪乌鳖(Gui, 2018)。清溪乌鳖的典型特征包括以下方面: 一是腹部乌黑色, 富含黑色素; 二是含血量多, 同等规格时大约是普通中华鳖血量的2倍, 因而其血液载氧能力提高了1倍多, 生产上表现出好动及好斗的特性; 三是肉质坚实, 口感佳, 味道鲜美, 必需氨基酸和不饱和脂肪酸成分含量高, 尤其是二十碳五烯酸(Eicosapentaenoic Acid, EPA)和二十二碳六烯酸(Docosahexaenoic Acid, DHA)总量比常见养殖种高20%以上(张海琪等, 2008)。自2008年国家水产新品种审定以来, 清溪乌鳖凭着其较高的营养价值, 深受消费市场认可, 已成为中华鳖养殖业品种结构优化的一种重要品种, 在全国各地推广(张海琪等, 2008)。清溪乌鳖生性凶猛好斗, 适合于低密度稀养, 目前的主要养殖方式为池塘低密度养殖、两段法养殖、虾鳖混养和鳖稻综合种养(何中央, 2015)。鉴于清溪乌鳖特殊的腹部黑色性状, 清溪乌鳖成为中华鳖遗传育种研究的良好材料, 并被用作国家水产新品种中华鳖“浙新花鳖”的选育亲本(何中央等, 2017; Zhang, 2017a, b)。
目前有关清溪乌鳖的研究主要集中在养殖性能(薛辉利等, 2009), 营养成分(张海琪等, 2008; 黄福勇等, 2011), 群体遗传多样性(张海琪等, 2011; 孟庆辉等, 2013; 徐建, 2015; Zhang, 2017a, b), 线粒体基因如线粒体细胞色素基因、12S rRNA基因、16S rRNA基因、COⅠ基因序列(张永正等, 2008; 许晓军等, 2012; 张超等, 2014; Zhang, 2015; 唐伟等, 2017), 生长与繁育特性(张海琪等, 2011, 2014; 何中央, 2015; Zhang, 2017a, b; 严维辉等, 2018), 色素、免疫及生长等相关基因研究(张永正等, 2009; Zhang, 2017a, b; 田儒品等, 2018)。由于养殖推广历史较短, 清溪乌鳖的病害研究至今未见有报道。但2018年以来, 清溪乌鳖的病害开始陆续出现, 其中以“摇头病”(head-shaking syndrome)最为典型, 其主要特征为浮于水面、反应迟钝、四肢无力、不断摇头而死亡。该病具有发病快、危害大的特点, 死亡率最高可达100%, 给养殖户带来了较大的经济损失。针对清溪乌鳖养殖过程中出现的这种病症, 本研究2018年7月从浙江省湖州市某清溪乌鳖养殖场采集到了典型性的病鳖样品, 从患病清溪乌鳖的肝脏、脾脏和肾脏等组织分离到同一种优势细菌, 通过对该菌株进行分离纯化、生理生化分析、基因扩增测序Blast比对、人工攻毒回感试验及病原菌药敏试验等一系列生物学特性研究, 旨在阐明该病原菌的致病机制, 为该病的临床诊断和治疗提供科学依据。
1 材料与方法
1.1 主要实验材料
患病清溪乌鳖()来源于浙江省湖州市某清溪乌鳖养殖场, 体质量0.5— 0.8kg。健康清溪乌鳖来源于同一养殖场, 体质量0.5—0.75kg, 在水温24—28°C、溶氧7.18mg/L 的塑料桶内暂养10d, 观察期间无发病和死亡后用于感染试验。胰蛋白胨大豆琼脂(TSA)和胰蛋白胨大豆肉汤(TSB)培养基均购自广东环凯生物科技有限公司; 恒温培养箱购自日本三洋公司; 台式恒温振荡器购自上海精宏公司; 革兰氏染色液试剂盒购自北京索莱宝科技有限公司; 细菌基因组DNA提取试剂盒、Taq DNA聚合酶均购自TIANGEN公司; 药敏纸片购自杭州微生物试剂有限公司; 实验中所用引物均由上海生工生物工程技术服务有限公司合成。
1.2 病原菌的分离与培养
用接种环无菌采集病鳖的肝、脾、肺、肾等病变脏器组织, 于TSA固体培养基上划线培养。30°C培养12h后接种的培养基上可见多个菌落。观察菌落形态, 挑取优势菌落革兰氏染色后镜检, 并对单菌落进行分离、纯化、增菌培养, 保存, 备用。
1.3 病原菌16S rRNA、gyrB和rpoB序列的PCR扩增和系统进化树构建
挑取单菌落接种到20mL液体培养基中, 30°C、200 r/min振荡培养12h后12000r/min离心5min收集菌体。参照试剂盒说明书提取其基因组DNA。扩增16S rDNA、和基因序列所用的引物(Massol-Deya, 1995; Larsen, 2014)见表1。PCR反应体系为100µL, 包含10×PCR Buffer缓冲液10µL, 2.5mmol/L dNTPs 8µL, 10µmol/L引物对各2µL, 模板DNA 2.5ng, Taq酶4U, 用ddH2O补足到100µL。
表1 扩增所用引物

Tab.1 Primers for amplification
*注: R为G or A; Y为C or T; W为A or T; D为G or A or T; H为A or C or T; B为G or Tor C; V为G or C or A; N为A or C or G or T
16S rDNA PCR反应条件为: 95°C预变性5min, 95°C变性60s, 57°C退火60s, 72°C延伸80s, 30个循环, 72°C延伸5min。基因序列反应条件: 95°C预变性5min, 95°C变性60s, 48°C退火60s, 72°C延伸90s, 33个循环, 72°C延伸10min。基因序列反应条件: 95°C预变性5min, 95°C变性45s, 46°C退火45s, 72°C延伸80s, 33个循环, 72°C延伸10min。PCR产物经1%琼脂糖凝胶电泳检测后对目标条带回收纯化, 送由上海生工生物工程技术服务有限公司进行基因序列测定。利用MEGA7软件采用邻接法(Neighbor-Joining)构建其与相近种基因的系统进化树, 进行1000次的Bootstrap检验置信度。
1.4 生理生化鉴定
对菌株进行革兰氏染色, 随即用油镜观察, 进行革兰氏鉴定。同时委托北京麦克罗科技有限公司利用Biolog全自动细菌鉴定仪对分离菌进行生理生化鉴定。
1.5 人工感染试验及半致死浓度的测定
为确定该细菌对清溪乌鳖的半数致死量, 选取40只同一养殖场的健康清溪乌鳖作为感染对象, 分为4组, 每组10只。分别对3组实验组乌鳖腹腔注射0.2mL浓度为7.86×107、7.86×105、7.86×103CFU/mL的菌悬液; 同时对照组注射相同剂量的无菌PBS。每天观察其是否发病症状, 并记录死亡情况, 连续观察15d。在清溪乌鳖出现症状时取其肝脏、脾脏、肾脏、肺等组织进行病原菌的分离培养与鉴定, 以确定是该细菌致病引起死亡。
1.6 药敏试验
采用纸片扩散法对14种常用抗菌药物进行药敏试验(中华人民共和国卫生部, 2000; 马绪荣等, 2001), 培养10—12h测量各药物的抑菌圈大小。每种药物均设定3个平行试验组, 根据其抑菌圈大小判定各药物对该细菌的作用。
2 结果
2.1 病原菌分离及形态观察
观察发现从患病清溪乌鳖肝脏、脾脏、肾脏、肺中分离到的菌为同一菌株, 命名为XS0724。该菌在TSA培养基上生长良好, 经过12h培养后, 出现菌落为圆形乳白色凸起, 融蜡状, 表面光滑, 边缘清晰整齐(见图1a)。革兰氏染色结果表明, 该细菌为革兰氏阳性菌, 有芽孢, 呈杆状, 单个或链状排列(见图1b)。
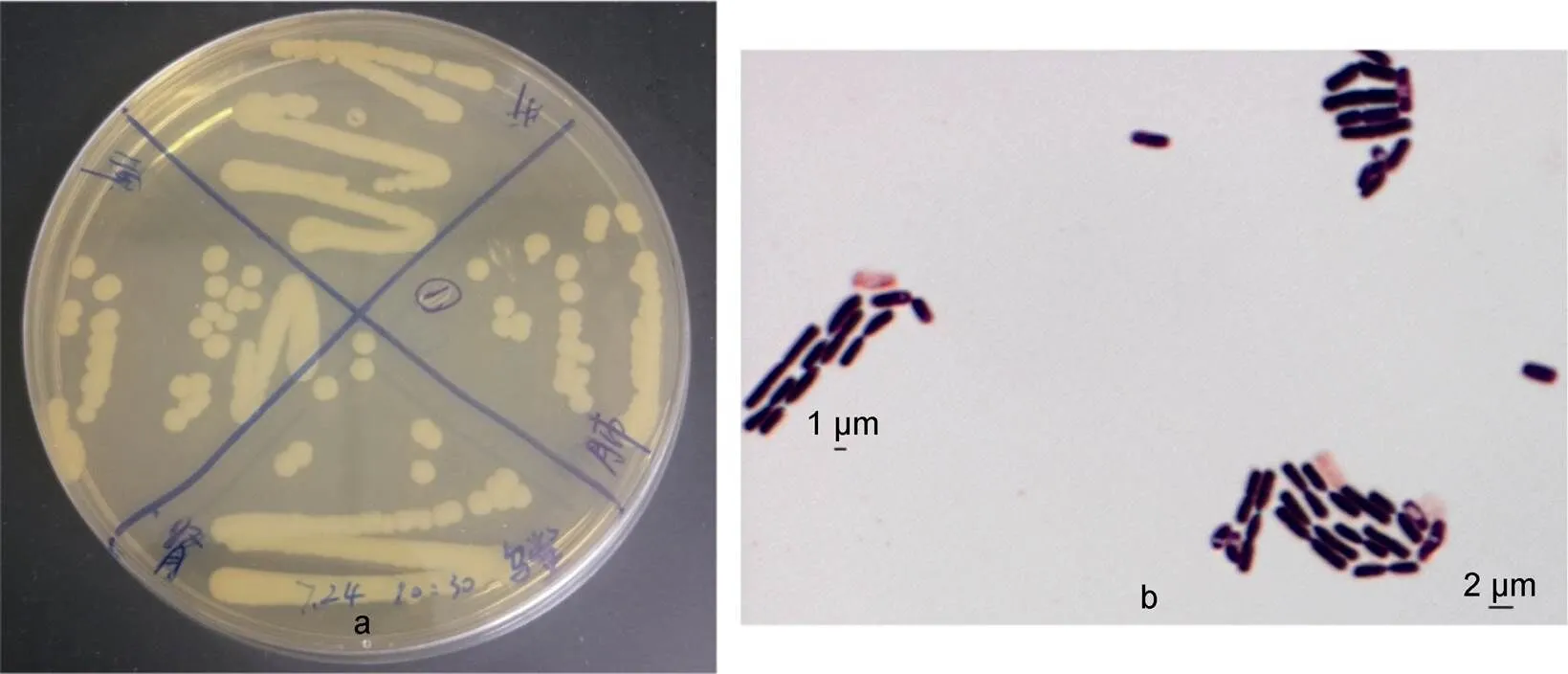
图 1 分离菌形态观察(a)及革兰氏染色镜检(b)
2.2 功能基因序列分析及系统进化树构建
2.2.1 16S rDNA基因分析 对该分离菌的16S rDNA基因进行PCR扩增, 测序获得大小为1407bp DNA序列(见图2)。用MEGA 7软件对该序列与22种相似菌的16S rDNA序列进行系统进化树构建, 结果见图3。结果显示, 该细菌与N24T聚在同一分支。
2.2.2B基因分析 对该分离菌的基因进行PCR扩增, 测序获得大小为833bp DNA序列(见图4)。用MEGA 7软件对该序列与7种相似菌的基因序列进行系统进化树构建(见图 5)。结果显示, 该细菌先与BCT-7112T和IAM 12077T聚在一起, 然后与ATCC 6462T相聚。
2.2.3B基因分析 对该分离菌的B基因进行PCR扩增, 测序获得大小为983bp DNA序列(见图6)。用MEGA 7软件对该序列与7种相似菌的B基因序列进行系统进化树构建(见图 7)。结果显示, 该细菌先与ATCC 10792T和ATCC 14579T聚在一起, 然后与str. VollumT相聚。
2.3 生理生化鉴定结果
细菌生理生化鉴定结果显示, 该细菌接触酶反应阳性, 氧化酶反应阳性。其他生化谱见表2所示。结果发现, 菌株XS0724能发酵葡萄糖、麦芽糖、海藻糖、果糖、纤维二糖, 不发酵甘露糖、龙胆二糖、蔗糖、岩藻糖、半乳糖。综合形态学观察和生理生化特性分析发现, 分离菌株与《常见细菌系统鉴定手册》蜡样芽孢杆菌描述基本一致, 结果进一步表明该细菌为芽孢杆菌类。
图2 分离菌16S rDNA基因扩增测序结果
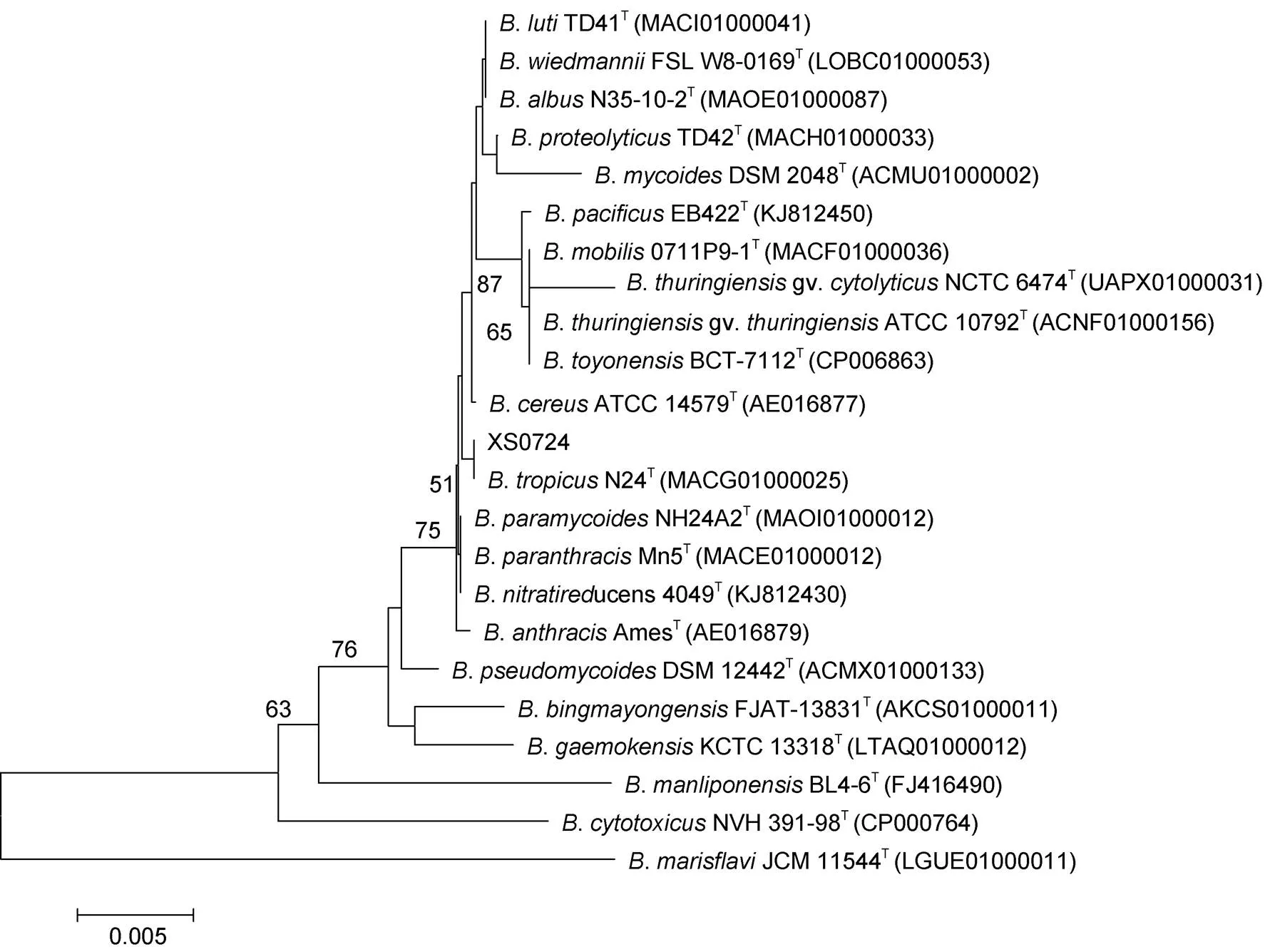
图3 基于16S rDNA基因序列的系统进化树(Neighbor-Joining法)

图4 分离菌gyrB基因扩增测序结果
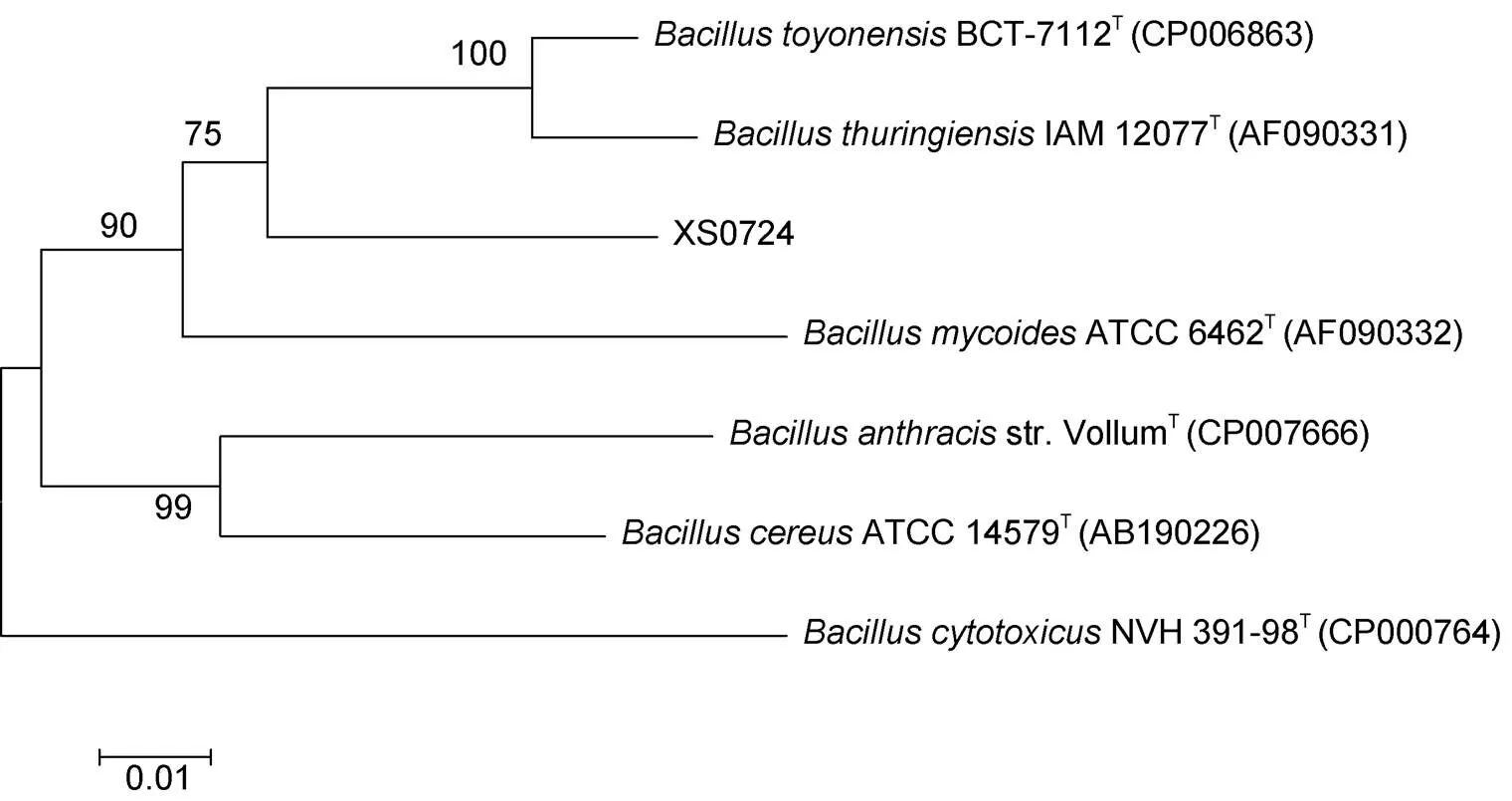
图5 基于gyrB基因序列的系统进化树(Neighbor-Joining法)
2.4 人工感染试验
实验组清溪乌鳖在腹腔注射感染后, 7.86×107CFU/mL组4d内全部死亡。15d观察结束后, 7.86×105CFU/mL组50%死亡, 7.86×103CFU/mL组20%死亡; 而PBS对照组试验期间未出现死亡。根据上述结果, 此株细菌对清溪乌鳖的LD50为2.42×105CFU/kg体重。濒死乌鳖出现浮出水面、脖颈伸长、不断摇头现象, 剖检发现其脾脏充血肿胀, 肠管壁充血, 与自然发病症状相似。同时, 从病鳖的肝脏、脾脏、肾脏、肺等组织均可再次分离到该细菌。表明该细菌为清溪乌鳖患“摇头病”的致病菌。

图6 分离菌rpoB基因扩增测序结果
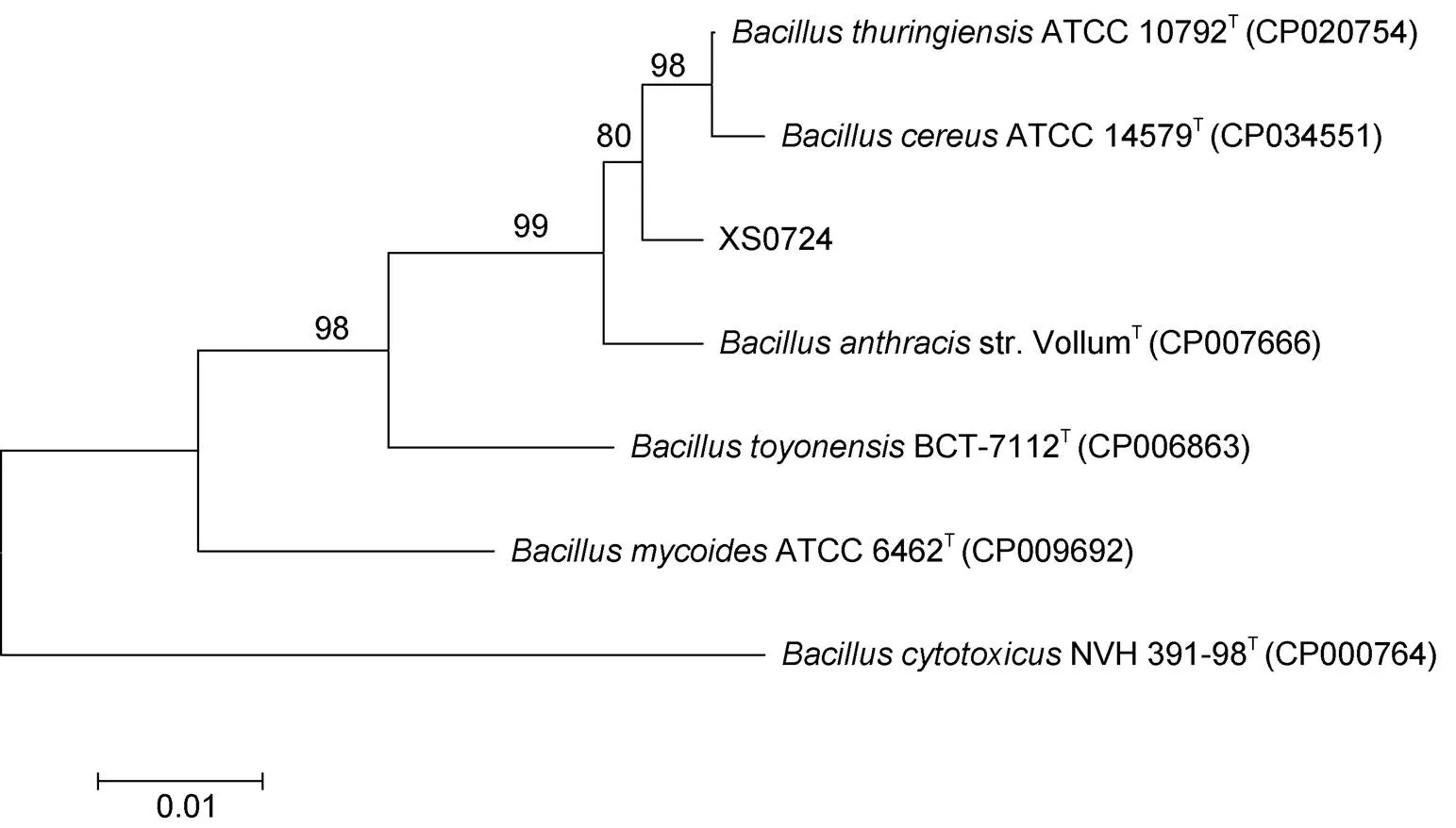
图7 基于rpoB基因序列的系统进化树(Neighbor-Joining法)
表2 细菌生理生化鉴定结果

Tab.2 Physiological and biochemical identification of bacteria
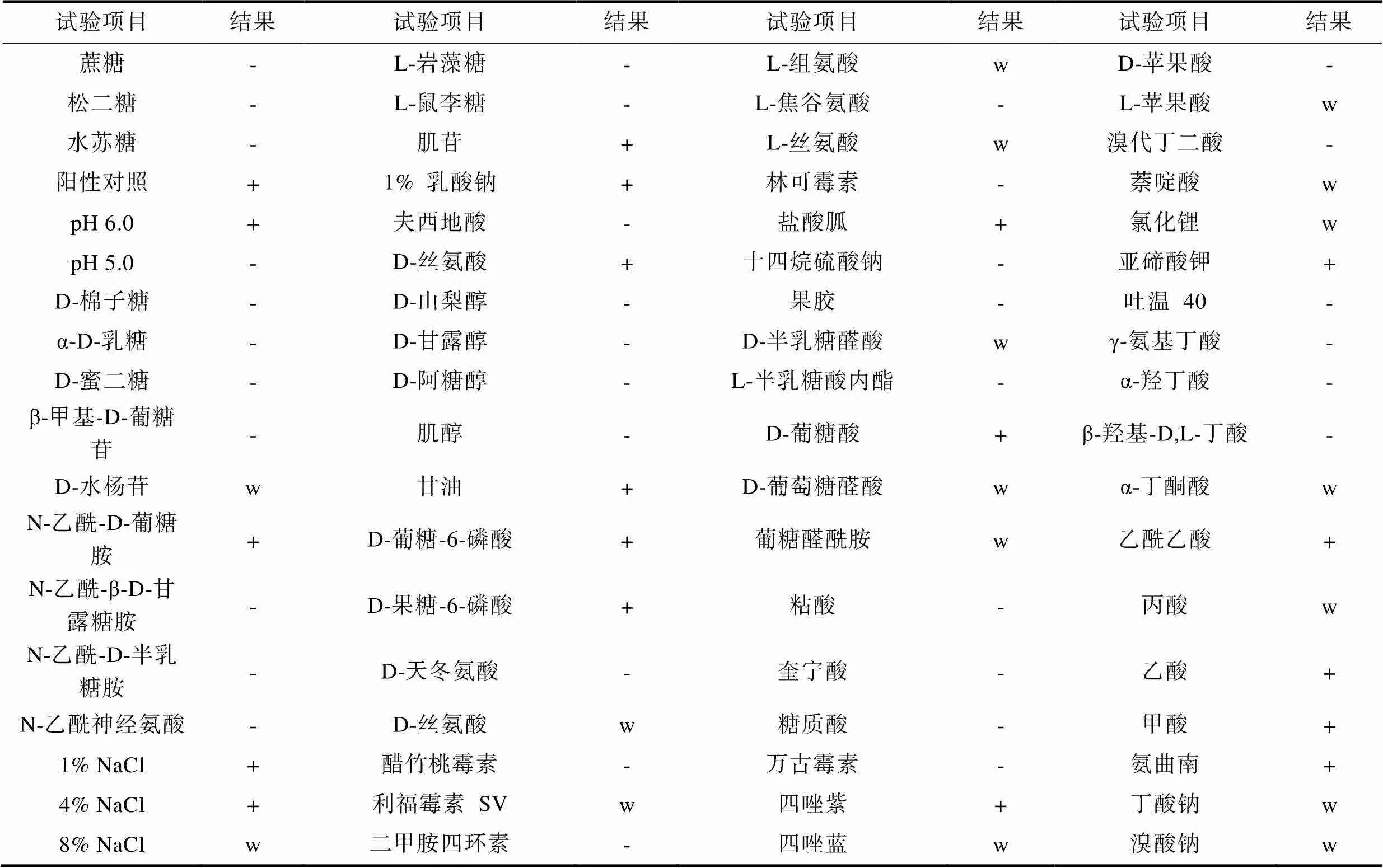
续表
注:+表示阳性, -表示阴性, w表示弱阳性
2.5 药敏试验
14种药物的药敏试验结果发现, 该菌对头孢氨苄、氟苯尼考、强力霉素、恩诺沙星、氧氟沙星高度敏感, 对于麦迪霉素、呋喃妥因、妥布霉素、卡那霉素、呋喃唑酮、庆大霉素、万古霉素中度敏感, 对于利福平、头孢他啶耐药(表3)。
表3 细菌分离株的药物敏感性

Tab.3 Antimicrobial susceptibility of the bacteria
注:S表示敏感, I表示中敏, R表示耐药
3 讨论
3.1 蜡样芽孢杆菌的致病性
蜡样芽孢杆菌是一种革兰氏阳性杆菌, 常见于土壤、灰尘、污水、饲料、植物和各类生熟食品中(Stiles, 2014)。分为无毒菌株和有毒菌株。无毒菌株作为益生菌, 在进入动物肠道后, 可影响肠道免疫细胞对细胞因子的分泌, 并且可产生抗菌肽等抗菌物质来增强机体的免疫能力, 是我国批准生产微生态制剂的菌种之一, 已在水产养殖上广泛应用(张惠云, 2000; 刘秀花, 2005; 李研东等, 2008; 张洪玉等, 2018)。有毒菌株作为条件致病菌, 含有溶血性肠毒素基因基因、非溶血性肠毒素基因基因、肠毒素基因基因和基因(刘芳等, 2016)。有毒菌株主要通过毒力基因产生腹泻毒素和呕吐毒素导致食物中毒, 也可通过菌体感染引起人的眼部疾病、心内膜炎、脑膜炎和败血症等疾病(李凤鸣, 1996; Schoeni, 2005; 高景枝等, 2008; 陆湘华等, 2015)。此外, 还会引起养殖牛、猪、罗非鱼、中华鳖、刺参等动物感染致病, 给养殖业和食品安全带来严重危害(曹伯宏等, 2004; 骆艺文等, 2009; 赵振宇等, 2014; 杨移斌等, 2017; 孟庆珍等, 2019)。本研究也从患病的清溪乌鳖内脏组织分离到优势致病菌, 与中华鳖、刺参等所报道的一致。鉴于蜡样芽孢杆菌包含有毒菌株和无毒菌株, 作为益生菌在水产养殖中使用前应首先确定菌株的安全性, 同时, 由于蜡样芽孢杆菌可引起水产养殖动物感染致病, 应引起研究者、养殖者的高度重视。
3.2 清溪乌鳖“摇头病”的发病原因及防控技术
清溪乌鳖原产于太湖流域, 典型特征是腹部乌黑, 富含黑色素, 为浙江省特有地方品种, 其营养丰富, 肌肉氨基酸总量、必需氨基酸、呈味氨基酸和蛋氨酸含量较高(张海琪等, 2008)。清溪乌鳖数量少, 苗种售价比普通鳖苗高出1倍以上, 商品鳖售价则高达200元/kg以上, 因此近年来备受广大养殖户的关注, 成为养鳖业供给侧结构性改革的重要养殖品种。清溪乌鳖养殖刚刚兴起, 还未见有其感染细菌病的报道, 但随着养殖业的发展, 其病例可能呈不断上升趋势。本研究从患病清溪乌鳖内脏组织中分离到一株优势菌, 可复制与其自然发病相似的症状, 证实其为导致清溪乌鳖“摇头病”的病原菌。经过细胞形态学观察、生理生化特征、16S rDNA序列、和功能基因序列等鉴定分析, 确定该菌株为蜡样芽胞杆菌群(group)内新种。如需进一步确定, 还需测定该菌株的全基因组序列来比较DNA-DNA同源性和ANI数值。研究者结合多年的养殖实践认为, 清溪乌鳖“摇头病”的发病原因可能存在以下两个方面: (1) 蜡样芽胞杆菌作为条件致病菌, 广泛存在于养殖环境中。清溪乌鳖因某些因素(如饲料来源和水源污染、环境温度、应激及其他病原感染等)导致鳖机体免疫力下降, 引发该菌继发性感染, 使鳖体发病。(2) 由于养鳖场没有精准用药, 可能存在滥用抗生素及给药方式不当, 导致临床治疗失败。本研究药敏试验表明, 该菌对头孢氨苄、氟苯尼考高度敏感, 在生产上采用二氧化氯消毒水体, 口服氟苯尼考和头孢氨苄, 连用5d后病害得到有效控制, 这些为清溪乌鳖“摇头病”的防治及其健康养殖奠定了基础。
4 结论
本研究鉴定并证明蜡样芽孢杆菌可导致清溪乌鳖“摇头病”的发生, 因此在水产养殖中蜡样芽孢杆菌作为益生菌使用前应首先确定菌株的安全性, 以免引起水产养殖动物感染致病; 若感染该菌, 可采用二氧化氯消毒水体, 口服氟苯尼考和头孢氨苄进行疾病的控制。本研究为清溪乌鳖“摇头病”的病因及治疗提供了理论依据。
马绪荣, 苏德模, 2001. 药品微生物学检验手册. 北京: 科学出版社, 215—216
中华人民共和国卫生部, 2000. WS/T 125-1999纸片法抗菌药物敏感试验标准. 北京: 中国标准出版社
田儒品, 张海琪, 许晓军等, 2018. 中华鳖()MITF基因的生物信息学及表达差异研究. 海洋与湖沼, 49(3): 662—670
刘 芳, 罗 臻, 黄静敏等, 2016. 致病性蜡样芽胞杆菌的研究进展. 检验检疫学刊, 26(1): 68—71
刘秀花, 2005. 芽孢杆菌的应用研究及进展. 商丘师范学院学报, 21(5): 135—137
许晓军, 张海琪, 何中央, 2012. 中华鳖日本品系和清溪乌鳖线粒体12S rRNA基因部分序列分析. 经济动物学报, 16(3): 163—167
严维辉, 高 峰, 杨振文, 2018. 乌鳖人工繁殖技术. 水产养殖, 39(2): 51—52
李凤鸣, 1996. 眼科全书. 北京: 人民卫生出版社, 470
李研东, 韩 雪, 王 颖等, 2008. 动物微生态制剂的研究进展. 饲料研究, (2): 22—24
杨移斌, 余琳雪, 刘永涛等, 2017. 罗非鱼源蜡样芽孢杆菌分离、鉴定及药敏特性研究. 淡水渔业, 47(4): 51—56
何中央, 2015. 中华鳖高效养殖模式攻略. 北京: 中国农业出版社
何中央, 张海琪, 周 凡等, 2017. 中华鳖“浙新花鳖”. 中国水产, (3): 80—83
张 超, 张海琪, 许晓军等, 2014. 中华鳖2个培育品系的16S rRNA基因多态性比较分析. 中国水产科学, 21(2): 398—404
张永正, 张海琪, 何中央等, 2008. 中华鳖()5个不同地理种群细胞色素基因序列变异及种群遗传结构分析. 海洋与湖沼, 39(3): 234—239
张永正, 张海琪, 黄利英等, 2009. 中华鳖()不同种群酪氨酸酶(TYR)基因的克隆及其多态性分析. 海洋与湖沼, 40(3): 361—366
张洪玉, 王海波, 杨移斌等, 2018. 虾源蜡样芽孢杆菌D7的生态安全性评价. 浙江农业学报, 30(9): 1585—1591
张海琪, 王根连, 何中央等, 2014. 清溪乌鳖若干生物学性状与生长研究. 浙江农业科学, (1): 111—113
张海琪, 何中央, 邵建忠, 2011. 中华鳖培育新品种群体遗传多样性的比较研究. 经济动物学报, 15(1): 39—46
张海琪, 何中央, 徐晓林等, 2008. 中华乌鳖的营养成分研究. 中国水产, (6): 76—78
张惠云, 2000. 微生态制剂在水产养殖中的应用. 饲料博览, (6): 46—47
陆湘华, 崔 昌, 王远萍等, 2015. 蜡样芽孢杆菌食物中毒的研究进展. 传染病信息, 28(4): 251—254
孟庆珍, 尹 飞, 傅超英等, 2019. 养殖中华鳖蜡样芽孢杆菌的分离、鉴定和致病性研究. 水生生物学报, 43(3): 570—578
孟庆辉, 许晓军, 张海琪, 2013. 中华鳖日本品系、清溪乌鳖及其杂交子代微卫星分析. 浙江农业科学, (9): 1194—1197
赵振宇, 戴荣四, 刘东友等, 2014. 一株猪源致病性蜡样芽孢杆菌的分离与鉴定. 湖南农业大学学报(自然科学版), 40(3): 311—315
骆艺文, 郝志凯, 王印庚等, 2009. 一株引起刺参“腐皮综合征”的蜡样芽孢杆菌. 水产科技情报, 36(2): 60—63
徐 建, 2015. 基于RNA-seq技术的中华鳖分子标记开发与应用. 宁波: 浙江万里学院硕士学位论文, 30—40
高景枝, 郑向梅, 王 滨, 2008. 一起由蜡样芽孢杆菌引起食物中毒调查分析. 中国公共卫生管理, 24(4): 387—388
唐 伟, 朱治任, 汪财生等, 2017. 基于基因的DNA条形码在鳖科动物鉴定上的应用. 江苏农业科学, 45(6): 30—36
黄福勇, 何中央, 丁雪燕等, 2011. 清溪乌鳖油脂肪酸的气相色谱-质谱联用分析. 福建分析测试, 20(05): 25—28
曹伯宏, 吴雅玲, 2004. 奶牛子宫炎的诊断治疗及预防. 青海畜牧兽医杂志, 34(1): 34—36
薛辉利, 何中央, 张海琪等, 2009. 清溪乌鳖养殖性能的初步研究. 中国水产, (6): 42—43
Larsen N, Thorsen L, Kpikpi E N, 2014. Characterization ofspp. strains for use as probiotic additives in pig feed. Applied Microbiology and Biotechnology, 98(3): 1105—1118
Massol-Deya A A, Odelson D A, Hickey R F, 1995. Bacterial community fingerprinting of amplified 16S and 16—23S ribosomal DNA gene sequences and restriction endonuclease analysis (ARDRA). In: Akkermans A D L, Van Elsas J D, De Bruijn F J eds. Dordrecht: Springer, 1—8
Schoeni J L, Lee Wong A C, 2005.food poisoning and its toxins. Journal of Food Protection, 68(3): 636—648
Stiles B G, Pradhan K, Fleming J M, 2014.andbinary enterotoxins: bad for the bowels, and eukaryotic being. Toxins, 6(9): 2626—2656
Zhang H Q, Xu X J, He Z Y, 2017a. De novo transcriptome analysis reveals insights into different mechanisms of growth and immunity in a Chinese soft-shelled turtle hybrid and the parental varieties. Gene, 605: 54—62
Zhang H Q, Xu X J, He Z Y, 2017b. Fuyong Huang. A comparative study on genetic characteristics of two new varieties ofand their hybrid. Genetics and Molecular Research, 16(3): gmr16039148
Gui J F, Tang Q S, Li Z J, 2018 Aquaculture in China: Success Stories and Modern Trends. New Jersey: Wiley Blackwell Press, 335—351
Zhang C, Xu X J, Zhang H Q, 2015. PCR-RFLP identification of four Chinese soft-shelled turtlestrains using mitochondrial genes. Mitochondrial DNA, 26(4): 538—543
ISOLATION AND IDENTIFICATION OF PATHOGEN CAUSING “HEAD-SHAKING SYNDROME” OFAND DRUG SUSCEPTIBILITY ANALYSIS
LI Yan-Li1, 2, ZHANG Hai-Qi1, LÜ Sun-Jian1, LIN Feng1, LIU Li1, YUAN Xue-Mei1, SU Sheng-Qi2
(1. Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, China; 2. College of Animal Science and Technology, Southwest University, Chongqing 400715, China)
A strain of bacteria was isolated from the liver, spleen, kidney, lung of diseasedwith “head-shaking syndrome”. The bacterial colonies were round milky white bulge, waxy, smooth, and the edge was clear and neat. The bacteria was Gram-positive in single or chain arrangement in staining microscopy. Combined with the results of physiological and biochemical test, sequence analysis of the 16S rDNA gene,gene andgene, and phylogenetic grouping, the strain was confirmed as a new species ofgroup. Different concentrations of isolated bacteria were used to intraperitoneally inject into healthy, and it was observed that the deadshowed symptoms similar to those naturally diseased ones in the farming, and the same bacteria were isolated from the viscera of the diseased. According to statistics and calculation, the LD50was 2.42×105CFU/kg. Results show that the isolates were sensitive to cefalexin, florfenicol, doxycycline, enrofloxacin, and ofloxacin, and resistant to rifampicin and ceftazidime. This study is a report on the bacterial pathogen of, and may provide a scientific basis and reference for the diagnosis and treatment of the disease.
;; separation and identification; antimicrobial susceptibility test
* 浙江省水产新品种选育重大专项项目, 2016C02055-4号; 浙江省公益类科研院所扶持专项, 2019YSZX004号。李延利, 硕士研究生, E-mail: yanlili93@163.com
张海琪, 博士, 正高级工程师, E-mail:zmk407@126.com
2019-12-27,
2020-01-26
S974.1
10.11693/hyhz20191200281

