阿什河流域底栖硅藻群落特征及水环境健康评价*
赵 杨 陆欣鑫 马 煜 李祯祥 刘 妍 范亚文
阿什河流域底栖硅藻群落特征及水环境健康评价*
赵 杨 陆欣鑫 马 煜 李祯祥 刘 妍①范亚文①
(哈尔滨师范大学生命科学与技术学院 黑龙江省水生生物多样性研究重点实验室 哈尔滨 150025)
为探索黑龙江省阿什河流域底栖硅藻群落特征及环境相关性, 并对阿什河流域进行水环境健康评价, 本研究于2018年7月(丰水期)和2018年10月(枯水期)对阿什河流域8个典型采样点进行调查。基于相似性分析检验(analysis of similarities, ANOSIM)和相似百分比分析(similarity percentages, SIMPER)分析探索枯水期与丰水期之间底栖硅藻的群落差异, 通过冗余分析 (redundancy analysis, RDA)对驱动底栖硅藻的关键环境因子进行筛选; 使用硅藻生物指数(biological diatom index, IBD)、硅藻属指数(generic index of diatom, GI)和水体营养指数(trophic state index, TSI)对研究区域水体营养状态进行初步评价。结果表明, 研究期间共鉴定底栖硅藻89种, 其中丰水期80种、枯水期57种。独立样本检验(-test)表明阿什河流域物种丰富度丰水期显著高于枯水期(<0.05), Shannon-wiener指数变化不显著(>0.05)。ANOSIM结合SIMPER分析结果显示阿什河流域硅藻群落格局存在一定的时空异质性。RDA分析表明水的电导率是驱动阿什河流域底栖硅藻空间分布的环境因子, 枯水期与丰水期之间高锰酸盐指数(CODMn)含量的变化是影响硅藻群落演替的因素之一。IBD、GI和TSI指数结果显示阿什河流域受人为活动干扰区域营养状态较差, IBD指数较GI指数能更有效的反映阿什河流域水体营养状况。
阿什河流域; 硅藻; 硅藻生物指数(biological diatom index, IBD); 硅藻属指数(generic index of diatom, GI); 冗余分析(redundancy analysis, RDA)
底栖硅藻作为水域生态系统的重要初级生产者, 由于其具有生长周期短(Van Vuuren, 2018)、分布广泛、繁殖速度快及对水环境变化反应敏感(Gautam, 2017; Bouchard, 2018)等特点, 其群落特征通常用于指示水体健康状况(Benito, 2018)。水域中特定底栖硅藻的分布格局, 是指示短期内水体富营养化、工业污染及水体连通程度的有效生物指示信号(Weilhoefer, 2008)。近年来, 我国对河流生态系统底栖硅藻的研究主要集中于硅藻多样性、硅藻指数适用性、生态完整性评价等方面(项珍龙等, 2016; 谭香等, 2018)。在我国温带地区辽河、渭河、香溪河、岗曲河及亚热带东江流域等已广泛开展底栖硅藻群落特征的生态研究(李国忱等, 2012; 陈向等, 2012)。硅藻生物指数(biological diatom index, IBD)是应用最为广泛的指数之一, 它基于硅藻物种丰富度、环境污染敏感度和耐污性来检测水体富营养状况、有机污染物浓度变化状况和水体酸化程度。硅藻属指数(generic index of diatom, GI )是偏好清洁水体的硅藻属与偏好污染水体的硅藻属的比值, 其大小被认为可以较好的反应水体状况。IBD及 GI等(Coste, 2009)已逐渐在我国水环境生态分析中发挥效能。目前涉及松花江及相关流域底栖硅藻的生态研究尚较少, 相关指数适用性及评价体系的效果尚待评估。
河流作为淡水生态系统重要的载体之一, 相对于湖泊、水库及湿地等静水生态系统而言, 其水文环境具有明显的周期性和极高的空间异质性(李晓琳等, 2016)。流域内气候、水文及土地利用率等因素, 共同决定河流的生态系统的生产力状况(周浩等, 2017), 其健康状态亦反映了人为活动干扰和生物多样性特征(廖梦娜等, 2018)。松花江流域属温带大陆性季风气候, 是我国温带河流生态系统的主要生态载体(陈威等, 2018), 其生态健康状况与区域生态平衡及生物多样性保护关系密切(周浩等, 2017)。阿什河是松花江一级支流, 位于松花江哈尔滨段东侧, 是松花江哈尔滨段重要的水源和蓄洪灌溉用水, 对松花江流域及临近水域生态系统有重要影响。阿什河流域受地表径流、工业点面源污染等人为活动干扰影响, 部分区域水质达到Ⅴ类。目前关于阿什河生态研究, 主要集中在点面源污染控制、营养盐控制及底栖动物多样性格局等方面(马广文等, 2014; 董雪等, 2016; 张莉等, 2017), 而阿什河流域内底栖硅藻多样性格局、枯水期与丰水期之间演替模式及理化驱动因子尚不清楚。鉴于此, 本研究于2018年丰水期和枯水期对该流域底栖硅藻进行研究, 阐述阿什河流域底栖硅藻群落特征; 基于多元统计分析探索驱动底栖硅藻演替格局的关键理化因子; 根据IBD、GI与水体营养指数(trophic state index, TSI)的相关性探究两种指数在阿什河流域的适用性。
1 材料和方法
1.1 采样点设置
阿什河流域干流总长度为213km, 流域总面积为3581km2, 受人为活动干扰影响, 是目前松花江流域内营养水平较高的支流之一。本研究于2018年丰水期(7月)和枯水期(10月)对阿什河流域进行水样及底栖硅藻样品采集。
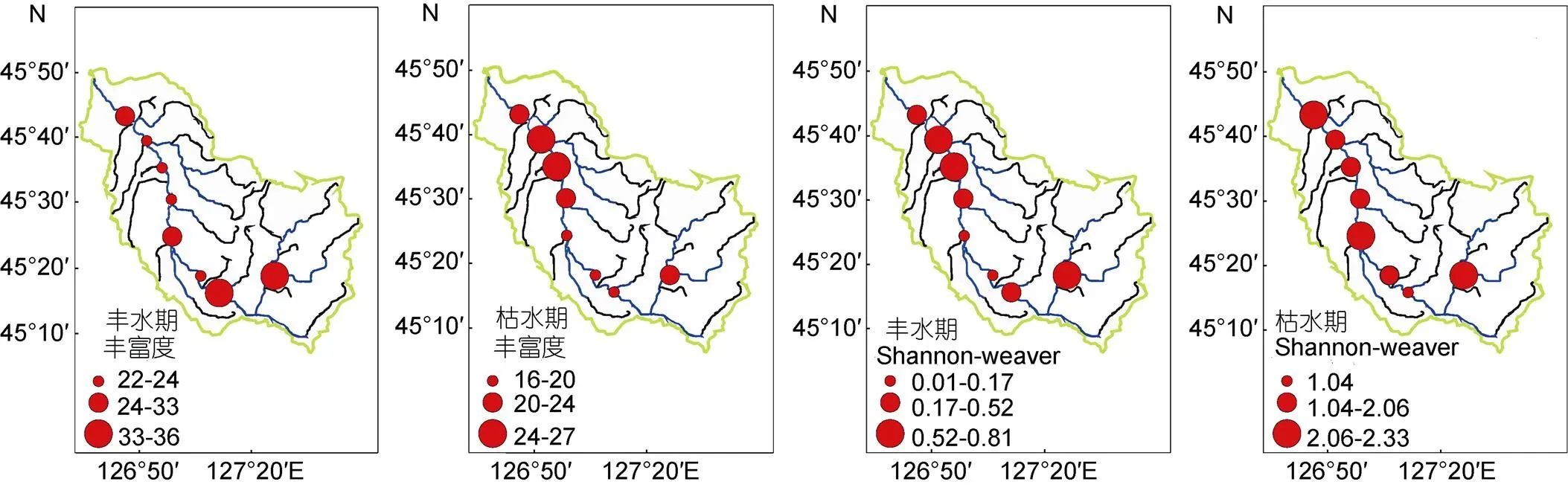
查阅本底数据, 根据阿什河流域水体生态特征(河道相通程度、湿生植物及工业排污口等), 本研究共设置8个采样点(图1), 基本涵盖了阿什河流域典型水体, 结合中国科学院资源环境科学数据中心的2018年中国土地利用遥感检测数据, 自下游至上游, 主要可分为受人为活动干扰影响的污水排污口(含国控污染点) (S1—S4)、农业区(S5、S6)及西泉眼水库保护区(靠近阿什河源头) (S7、S8)。采样点设置定位采用GPS全球卫星定位系统。样点地图的绘制通过Google earth定位及ArcMap 10.2完成。

图1 阿什河流域地采样点布设示意图
1.2 样品采集处理及鉴定
底栖硅藻样品的采集方法主要参考美国EPA标准(Barbour, 1999), 用4%的甲醛溶液固定。实验室内对硅藻样品进行前期处理, 并用Naphrax胶制作硅藻永久性封片。用10×100倍蔡司光学显微镜对硅藻随机计数, 排除破损面积大于1/4的壳体, 每个样点封片计数不少于600个硅藻壳面。底栖硅藻的鉴定及生态分布信息主要参照中国淡水藻类——系统、分类及生态、《欧洲硅藻》等文献(Krammer, 2002; 胡鸿钧等, 2006)。本研究中, 种的优势度依据McNaughton优势度指数计算, 并将≥0.02的种确定为优势种(Lampitt, 1993)。
1.3 水体理化因子测定
在采集现场, 使用Hydrolab多参数水质分析仪, 测定水体pH、水温(WT)、电导率(Conductivity)、溶解氧(DO)、浊度(Turbidity)以及叶绿素(chl); 用2L有机玻璃采水器在水面以下约0.5m处进行水样采集, 并用500mL棕色玻璃瓶将水样密封保存, 12h内根据国标《GB-38382002》对总氮(TN)、总磷(TP)及高锰酸盐指数(CODMn)和5日生化需氧量(BOD5)进行测定。
1.4 多元统计分析
使用群落相似分析(ANOSIM)探索丰水期和枯水期之间底栖硅藻群落的差异性, 通过独立样本检验, 检验物种丰富度的差异, 使用综合营养状态指数对研究区域水体营养状态进行划分。其中, ASNOSIM使用PRIMER5.0软件完成, 独立样本检验和相关性分析使用SPSS22.0完成。TSI指数评价标准: 0
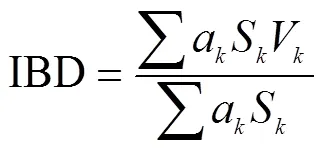
式中,a表示硅藻种的相对丰度,V代表种的环境指示值,S代表种境的敏感值。IBD评价标准: IBD<5为很差; 9>IBD≥5差; 13>IBD≥9中等; 17>IBD≥13好。
GI指数的计算公式为(Wu, 2002):

式中,a表示曲壳藻属(sp.)的相对丰度,a表示卵形藻属(sp.)的相对丰度,a表示小环藻属(sp.)的相对丰度,a表示桥弯藻属(sp.)的相对丰度,a表示直链藻属(sp.)的相对丰度,a表示菱形藻属(sp.)的相对丰度。
GI评价标准: <1.5为重度污染, 1.5—5为中度污染, 5—11为轻度污染, 11—30为微污染, >30为极轻微污染。
2 结果与分析
2.1 阿什河水体理化环境特征
研究期间, 阿什河流域水体理化因子空间部分特征差异明显(图2)。水体电导率(平均272μs/cm, 变化范围139—471μs/cm)、溶解氧(平均3.3mg/L, 变化范围1.1—5.7mg/L)、叶绿素(平均13.9μg/L, 变化范围3.4—59.4μg/L)、总氮(平均0.37mg/L, 变化范围0.25—0.52mg/L)、总磷(平均0.15mg/L, 变化范围0.01—0.42mg/L)、高锰酸盐指数(平均4.6mg/L, 变化范围1.6—7.8mg/L)及5日生化需氧量(平均1.83mg/L, 变化范围1.1—2.8mg/L) 7项指标, 以上理化因子变化均表现为排污口最高(S1—S4), 水库保护区前后(S7、S8)最低的分布格局。水体浊度(平均57.9 NTU, 变化范围30.6—95.1 NTU)与上述7项指标不同, 表现为枯水期高值依旧出现在排污口区域, 但丰水期为农业区最高的规律。在枯水期与丰水期之间水体电导率、浊度和氧化还电位等变化不明显, 而叶绿素、总氮、总磷及高锰酸盐指数变化差异显著(<0.05)。
2.2 阿什河流域底栖硅藻群落结构
在研究期间共鉴定底栖硅藻89种, 隶属于2纲12目20科36属。其中, 丰水期共鉴定硅藻80种, 枯水期鉴定硅藻57种。物种丰富度和Shannon-Wiener指数变化范围在16—36种和1.04—2.32之间, 其中物种丰富度最高值出现在丰水期的S8站位为36种, 而枯水期的S6站位物种丰富度最低, 仅为16种; Shannon-Wiener指数最高值出现在枯水期的S1站位, 最低值出现在枯水期S7站位(图3)。独立样本检验(-test)表明阿什河流域物种丰富度丰水期显著高于枯水期(<0.05), Shannon-Wiener指数变化不显著(>0.05)。群落相似性分析(analysis of similarities, ANOSIM)表明, 阿什河流域丰水期和枯水期之间硅藻群落结构差异明显(<0.05) (表1)。污水排污口与农业区硅藻群落结构空间异质性差异明显(<0.05), 农业区和保护区群落结构差异不显著(>0.05) (表1, 图4)。
2.3 营养状态评价
综合营养状态指数(TSI)表明, 阿什河流域水体营养状态在时空分布上呈现一定规律。在空间上, 污水排污口区域(S1—S4)处于中营养-轻度富营养水平, 农业区和水源保护区(S5—S8)处于贫营养-中营养水平。在枯水期与丰水期之间, 营养状态呈现丰水期显著高于枯水期的规律(<0.05)。
基于11项水体理化指标的层次聚类分析表明, 研究期间污水排污口区域水体营养水平与其他区域特征差别明显, 在研究期间通常处于中营养-高营养水平, 流经西泉眼水库保护区的站位营养水平最低, 通常处于贫营养-中营养之间, 受农业污水影响的区域则在枯水期与丰水期之间, 均保持中营养状态(图5)。

图2 阿什河流域理化指标指数时空分布
注: pH: 酸碱度; WT: 水温; DO: 溶解氧; Conductivity: 电导率; Turbidity: 浊度; chl: 叶绿素; TN: 总氮; TP: 总磷; CODMn: 高锰酸盐指数; BOD5: 五日生化需氧量
硅藻生物指数IBD值与水体健康水平成正相关, 指数值越大, 表示水体健康水平越高。IBD值表明阿什河污水排污口区域(S1—S4)和农业区(S5—S6)的评价为“很差”和“差”。而水库保护区(S7、S8)的评价标准为“差”和“中等”(图6)。在枯水期与丰水期之间呈现枯水期IBD得分要高于丰水期的规律, 反映枯水期的营养状态要好于丰水期。这与TSI评价结果基本一致。与IBD指数相似, 硅藻属指数GI数值越高, 水体健康水平越好。本次研究中, GI值评价认为工业排污口区域(S1—S4)营养状态要好于其他区域, 这与TSI和IBD评价结果相反。
注: IBD: biological diatom index, 硅藻生物指数; GI: generic index of diatom, 硅藻属指数
表1 阿什河流域底栖硅藻群落结构ANOSIM及SIMPER分析

Tab.1 Two-way crossed ANOSIM and SIMPER for testing the area and period on diatom communities in Ashi River Basin, and the differences in diatom communities between area and period
2.4 底栖硅藻分布格局与环境因子的关系
对阿什河流域水温(WT)、pH、电导率(Conductivity)、溶解氧(DO)、浊度(Turbidity)、叶绿素(chl)、总磷(TP)、总氮(TN)、高锰酸盐指数(CODMn)及5日生化需氧量(BOD5)共10种理化因子与优势种硅藻进行排序分析, 探究阿什河流域底栖硅藻在枯水期与丰水期和人为互动干扰区域之间的分布格局, 并对驱动阿什河流域底栖硅藻时空分布的主要环境因子进行筛选与识别。筛选优势种硅藻进行除趋势对应分析(detrended correspondence analysis, DCA), DCA结果表明排序轴最长梯度长度值为2.31。因此, 线性模型冗余分析(redundancy analysis, RDA)可更好地解释阿什河流域底栖硅藻分布格局与环境因子关系。
排序分析结果显示, RDA排序轴1和轴2的特征值分别为0.36和0.19, 硅藻群落与环境因子相关系数达到0.86和0.86, 前四个排序轴共解释92.0%的累计种类环境变量百分比。说明本次RDA排序结果可靠, 基本反映了研究期间阿什河流域底栖硅藻与环境因子之间的生态关系。经蒙特卡洛检验, 电导率和高锰酸盐指数与阿什河流域底栖硅藻时空分布特征关系密切(2=3.148,2=2.27,<0.05) (图7)。
3 讨论
3.1 阿什河流域底栖硅藻群落结构
底栖硅藻的时空分布特征与流域内水环境特征关系密切, 当枯水期与丰水期间水温、营养盐及光照发生改变时, 硅藻群落能通过演替来完成对水环境条件的生态适应, 进而维持群落的能量流动和信息传递的平衡(陈向等, 2012; 谭香等, 2018)。研究表明枯水期与丰水期之间水文条件的变化对河流硅藻群落结构有着重要影响(Elias, 2012)。如水温、降雨量带来的地表径流变化都会影响硅藻光合作用的过程, 进而对硅藻的群落结构产生限制(陶建霜等, 2015)。本次研究共鉴定隶属于36个属的底栖硅藻共89种。物种丰富度与太子河(90种)流域和东江流域(83种)研究结果相近, 但远低于浑河(230种)和黔桂喀斯特流域(516种)。研究期间底栖硅藻Shannon- Wiener多样性指数表明阿什河底栖硅藻群落结构稳定性一般, 这主要因为阿什河流域受城市活动污染较为明显, 在不同人为活动干扰下河段整体营养水平较高, 优势种支配地位明显。ANOSIM分析表明, 研究期间丰水期和枯水期之间优势种的变化存在一定演替规律。SIMPER分析结果表明变异直链藻(Agardh)和谷皮菱形藻[(Kützing) Smith]是枯水期与丰水期间的关键影响物种, 其对群落相似性差异贡献度分别超过20%和10% (表1)。直链藻是河流生态系统中的代表性硅藻, 其中变异直链藻相对于其他种类如颗粒直链藻[(Ehrenberg) Ralfs]对于水体扰动环境的适应相对较弱(Rusanov, 2012)。变异直链藻喜好营养盐水平较高的栖息环境, 在富营养化程度较高的水域中容易成为优势种群(Lepistö, 2006)。阿什河流域受农业污水影响的样点水体营养水平普遍较高, 加之枯水期降雨量减少, 地表径流降低, 较高的营养状态水平为变异直链藻提供了适宜的生存环境, 因此该种在枯水期硅藻群落中的相对丰度明显升高。谷皮菱形藻是广泛分布的耐污种类, 被认为是指示水体环境变化的有效生态指标(Triest, 2012)。谷皮菱形藻的生态适应机制属于耐受于水体扰动和冲刷(Flushing) (Reynolds, 2002), 这可能也是该种能在雨量较高的丰水期中占据优势的主要原因之一。室内实验研究表明谷皮菱形藻对光照强度反映敏感, 适度的光照增加能提升该种的生物量(徐婷婷等, 2014)。尽管阿什河枯水期降雨量减少, 水体扰动降低, 其他种类如披针舟形藻[(Agardh) Kützing]、对称舟形藻(Patrick)和辐头舟形藻(Germain)也可以在与谷皮菱形藻资源竞争中逐渐占据优势, 导致其相对丰度逐渐升高(图4), 但由于水体稳定的光照环境, 谷皮菱形藻在阿什河枯水期仍然能够占据一定优势。
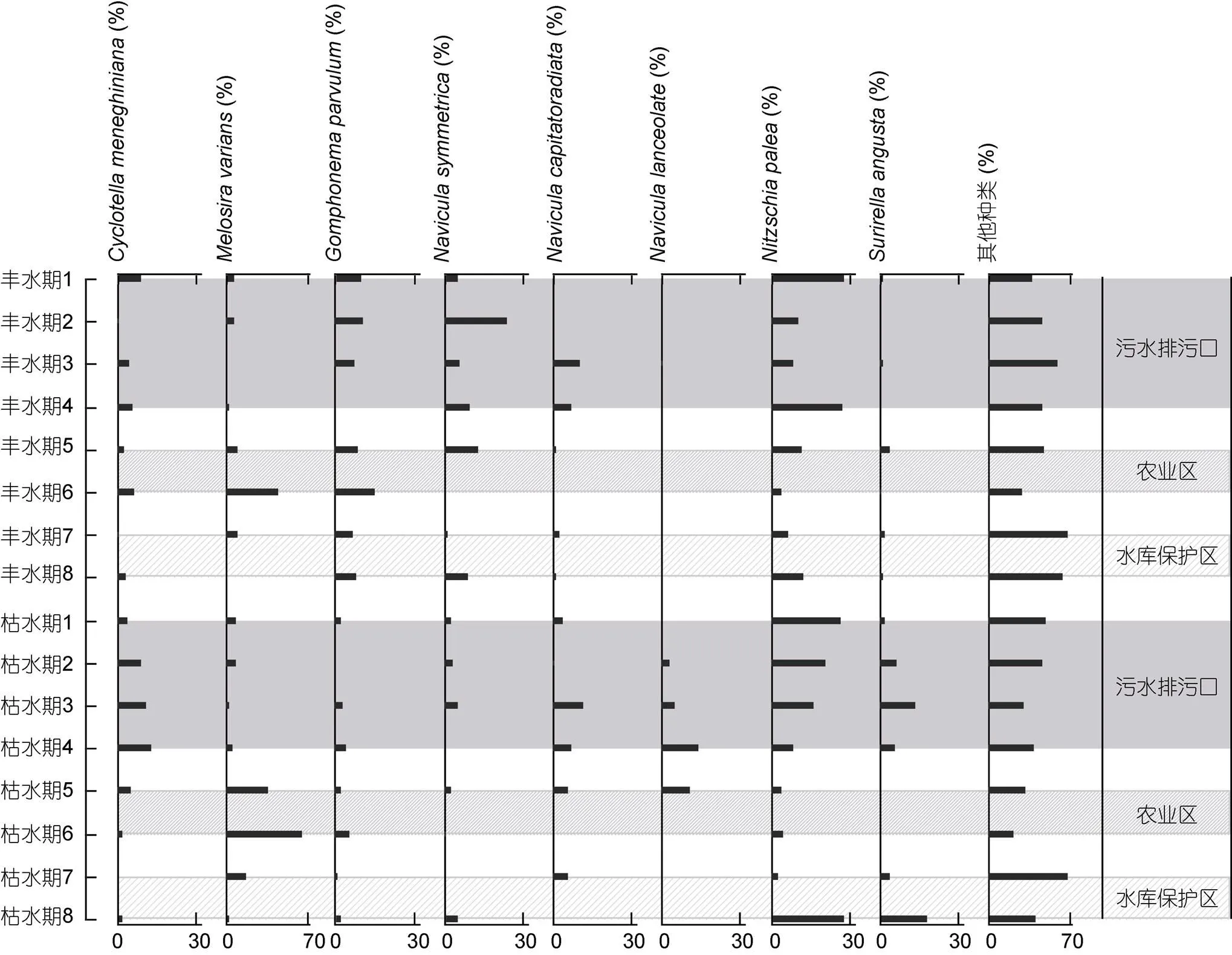
图4 阿什河流域硅藻群落特征
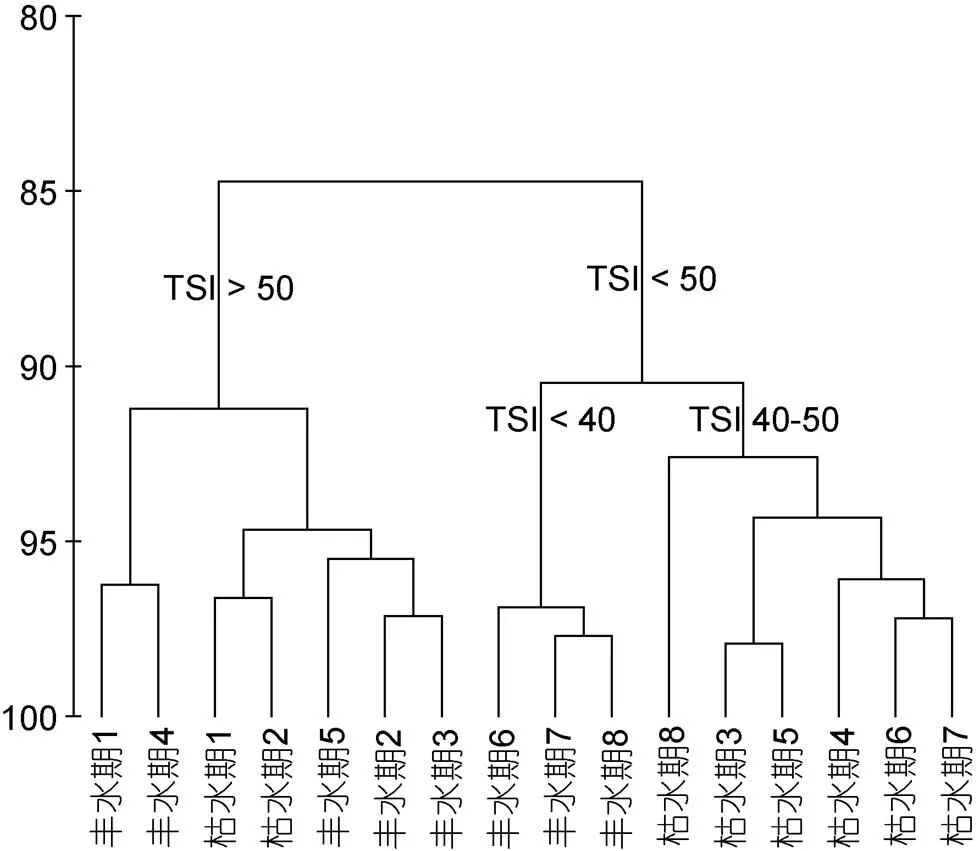
图5 阿什河流域理化因子聚类分析
注: TSI: trophic state index, 水体营养指数

图6 阿什河流域TSI指数时空分布
表2 TSI、IBD及GI指数Spearman相关性分析

Tab.2 Spearman correlation of dominate species, TSI, IBD, and GI
注:*表示差异显著

图7 基于优势种硅藻和环境因子的RDA排序图
Fig 7 RDA ordination based on dominate diatom and environmental factors in Ashi River Basin
注:-:Kützing (梅尼小环藻),-:Agardh (变异直链藻),-:Kützing (小型异极藻),-:Patrick (对称舟形藻),-:Germain (辐头舟形藻),-:(Agardh) Kützing (披针舟形藻),-:(Kützing) Smith (谷皮菱形藻),-:Kützing (窄双菱藻).
DO: 溶解氧; Conductivity: 电导率; TP: 总磷; chl: 叶绿素; TN: 总氮; BOD5: 五日生化需氧量; CODMn: 高锰酸盐指数; WT: 水温; pH: 酸碱度
3.2 阿什河底栖硅藻群落对环境梯度的生态响应
相对于湿地、湖泊及水库等静水生态系统而言, 河流作为一种流动性水体, 水体理化环境存在明显的周期性和极高的空间异质性(李丽娟等, 2015)。随着人口的增加和经济的高速发展、农牧业活动增加, 大量的废水直接排入水体中, 使阿什河流域持续保持了较高的富营养水平(马广文等, 2014)。底栖硅藻群落分布特征受水体中物理(WT、Conductivity)和化学(N、P、CODMn等)因子共同驱动(孟昭翠等, 2013)。作为河流生态系统中的主要初级生产者, 底栖硅藻的分布模式决定了流域内的初级生产力, 生态系统的稳定与平衡也反映了环境梯度的变化规律(项珍龙等, 2018)。本次研究中RDA前2轴分别与电导率、总氮、高锰酸盐指数和水温关系密切(2=-0.6749,-0.4636,-0.4635和-0.6026)关系密切, 采样点排序轴中的位置基本反映了阿什河流域水环境梯度特征及硅藻群落分布格局对主要环境因子梯度的生态响应。
电导率(Conductivity)是影响淡水生态系统中生物群落结构的主要环境因子, 特别是河流生态系统中电导率的高低是表征水体纯净及地表径流特征的关键指标之一。许多研究表明, 电导率同样也是影响硅藻群落分布的主要环境因子(易燃等, 2015; 李巧玉等, 2017)。阿什河流域水体电导率的变化与硅藻群落空间分布特征具有很好的响应关系。本次研究中, RDA排序表明电导率是驱动阿什河流域硅藻群落空间分布的关键因子(=3.148,<0.05), 这与我国东江流域、桂江流域及浑河流域的相关研究结果相吻合(邓培雁等, 2012; 陈向等, 2012; 项珍龙等, 2018)。受城市污水排放影响, 阿什河流域水质从上游水库保护区(S7、S8)到下游污水排放口区域(S1—S4), 水体营养状态梯度呈明显升高趋势。ANONSIM分析表明排污口区域与农业区群落结构差异明显(<0.05)(表1), 排污口区域电导率(平均364μs/cm)显著高于农业区和水库保护区(<0.05)。从RDA排序图显示, 硅藻中的谷皮菱形藻和对称舟形藻在排污口区域呈现较高的权重, 其相对丰度与电导率含量变化密切相关(图7)。SIMPER分析也可看出谷皮菱形藻和对称舟形藻是排污口区域与农业区域硅藻群落结构差异的主要物种。谷皮菱形藻被普遍认为是河流和湿地水体中的富营养指示种; Weilhoefer等(2006)对美国中部(Mid-Atlantic Highlands)河流底栖硅藻群落与环境关系表明谷皮菱形藻分布特征反映了总磷和电导率的梯度变化; 邓培雁等(2015)对我国东江流域硅藻研究表明谷皮菱形藻对电导率具有较高的最适值。属的种类广泛应用于指示水体的营养状态, Grenier等(2010)对法国Lawrence Basin底栖硅藻生态阈值研究中表明, 对称舟形藻分布可作为水环境梯度有效指示种(指示值为84); 对称舟形藻也是中度营养状态的指示种。阿什河流域中的谷皮菱形藻和对称舟形藻分布亦对水体电导率具有明显的生态响应。此外, 在阿什河流域附近开展的湿地(马广文等, 2014)和湖泊浮游生物群落结构(董雪等, 2016)研究表明, 电导率与水环境中的浮游生物多样性格局关系密切。
高锰酸盐指数是反映水体有机污染的指标, 水体有机物释放过程中所导致营养盐含量变化, 是影响硅藻个体生长代谢的因素之一(王倩等, 2009)。阿什河流域地处温带季风气候, 年平均降水量为545.7mm, 丰水期水流通过地表径流携带污染物汇入阿什河水体造成污染, 是使丰水期水体营养程度升高的原因之一(张莉等, 2017)。RDA分析结果表明, 阿什河枯水期与丰水期之间高锰酸盐指数梯度的将丰水期和枯水期硅藻群落结构明显划分为两个部分。RDA排序图显示,Kützing (小型异极藻)在丰水期采样点权重较高, 其相对丰度与高锰酸盐指数含量正相关。相关研究表明, 水体有机污染和富营养化与小型异极藻丰度关系密切; 室内实验也表明sp.在金属及有机污染胁迫下, 其生理生化特征会明显改变(Gautam, 2017)。变异直链藻是淡水生态系统的广布种, 能在富营养化水体及污染水体中形成优势种群, 是富营养化水体及污染水体的典型指示藻种(张琦等, 2016)。ANONSIM和SIMPER分析指出变异直链藻是构成枯水期与丰水期之间硅藻群落差异的主要物种, 但本研究的RDA排序分析显示随着高锰酸盐指数含量升高变异直链藻并未呈现明显上升趋势, 这可能是因为变异直链藻属于广谱性分布物种, 对营养盐含量变化具有较高的耐受性。综合来看, 阿什河流域水体高锰酸盐指数和电导率含量的变化驱动了枯水期与丰水期之间硅藻群落结构的时空分布, 而谷皮菱形藻、对称舟形藻和小型异极藻这些优势种的分布特征, 与阿什河流域的水环境梯度变化有较好的响应。
3.3 硅藻指数对阿什河水体营养状态的指示
河流生态系统独特的水流方向性, 使其流域内生物完整性具有独特的分布特征, 其多样性分布格局是对流域内地形、气候、地表径流及人为活动干扰响应的综合生态载体, 特别是底栖硅藻的分布特征更是指示营养状态的有效生物指示信号(陈向等, 2017)。目前, 基于底栖硅藻指数已广泛应用于河流水质的监测及水体环境的重演中(刘园园等, 2016; 项珍龙等, 2016)。
TSI指数是综合多个环境因子对水体进行营养状态评价的方法, 与单因子评价相比其结果准确性更高。该指数常应用于湖泊(杨梅玲等, 2013)、湿地(黄小波等, 2009)、水库及河流(周晓铁等, 2010)等诸多水体的营养状态评价。由于不同纬度、人为活动干扰所带来的气候条件、水体营养状态差异, 硅藻指数的应用效果存在一定的区域和空间局限性。IBD指数评价法是基于硅藻生态适应性(耐污、敏感性)及物种丰富度特征发展而来的指数, 能有效的指示水体营养状态及有机污染情况。目前IBD指数已广泛应用于欧盟水框架河流水质评价中, 并取得可靠的结果(Coste, 2009)。阿什河是典型的受人为活动干扰所导致水体营养状态空间异质性差异明显的河流, 本次研究中基于IBD和TSI指数分析表明, IBD和TSI评价结果较为类似。阿什河受人为活动干扰的排污口和农业区, 水体营养状态多处于“差”或“中营养水平”, 而水库保护区则为“中等”或“贫营养”水平, 这与水体理化指标所指示的水体营养状态特征基本吻合。Spearman相关性分析表明IBD和TSI值成正相关, 结合两个指标所反映的生态指示意义, 说明应用IBD指数评价阿什河流域水体营养状态较为可靠。理论上GI指数评价水体健康状况的高值区应与TSI和IBD指数的高值区相反, 而本研究中Spearman相关性分析表明GI指数与TSI指数呈现显著正相关(>0.05)。如S1样点实际水体富营养状态较为严重, 但GI指数却在表征营养状态较好的高值区, 而S1样点基于IBD和TSI指数的营养状态评价也与GI指数评价结果相悖。对亚热带流域河流底栖硅藻研究表明, GI指数评价营养状态效果不如IBD指数可靠(邓培雁等, 2015)。本研究Spearman相关性分析表明GI指数与优势种之一的梅尼小环藻相对丰度呈现显著正相关(<0.05) (表2)。梅尼小环藻被认为是广普性耐污指示种, 通常生活在营养水平较高的环境中, 较高的梅尼小环藻丰度是水域富营养指示信号。这进一步验证了GI指数对阿什河水体营养状态评价的效果并不理想。
随着水域生物多样性研究的深入, 从各种生态角度出发的硅藻指数逐渐应用于河流生态研究中。然而, 底栖硅藻指数的适用性需综合考量, 如: 水体理化参数、河流等级、人为活动干扰及海拔等诸多因素的改变, 都可能改变硅藻指数健康评价的结果(Tan, 2013)。从物种本身指示意义出发, 结合水生态环境特征对硅藻指数的应用仍然是现阶段最可靠的方法。对指示效能较低的硅藻指数筛选与排除, 是河流生态系统评价体系完善的关键环节。
4 结论
底栖硅藻是水域生态系统的重要初级生产者及环境指示生物, 本研究选择典型城市污染河流阿什河流域为研究区域, 基于多元统计分析探索了底栖硅藻的多样性格局及环境相关性, 通过IBD和GI指数及TSI等对水体健康状态进行分析。研究期间阿什河流域共鉴定底栖硅藻89种, 枯水期与丰水期之间底栖硅藻群落特征存在一定差异。驱动阿什河流域底栖硅藻生态分布的主要环境因子为高锰酸盐指数和电导率。综合本底数据分析, 表明硅藻生物指数IBD能较好的反应阿什河流域水体健康状况。
马广文, 王业耀, 香 宝等, 2014. 阿什河丰水期氮污染特征及其来源分析. 环境科学与技术, 37(11): 116—120, 155
王 倩, 支崇远, 康福星, 2009. 黔桂喀斯特区域河流水体离子对底栖硅藻群落的影响. 环境科学学报, 29(7): 1517—1526
邓培雁, 张 婉, 王旭涛等, 2015. 水质对东江流域附生硅藻群落的影响. 生态学报, 35(6): 1852—1861
邓培雁, 雷远达, 刘 威等, 2012. 桂江流域附生硅藻群落特征及影响因素. 生态学报, 32(7): 2196—2203
刘园园, 陈光杰, 施海彬等, 2016. 星云湖硅藻群落响应近现代人类活动与气候变化的过程. 生态学报, 36(10): 3063—3073
李巧玉, 刘 瑞, 向 蓉等, 2017. 三峡库区支流底栖硅藻功能群特征及其驱动因子分析——以汝溪河为例. 湖泊科学, 29(6): 1464—1472
李丽娟, 金 文, 王博涵等, 2015. 太子河河岸带土地利用类型与硅藻群落结构的关系. 环境科学研究, 28(11): 1662—1669
李国忱, 汪 星, 刘录三等, 2012. 基于硅藻完整性指数的辽河上游水质生物学评价. 环境科学研究, 25(8): 852—858
李晓琳, 薛俊增, 吴惠仙, 2016. 洋山港海域浮游植物群落结构特征及演变趋势. 生物学杂志, 33(6): 62—67
杨梅玲, 胡忠军, 刘其根等, 2013. 利用综合营养状态指数和修正的营养状态指数评价千岛湖水质变化(2007年-2011年). 上海海洋大学学报, 22(2): 240—245
张 莉, 林佳宁, 张 远等, 2017. 浑太河不同水生态区营养盐对底栖硅藻的影响及阈值. 环境科学, 38(11): 4570—4579
张 琦, 傅园园, 黄河仙等, 2016. 东洞庭湖浮游藻类优势种群对主要水环境因子的生态适应性. 广西科学, 23(2): 144—149
陈 向, 刘 静, 何 琦等, 2012. 东江惠州河流段人工基质附着硅藻群落的季节性动态. 湖泊科学, 24(5): 723—731
陈 向, 周伟奇, 李伟峰, 2017. 北京河流底栖硅藻沿城乡梯度带空间分布及其季节变化. 生态学报, 37(10): 3586—3595
陈 威, 魏 南, 金小伟, 等, 2018. 松花江哈尔滨段藻类植物分布及其与环境因子的关系. 中国环境监测, 34(4): 107—115
易 燃, 蔡德所, 张永祥等, 2015. 龙江底栖硅藻群落特征及与环境因子的关系. 环境科学与技术, 38(4): 40—46, 78
周 浩, 王凤鹭, 于晓英, 2017. 牡丹江流域冰封期浮游植物群落组成及生物多样性研究. 现代农业科技, (2): 163, 167
周晓铁, 韩宁宁, 孙世群等, 2010. 安徽省河流和湖库型饮用水水源地水质评价. 湖泊科学, 22(2): 176—180
孟昭翠, 徐奎栋, 2013. 长江口及东海春季底栖硅藻、原生动物和小型底栖生物的生态特点. 生态学报, 33(21): 6813—6824
项珍龙, 杨 璐, 李 晨等, 2018. 浑河流域底质类型对硅藻群落分布特征的影响. 环境科学学报, 38(2): 570—578
项珍龙, 陈 海, 李 晨等, 2016. 河流硅藻指数在太子河水生态健康评价中的应用研究. 大连海洋大学学报, 31(4): 416—425
胡鸿钧, 魏印心, 2006. 中国淡水藻类—系统、分类及生态. 北京: 科学出版社, 300—416
徐婷婷, 路建周, 靳 萍等, 2014. 温度、光照和氮磷浓度对谷皮菱形藻生长的影响. 淡水渔业, 44(3): 39—44
陶建霜, 陈光杰, 陈小林等, 2015. 多重环境压力下大屯海硅藻群落结构的长期变化. 应用生态学报, 26(8): 2525—2533
黄小波, 洪剑明, 杜桂森等, 2009. 北京市汉石桥湿地浮游植物调查与水质评价. 湖南农业科学, (4): 133—135
董 雪, 蔡 艳, 贾铭宇等, 2016. 阿什河春季不同河段大型底栖动物群落结构与环境因子. 东北林业大学学报, 44(1): 90—93
廖梦娜, 李艳玲, 2018. 东北镜泊湖硅藻对近现代气候变化和人类干扰的响应过程. 生态学报, 38(4): 1458—1469
谭 香, 张全发, 2018. 底栖硅藻应用于河流生态系统健康评价的研究进展. 水生生物学报, 42(1): 212—220
Barbour M T, Gerritsen J, Snyder B D, 1999. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. 2nd ed. Washington US: Environmental Protection Agency, Office of Water
Benito X, Fritz S C, Steinitz-Kannan M, 2018. Geo-climatic factors drive diatom community distribution in tropical South American freshwaters. Journal of Ecology, 106(4): 1660—1672
Bouchard F, Proult V, Pienitz R, 2018. Periphytic diatom community structure in thermokarst ecosystems of Nunavik (Québec, Canada). Arctic Science, 4(1): 110—129
Coste M, Boutry S, Tison-Rosebery J, 2009. Improvements of the Biological Diatom Index (BDI): Description and efficiency of the new version (BDI-2006). Ecological Indicators, 9(4): 621—650
Elias C L, Vieira N, Feio M J, 2012. Can season interfere with diatom ecological quality assessment? Hydrobiologia, 695(1): 223—232
Gautam S, Pandey L K, Vinayak V, 2017. Morphological and physiological alterations in the diatomdue to heavy metal stress. Ecological Indicators, 72: 67—76
Grenier M, Lavoie I, Rousseau A N, 2010. Defining ecological thresholds to determine class boundaries in a bioassessment tool: the case of the Eastern Canadian Diatom Index (IDEC). Ecological Indicators, 10(5): 980—989
Krammer K, 2002. Diatoms of the European inland waters and comparable habitats.. In: Gantner A R G, Verlag K G eds. Diatoms of Europe. Volume 3. Königstein, 1—584
Lampitt R S, Wishner K F, Turley C M, 1993. Marine snow studies in the Northeast Atlantic Ocean: distribution, composition and role as a food source for migrating plankton. Marine Biology, 116(4): 689—702
Lepistö L, Kauppila P, Rapala J, 2006. Estimation of reference conditions for phytoplankton in a naturally eutrophic shallow lake. Hydrobiologia, 568(1): 55—66
Reynolds C S, Huszar V, Kruk C,2002. Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research, 24(5): 417—428
Rusanov A G, Stanislavskaya E V, Ács É, 2012. Periphytic algal assemblages along environmental gradients in the rivers of the Lake Ladoga basin, Northwestern Russia: implication for the water quality assessment. Hydrobiologia, 695(1): 305—327
Tan X, Sheldon F, Bunn S E, 2013. Using diatom indices for water quality assessment in a subtropical river, China. Environmental Science and Pollution Research, 20(6): 4164—4175
Triest L, Lung’ayia H, Ndiritu G, 2012. Epilithic diatoms as indicators in tropical African rivers (Lake Victoria catchment). Hydrobiologia, 695(1): 343—360
Van Vuuren S J, Saber A A, Swanepoel A, 2018. Can the presence of curved forms of the diatomin the Nile (Egypt) and Vaal (South Africa) Rivers be ascribed to similar water quality conditions? African Journal of Aquatic Science, 43(2): 111—122
Weilhoefer C L, Pan Y D, 2008. Using change-point analysis and weighted averaging approaches to explore the relationships between common benthic diatoms and in-stream environmental variables in mid-atlantic highlands streams, USA. Hydrobiologia, 614(1): 259—274
Wu J T, Kow L T, 2002. Applicability of a generic index for diatom assemblages to monitor pollution in the tropical River Tsanwun, Taiwan. Journal of Applied Phycology, 14(1): 63—69
Zelinka M, Marvan P, 1961. Zur Präzisierung der biologischen Klassifikation des Reinheit fliessender Gewässer. Archiv für Hydrobiologie, 57: 389—407
Benthic Diatom Community Characteristics in Ashi River Basin and Aquatic ENVIRONMENTAL Health Assessment
ZHAO Yang, LU Xin-Xin, MA Yu, LI Zhen-Xiang, LIU Yan, FAN Ya-Wen
(College of Life Science and Technology, Harbin Normal University, Key Laboratory of Biodiversity of Aquatic Organisms, Harbin Normal University, Heilongjiang Province, Harbin 150025, China)
The characteristics of benthic diatom communities and their response to the environment in the Ashi River Basin, Heilongjiang, NE China were explored, and the health state of water was evaluated. Eight typical sampling sites of the basin were investigated in wet season (July 2018) and dry season (October 2018). The differences of benthic diatom communities between the two seasons were studied by the analysis of similarities (ANOSIM) and the similarity percentages (SIMPER). The key environmental factors driving benthic diatoms were specified by RDA (redundancy analysis). The water trophic status of the area was determined using IBD (biological diatom index), GI (generic index of diatom), and TSI (trophic state index). Results show that there were a total of 89 taxa, of which 80 species in wet season and 57 species in dry season were identified. The richness of the wet season was significantly higher than the dry season (<0.05), while there was no significant change in Shannon-Wiener index among different seasons (>0.05) as indicated in the independent sample-test. In addition, the spatial and temporal heterogeneity was certain in the diatom community patterns in the area as revealed in ANOSIM and SIMPER. Water conductivity was found the driving factor on the spatial distribution of benthic diatoms in the Ashi River Basin as confirmed in RDA, and the change of CODMnbetween the seasons was one of the factors contributing to the succession of diatom communities. Overall, the nutritional status of Ashe River Basin was poor as shown by IBD, GI, and TSI, of which IBD index was more effective than GI index.
Ashi River Basin; diatom; IBD (biological diatom index); GI (generic index of diatom); RDA (redundancy analysis)
* 国家自然科学基金项目, 31870187号, 31970213号。赵 杨, 硕士研究生, E-mail: zyang0201@163.com
范亚文, 博士生导师, 教授, E-mail: fanyaw@163.com; 刘 妍, 硕士生导师, 副教授, E-mail: liuyanll@sina. com
2019-10-01,
2019-12-14
Q178.1
10.11693/hyhz20191000184

