苁蓉舒痉颗粒中间体总多糖的质量控制研究
洪丽婷,刘秀棉,陈 丹*,黄庆德,蔡 晶,余文静,熊朝栋
(1. 福建中医药大学药学院,福建 福州350122;2. 福建中医药大学中西医结合学院,福建 福州350122)
苁蓉舒痉颗粒由苁蓉、黄精等中药组成,是在中医药理论指导下,结合现代最新研究成果,针对帕金森病肌强直开发研制的颗粒剂[1]。 研究表明,苁蓉舒痉颗粒的多糖组分是抗帕金森病肌强直作用的重要药效部位[2-3]。 多糖作为生命的有机体,与维持生命的种种生理机能有着密切的联系,它一般是由10 个以上醛糖和(或)酮糖通过糖苷键连接在一起的聚合物。 为确保苁蓉舒痉颗粒成品质量,需要在生产过程中建立有效控制颗粒剂中间体总多糖含量的测定方法。 故本实验以葡萄糖为对照品,蒽酮-硫酸溶液为显色剂,在582 nm 波长处测定苁蓉舒痉颗粒中间体总多糖含量,并对三批苁蓉舒痉颗粒中间体样本进行含量检测。
1 仪器与试药
1.1 仪器 XS 205 十万分之一电子天平、AR 2140万分之一电子天平(梅特勒-托利多仪器上海有限公司);HH-S 型水浴锅(郑州长城科工贸有限公司);KQ-500E 型超声波清洗器(昆山市超声仪器有限公司);UV-4802 型双光束紫外可见分光光度计(尤尼柯上海仪器有限公司)。
1.2 试药 苁蓉舒痉颗粒中间体(自制,批号20190403,20190405,20190407);D-无水葡萄糖(中国食品药品检定研究院,批号:110833-201707);蒽酮(国药集团化学试剂有限公司,批号:20180111);硫酸、无水乙醇等其余试剂均为分析纯,水为蒸馏水。
2 方法与结果
2.1 对照品溶液制备 取经105 ℃干燥至恒重的无水葡萄糖对照品适量,精密称定,置100 mL 量瓶中,加水溶解并稀释至刻度,摇匀,配成浓度为0.34 mg/mL 的对照品溶液,即得。
2.2 供试品溶液制备 取苁蓉舒痉颗粒中间体粉末约0.25 g,精密称定,置于50 mL 离心管中,加入5 mL 水,超声15 min 使溶解,加入20 mL 无水乙醇,快搅慢加,置4 ℃冰箱中静置12 h,以4 000 r/min离心15 min,弃上清液,残渣用80%乙醇洗涤2 次,每次2 mL,残渣烘干,加水适量使溶解,定量转移至50 mL 量瓶中,加水稀释至刻度,摇匀,即得。
2.3 蒽酮-硫酸溶液配制 称取0.20 g 蒽酮,用浓硫酸溶解并制得0.2%蒽酮-硫酸溶液,注意避光保存,临用新配。
2.4 测定波长的选择 精密吸取对照品溶液0.4 mL、供试品溶液1.0 mL 及蒸馏水(即空白对照溶液)1.0 mL,分别置10 mL 洁净干燥的具塞刻度试管中,加水补至2 mL,振荡摇匀,在冰水浴中缓缓滴加新鲜配制的0.2%蒽酮-硫酸溶液8 mL,混匀,放冷后置沸水浴中保温10 min,取出,立即置冰水浴中冷却10 min,取出。 分别在500~800 nm 波长范围进行扫描,确定最大吸收波长。 实验结果表明,葡萄糖对照品溶液和供试品溶液在582 nm 波长处均有最大吸收,空白溶液无干扰,故选定582 nm 为测定颗粒剂中间体总多糖的测定波长,见图1。
2.5 标准曲线制备及线性关系考察 精密吸取对照品溶液0.1、0.2、0.4、0.5、0.6、0.8 mL,分别置于10 mL 洁净干燥的具塞刻度试管中,按“2.4”项下自“加水补至2 mL……”起,同法操作,在582 nm 波长处测定吸光度值A,以吸光度值(A)为纵坐标,无水葡萄糖质量浓度(C)为横坐标,线性回归并绘制标准曲线。 实验结果表明,回归方程A=3.727×102C+4.465×102,r=0.998 8。 无水葡萄糖质量浓度在3.41~27.26 μg/mL 范围内与吸光度A 呈良好的线性关系。 结果见表1、图2。
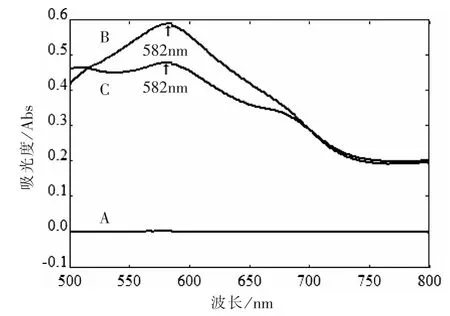
图1 显色后吸收光谱图

表1 线性关系考察结果
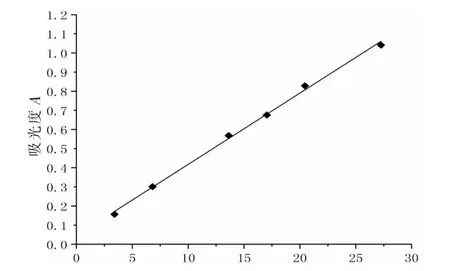
图2 葡萄糖标准曲线图
2.6 精密度试验 精密吸取对照品溶液0.5 mL,置10 mL 具塞干燥试管中,按“2.4”项下自“加水补至2 mL……”起,同法操作,在582 nm 波长处连续测定吸光度值6 次。 实验结果表明,吸光度分别为0.675 6、0.675 6、0.675 5、0.675 5、0.675 5、0.675 4,RSD 值为0.01%,仪器精密度良好。
2.7 稳定性试验 取供试品溶液,按“2.4”项下自“加水补至2 mL……”起,同法操作,在室温下避光放置,分别在0、30、60、90、120、150、180 min 时,在582 nm 波长处测定吸光度A。 实验结果表明,吸光度分别为0.448 0、0.446 4、0.441 4、0.441 6、0.437 7、0.437 6、0.437 8,RSD 值为0.96%,供试品溶液显色后在室温避光放置3 h 内稳定。
2.8 重复性试验 分别精密称取苁蓉舒痉颗粒中间体粉末(批号20190405)约0.25 g,6 份,按“2.2”项下方法制备供试品溶液,按“2.4”项下自“加水补至2 mL……”起,同法操作,在582 nm 波长处测定吸光度,计算总多糖含量。 实验结果表明,总多糖平均含量为21.85 mg/g,RSD 值为1.00%,该方法重复性良好。 见表2。

表2 重复性试验考察结果
2.9 加样回收率试验 分别精密称取已知总多糖含量(21.85 mg/g)的苁蓉舒痉颗粒中间体粉末(批号20190405)约0.125 g,6 份,按“2.2”项下方法处理样品,并分别精密加入浓度为2.36 mg/mL 的无水葡萄糖对照品溶液1.0 mL,继续加水至刻度线,摇匀,即得回收率测定的供试品溶液,按照“2.4”项下自“加水补至2 mL……”起,同法操作,于582 nm处测定吸光度并计算总多糖含量,计算回收率。 实验结果测得的平均回收率为98.32%,RSD 值为1.65%。 实验结果表明,方法准确度较高。 见表3。
2.10 样品含量测定 取三批苁蓉舒痉颗粒中间体,分别按“2.2”项下方法制备供试品溶液,按“2.4”项下自“加水补至2 mL……”起,同法操作,在582 nm波长处测定吸光度,计算总多糖含量,每批次平行试验3 次。 见表4。

表3 加样回收率试验结果

表4 样品总多糖含量测定结果(n=3)
3 讨 论
现在普遍采用的多糖含量测定方法,是利用多糖在强酸性条件下水解生成单糖,继续脱水成糠醛或者糠醛类衍生物,然后再与酚类或胺类化合物缩合, 生成有特殊颜色物质后用分光光度法测定,其显色深度与多糖的含量呈线性关系,这类方法有蒽酮-硫酸法、苯酚-硫酸法和地衣酚-硫酸法。预实验曾比较以常用的蒽酮-硫酸法及苯酚-硫酸法测定苁蓉舒痉颗粒中间体总多糖含量,由于苯酚易氧化,苯酚用前最好需重蒸,操作较繁琐,且采用苯酚-硫酸法测定时含量结果数据变化较大,稳定性稍差。因此,实验选用《中国药典》2015 年版黄精“含量测定”项下所采用的蒽酮-硫酸法作为苁蓉舒痉颗粒中间体的总多糖含量测定方法[4],经方法学考察结果稳定、准确且重复性良好。 实验过程,蒽酮-硫酸溶液宜新鲜配制,避光保存;待测液需放置时应避光、干燥放置,避免蒽酮-硫酸试剂吸水、分解,导致结果波动。 试验应平行操作,避免环境、试剂批次对测定结果的影响。
课题组制备的苁蓉舒痉颗粒是由黄精等中药组成,据文献[5]报道,黄精多糖的单糖组成主要含有葡萄糖、果糖、半乳糖等,且《中国药典》2015 年版的中药黄精多糖含量测定方法以无水葡萄糖为对照品[4],故苁蓉舒痉颗粒中间体总多糖含量测定选择以葡萄糖为对照。
苁蓉舒痉颗粒剂的辅料之一为糊精,预实验结果表明,随着糊精比例的增加,颗粒剂总多糖含量增加,可能是糊精在测定条件下被水解成单糖,干扰苁蓉舒痉颗粒剂的多糖含量测定,引起误差[6-7]。 因此,在苁蓉舒痉颗粒制备工艺研究过程对其中间体进行总多糖的含量测定,在关键环节控制苁蓉舒痉颗粒的质量稳定,确保最终成品质量,为苁蓉舒痉颗粒总多糖质量控制方法的建立提供实验依据。

