罗非鱼胶原蛋白4种制备方法比较研究
韩玮, 邢瀚文, 施文正,2,3, 李晓晖,2,3
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
胶原蛋白是一类生物高分子,是动物结缔组织中的主要成分,它能使腱、骨、软骨、牙、皮和血管等结缔组织具有机械强度,起着支撑器官和保护机体的作用。目前胶原蛋白的应用已经涉及食品工业、生物制药、医疗保健、美容化妆、组织工程等领域[1]。中国水产资源丰富,渔业是中国发展最快的产业之一。鱼类加工过程中会产生大量的废物,切片后的鱼类加工废物约占鱼总质量的75%[2-3],许多水产品包括其加工后的废弃物含有丰富的胶原蛋白,可以成为提取胶原蛋白的良好来源。如果将这些废弃物丢掉,不仅污染环境,还对资源造成极大的浪费。根据2017年发布的《中国罗非鱼产业发展报告》报道,中国是目前世界上第一大罗非鱼的生产国和出口国,受贸易和消费者习惯的影响,罗非鱼加工企业生产成本上升、利润下降,内销市场开拓不足。因此,利用罗非鱼皮生产胶原蛋白,不但可以增加产品的附加值,而且能够减少生产哺乳动物胶原蛋白产生的安全和宗教问题。已经报道的鱼类胶原蛋白的提取有很多方法,各有优劣点。其中,热水法提取的胶原蛋白凝胶特性好,但是由于提取过程温度较高,大部分胶原蛋白变为明胶[4]。酸法提取对胶原蛋白的网络结构影响小,产物凝胶强度好,稳定性强,但是生产周期较长,对设备腐蚀严重,容易产生二次污染[5]。碱法提取胶原蛋白降解为多肽,易吸收,缺点是易导致胶原蛋白变性,过程中易产生消旋混合物,危害人体健康,且周期长,污染重,得率低[6]。酶法提取反应条件比较温和,受酶的种类和反应条件的影响比较大,产品主要是胶原蛋白肽[7]。而采用微生物发酵的方法提取胶原蛋白,不同于传统的方法,将去除杂蛋白和脂肪,提取胶原蛋白通过发酵一步实现,极大程度地简化了工艺,节约了成本,而且不用加入任何化学试剂,不会带来环境污染问题。
本研究以罗非鱼加工过程中产生的鱼皮为原料,利用实验室分离得到的一株具有较高胶原蛋白酶活力的芽孢杆菌,通过发酵法提取制备胶原蛋白,并与常见的热水提取、酸提取和碱提取方法的得率进行比较,通过紫外吸收峰、红外光谱和氨基酸测定对发酵法得到的胶原蛋白进行鉴定,并对发酵法获得的胶原蛋白各项理化性质进行测定和比较,以期为罗非鱼皮来源的胶原蛋白的加工利用提供参考,进一步推动淡水鱼皮资源的深加工。
1 材料与方法
1.1 材料
1.1.1 原料与试剂 罗非鱼干鱼皮购自市场;其他试剂均为分析纯,由国药集团化学试剂有限公司提供。
1.1.2 培养基 营养肉汤培养基:青岛海博生物有限公司;种子培养基:粉碎鱼皮1 g·L-1;牛肉膏3 g·L-1;蛋白胨10 g·L-1;NaCl 5 g·L-1;pH 7.2~7.4。
1.1.3 菌株来源Bacillussp. H3,由本实验室(农业部水产品贮藏保鲜质量安全风险评估实验室)分离鉴定,现保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:CGMCC 15830。
1.1.4 主要仪器 YP电子天平,常州市宏衡电子仪器厂;DK-8D型电热恒温水槽,上海一恒科技有限公司;FW100型高速万能粉碎机,天津市泰斯特仪器有限公司;MH-1型微量振荡器,海门市其林贝尔仪器制造有限公司;UV-1800PC型紫外可见分光光度计,上海美谱达仪器有限公司;IS5红外光谱仪,Thermo Scientific Nicolet;SW-CJ-2F双人双面垂直送风洁净工作台,上海天恒医疗器械有限公司;L-8800氨基酸自动分析仪,日本Hitachi公司;立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;MERAEUS PICO 17 Centrifuge,Thermo Scientific;THZ-82(A)气浴恒温振荡器,金坛市科析仪器有限公司。
1.2 方法
1.2.1 罗非鱼皮预处理 将干鱼皮剪成0.5 cm×0.5 cm左右小块,用粉碎机进行粉碎。取5 g鱼皮粉加入100 mL生理盐水中,进行搅拌,浸泡1 h,使鱼皮软化,4层纱布过滤,除去盐溶性杂质。用去离子水清洗,沥干。将清洗后的鱼皮浸泡于100 mL乙醇中进行搅拌,并浸泡3 h,4层纱布过滤,去除脂肪[4]。然后用去离子水清洗,沥干,备用。
1.2.2 胶原蛋白的提取
1.2.2.1 热水法提取 将5 g鱼皮预处理好后与100 mL去离子水混合,在60 ℃水浴条件下提取6 h[5]。离心后过滤,取上清液,得到胶原蛋白粗提液。将样品进行真空冷冻干燥,得到热水法制备胶原蛋白。
1.2.2.2 酸法提取 取5 g鱼皮经过预处理,加入100 mL 0.5 mol·L-1的冰乙酸溶液中,提取24 h[6]。离心后过滤,取上清液,调节pH至中性,即胶原蛋白粗提液。经过真空冷冻干燥,得到酸法制备胶原蛋白。
1.2.2.3 碱法提取 取5 g鱼皮预处理,加入100 mL 1.5%的NaOH溶液[8],提取24 h,离心后过滤,取上清液,调节pH至中性,即胶原蛋白粗提液。经过真空冷冻干燥,得到碱法制备胶原蛋白。
1.2.2.4 微生物发酵法提取 将Bacillussp.H3从甘油保藏管中接入营养肉汤培养基中,37 ℃培养24 h进行活化。将活化好的菌种接种于种子培养基中,37 ℃、160 r·min-1摇床培养24 h,制得种子液。将处理好的鱼皮5 g与125 mL去离子水混合,灭菌,作为发酵培养基。在无菌条件下,接入6%的种子液。放置于37 ℃,160 r·min-1摇床培养24 h。离心后过滤,取上清液,得到胶原蛋白粗提液[9]。将样品进行真空冷冻干燥,得到发酵法制备胶原蛋白。
1.2.3 得率测定 称取一定量胶原蛋白样品,加入6 mol·L-1的HCl 105 ℃水解24 h,采用ISO3496—1978法,稀释后测吸光度,测定样品中羟脯氨酸含量[10]。并按照以下公式[11]计算得率:
得率(%)=(m1×11.1×c)/m2×100
式中:m1为测得样品中羟脯氨酸质量(g);11.1为羟脯氨酸和胶原蛋白换算系数;c为稀释倍数;m2为鱼皮质量(g)。
1.2.4 胶原蛋白结构间鉴定
1.2.4.1 紫外全波长扫描 分别取适量干燥的4种胶原蛋白样品溶于0.5 mol·L-1的冰乙酸溶液中,配制成1.0 g·L-1的胶原蛋白溶液,以0.5 mol·L-1的醋酸溶液作空白对照。在200~400 nm近紫外光区对胶原蛋白溶液进行扫描,分辨率为0.5 nm。
1.2.4.2 傅里叶变换红外光谱扫描 分别取适量干燥的4种样品与干燥的KBr于玛瑙研钵中研磨均匀,装样,手动压片,取出样品迅速小心放入样品室,用Thermo Scientific Nicolet iS5红外光谱仪在4 000~500 cm-1范围内进行检测,分辨率为0.5 cm-1[12]。
1.2.4.3 氨基酸组成分析 采用GB 5009.124—2016[13]的方法处理胶原蛋白样品,测定样品中氨基酸含量。氨基酸自动分析仪条件:色谱柱4.6 mm×60 mm,分离树脂为阳离子交换树脂,柱温度57 ℃,检测波长为570 nm,1通道缓冲溶液流速0.40 mL·min-1,反应液为茚三酮试剂,2通道反应液流速0.35 mL·min-1,进样量为20 μL[14]。
1.2.5 胶原蛋白性质测定
1.2.5.1 溶解度 取一定量的胶原蛋白溶于0.5 mol·L-1乙酸溶液中,配制成3 g·L-1的胶原蛋白溶液。取5 mL胶原蛋白溶液,加入5 mL不同质量浓度的NaCl溶液,使最终胶原蛋白溶液中NaCl质量浓度分别为0、10、20、30、40、50、60、80、100 g·L-1。将胶原蛋白溶液搅拌1 h,10 000 r·min-1离心20 min,取上清液,采用福林酚法测定胶原蛋白含量[15]。相对溶解度为上清液中蛋白含量与上清液中最高蛋白含量之比。
1.2.5.2 胶原蛋白的吸水性和吸油性[16]称取0.25 g样品与4 mL水于10 mL离心管中,涡旋快速混合30 s后,室温静置30 min,以5 000 r·min-1的转速离心30 min。按下列公式计算吸水性:
吸水性(mL·g-1)=(4-VW)/0.25
式中:VW指上清液体积。
称取0.25 g样品与4 mL大豆油于10 mL离心管中,涡旋快速混合30 s后,室温静置30 min,以5 000 r·min-1的转速离心30 min,记录上清液体积V0。按下列公式计算吸油性:
吸油性(mL·g-1)=(4-V0)/0.25
式中:V0指上清液体积。
1.2.5.3 胶原蛋白的持水性 持水性是指蛋白质保持水分的能力。取10 mL 10 g·L-1胶原蛋白溶液于培养皿中,置于37 ℃的恒温培养箱中温浴,在120 min内每隔20 min测量一次保留水与最初水分的比例。持水性按下式计算:
持水性(%)=(m1/m0)×100
式中:m1为胶原蛋白保留水量(g);m0为最初水分质量(g)。
1.2.5.4 胶原蛋白的乳化性[16]称取1 g样品溶于50 mL蒸馏水中,调节pH值为7。再加入50 mL大豆油,均质2 min,取50 mL混合液转移到50 mL刻度离心管,将离心管中样品溶液在1 500 r·min-1的速度下离心5 min,以乳化层体积占总体积的比例计算乳化性。
1.2.5 数据统计与分析 每次试验均重复3次,采用Excel 2003作图,采用SPSS statistics 16.0进行数据统计分析,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 不同制备方法得到的胶原蛋白得率的比较
羟脯氨酸是胶原蛋白的特征氨基酸,所以通过测定羟脯氨酸含量计算胶原蛋白得率。羟脯氨酸质量分数作为横坐标,吸光度设置成纵坐标绘制标准曲线。得到标准曲线的回归方程为y=0.170 8x-0.004 8,R2=0.998 4。根据得率计算公式计算各提取方法中胶原蛋白的含量。图1显示了发酵法、酸法、热水法、碱法制备的胶原蛋白得率,依次分别为(87.13±5.94)% >(79.62±4.45)% >(71.95±7.62)% >(54.88±5.80)%。发酵法和酸法得率较高,且发酵法显著高于热水法和碱法(P<0.05)。
2.2 不同制备方法得到的胶原蛋白的紫外光谱分析
4种胶原蛋白样品的紫外光谱如图2所示,4种胶原蛋白均在230 nm波长处有明显的吸收峰,酸法、热水法、发酵法制备的胶原蛋白吸收峰形态比较均一,而碱法制得的胶原蛋白在280 nm左右存在一个比较明显的吸收峰。

注:不同的小写字母表示存在显著性差异,P<0.05。

图2 不同方法制备的胶原蛋白的紫外光谱
2.3 不同制备方法得到的胶原蛋白的傅里叶变换红外光谱扫描结果
由图3所示,热水法、碱法、酸法和发酵法胶原蛋白样品分别在3 324 cm-1、3 305 cm-1、3 318 cm-1和3 306 cm-1处有强吸收,符合酰胺A的特征吸收。热水法、酸法、发酵法胶原蛋白样品的酰胺B吸收峰均位于2 937 cm-1处,碱溶性胶原蛋白的吸收峰位于2 961 cm-1。酸法和发酵法提取的胶原蛋白的酰胺Ⅰ的吸收峰均位于1 656 cm-1处,碱溶性胶原蛋白的酰胺Ⅰ的吸收峰位于1 655 cm-1,水溶性胶原蛋白的酰胺Ⅰ的吸收峰位于1 651 cm-1。热水法、碱法、酸法和发酵法样品酰胺Ⅱ带的吸收峰分别位于1 536 cm-1、1 542 cm-1、1 539 cm-1和1 540 cm-1。热水法、酸法和发酵法三者的酰胺III带均于1 239 cm-1存在明显的吸收峰,碱法于1 241 cm-1存在明显的吸收峰。

图3 不同方法制备的胶原蛋白的红外光谱
酰胺A表明鱼皮胶原蛋白肽链间存在氢键,且发酵法和碱法提取物有更多的N-H基团参与氢键的形成;酰胺B吸收峰体现胶原蛋白分子与其他一般蛋白质分子的特异性;酰胺Ⅰ带是胶原蛋白分子二级结构的特征吸收;酰胺Ⅱ带是C-N伸缩振动与胶原蛋白N-H弯曲振动的反映,也说明发酵法和碱法提取的胶原蛋白的3条α-肽链结合得更紧密。酰胺Ⅲ吸收峰的存在可以表明胶原蛋白的三维螺旋结构能够保持完整[17-18]。因此,红外图谱说明了这4种方法制备的胶原蛋白具有完整的三螺旋结构,且在二级结构上不存在较大差异。
2.4 不同制备方法得到的胶原蛋白氨基酸组成分析
氨基酸组成方面,胶原蛋白均富含甘氨酸、脯氨酸和羟脯氨酸,这是由于胶原蛋白多肽链很长的区段序列是由(-Gly-X-Y-)氨基酸序列重复而成。其中,羟脯氨酸作为胶原蛋白中的特征氨基酸,可促进胶原蛋白α链间氢键的形成,它在胶原蛋白分子3级结构的稳定性中起到非常重要作用[19]。
由表1可知,4种方法制备的样品均具有天然胶原蛋白的特征组成氨基酸,检测得到的17种氨基酸中甘氨酸含量最高,亚氨基酸脯氨酸和羟脯氨酸的含量20%左右,它们是组成胶原蛋白的特征氨基酸。在其他氨基酸中,酪氨酸、甲硫氨酸、苯丙氨酸的含量相对较低。而碱法制备的胶原蛋白氨基酸组成与其他3种样品在氨基酸组成上存在较大差异。其中甘氨酸、精氨酸含量低于其他3种样品,而芳香族氨基酸酪氨酸和苯丙氨酸含量较高。
2.5 不同制备方法得到的胶原蛋白的溶解性
由图4可知,4种方法制备的胶原蛋白的溶解性在NaCl质量浓度由20 g·L-1升高到40 g·L-1时,溶解性显著降低(P<0.05)。当NaCl的质量质量浓度相同时,样品溶解性从大到小排序为:发酵法>碱法>酸法>热水法。其中,发酵法样品在40 g·L-1到100 g·L-1范围时,溶解性均大于40%。

表1 不同方法制备的胶原蛋白氨基酸组成Table 1 Amino acid composition of collagen extracted by different methods %

图4 NaCl质量浓度对胶原蛋白溶解性的影响
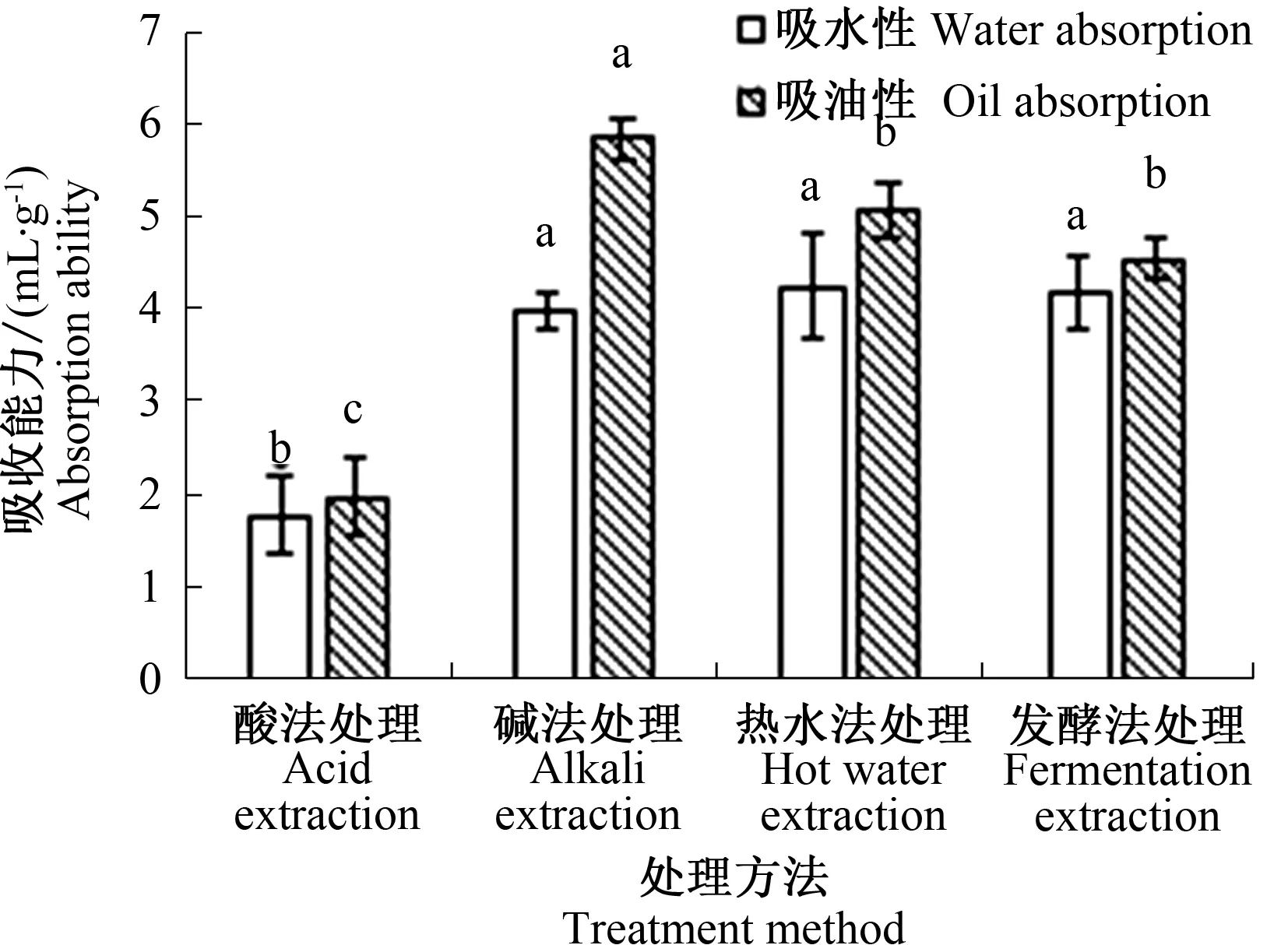
2.6 不同制备方法得到的胶原蛋白的吸水性和吸油性
4种方法提取的胶原蛋白吸水性和吸油性结果如图5所示。4种方法制备的胶原蛋白均具有一定的吸水性和吸油性。其中,碱法提取得到的胶原蛋白的具有最高的吸油性,酸法提取制备的胶原蛋白吸水性显著低于其他3种(P<0.05)。
2.7 不同制备方法得到的胶原蛋白的持水性
由图6可知,随着时间的延长,胶原蛋白持水性均有所下降。140 min时,发酵法提取所得胶原蛋白持水性最好,仍可以达到(62.71±5.14)%,其次是碱法、酸法。热水法制备的胶原蛋白持水性最差,只有(51.94±4.78)%。
注:不同的小写字母表示吸水性/吸油性之间存在显著性差异,P<0.05
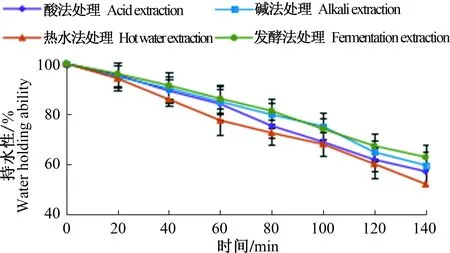
图6 不同方法制备的胶原蛋白的持水性比较
2.8 不同制备方法得到的胶原蛋白的乳化性
4种方法提取的胶原蛋白均具有一定的乳化性。由图7可以看出,乳化性从大到小依次分别是发酵法、热水法、碱法和酸法提取的胶原蛋白,分别为(66.25±3.31)%、(60.38±3.44)%、(55.83±3.15)%和(55.14±8.68)%。其中发酵法乳化性最强,且与酸法和碱法比较存在显著性差异(P<0.05)。

注:不同的小写字母表示存在显著性差异,P<0.05。
3 结论与讨论
目前制备胶原蛋白的原料主要是陆生哺乳动物,如牛、猪的骨和皮,但是由于疯牛病、口蹄疫等疾病的爆发,人们对这些陆生哺乳动物制成的胶原蛋白的安全性产生了疑虑;同时,由于宗教方面的原因,一部分人排斥或拒绝使用从猪身上获得的胶原产品,这使得传统来源胶原蛋白的应用受到限制。鱼类胶原蛋白以Ⅰ型胶原蛋白为主,具有较高的分散性、凝胶性、黏度、吸水性、持水性以及乳化性等特点,具有较高的抗压强度,可以作为一种安全的美容护肤材料和食品功能配料[20]。
本研究分别采用酸法、碱法、微生物发酵法和热水法提取罗非鱼鱼皮胶原蛋白,并比较了各方法提取的胶原蛋白的结构特性。紫外光谱表明4种提取方法得到的胶原蛋白在230 nm波长处有明显的吸收峰,这与胶原蛋白的紫外吸收特征一致。酸法和发酵法提取对胶原蛋白螺旋结构影响最小,因此胶原蛋白得率高;碱法提取胶原蛋白时会破坏氨基酸,碱法得到的胶原蛋白在240~280 nm处有明显的吸收峰,说明提取的胶原蛋白纯度低,氨基酸测定的结果发现,碱法提取的酪氨酸和苯丙氨酸含量最高,与文中紫外吸收测定情况相符合。微生物发酵法提取成本低、效率高,而且得率高,具有一定优势,曹梦霞等[21]利用混合微生物发酵,对鳕鱼皮胶原蛋白进行水解制备鱼皮多肽,同时祛除鱼腥味,大大提高了原料鱼的利用率。马丽杰等[22]采用微生物发酵法制备鱼皮胶原蛋白,并进行复合发酵以研究脱腥工艺,以水解度和感官腥味为指标,得到了最佳发酵菌种组合及发酵条件,但缺少了对产物结构和性质方面的测定。而本研究采用的发酵工艺得率较高,胶原蛋白结构完整,性质优良,可以为工业生产提供参考。
由于存在盐析效应,NaCl的质量浓度对胶原蛋白的溶解性有较大影响。4种提取方法得到的溶解性变化趋势比较一致,这与陈丽丽等[19]的研究结论一致。相比其他3种方法,发酵法制得的胶原蛋白具有较高的溶解性,这可能与经过发酵后胶原蛋白的相对分子质量降低有关,后续将对制备的胶原蛋白的相对分子质量分布情况和相关的活性功能进行进一步的研究。
蛋白质对油脂的吸附有一定作用。4种方法制备的胶原蛋白吸油性均大于吸水性,说明胶原蛋白的疏水基团含量高于亲水基团含量[23],而吸油性强的胶原蛋白可用于需要保留油脂的奶制品、肉制品等食品中[24]。蛋白质的持水能力受蛋白浓度、离子强度、相对湿度与温度等环境因素的影响很大。持水性测定结果表明,发酵法制备的胶原蛋白具有较好的持水性和乳化性,可以应用于化妆品保湿、乳化剂制作人造奶油,也可以作为稳定剂加入酸奶和乳酪中,降低脱水收缩作用等。
本研究发现微生物发酵法制备胶原蛋白的得率最高,4种方法制备的胶原蛋白均具有完整的三螺旋结构,发酵法、酸法和热水法胶原蛋白样品纯度较高,氨基酸组成相似,且发酵法制备的胶原蛋白吸油性大于吸水性,并具有较高的溶解性、持水性和乳化性。微生物发酵法作为一种较为新颖的胶原蛋白提取技术,值得大规模工业生产和多领域应用。

