电化学氧化法处理四氧化三锰生产废水中的氨氮
姜智超,杨国超,刘 孟
(长沙矿冶研究院有限责任公司,湖南长沙410012)
四氧化三锰是生产软磁铁氧体的主要原材料,我国现有的四氧化三锰生产工艺90%以上采用电解金属锰悬浮氧化法,生产1 t四氧化三锰消耗水量5~20 t,其中的氨氮质量浓度达 200~500 mg/L〔1〕。 在一定条件下,废水中的氨氮能够被转化为毒害性较大的硝态氮、亚硝态氮等,易对人体及水中生物产生一定毒害作用〔2〕。由于中低质量浓度氨氮废水(50~500 mg/L)自身水质特点以及传统处理工艺的局限性,造成该类废水处理成本和处理难度均较大〔3〕。
常见的中低浓度氨氮废水处理方法有高级氧化法〔4〕、生物膜法〔5〕、化学沉淀法〔6〕、吹脱法〔7〕、吸附法〔8〕、离子交换法〔9〕等。 电化学氧化法因在处理中低浓度氨氮废水方面具有可控性强、设备占地面积小、无二次污染等特点近年来被广泛应用〔10-13〕,但却鲜有关于电化学氧化法处理四氧化三锰生产废水中氨氮的研究报道。为此,本研究采用电化学氧化法对四氧化三锰生产废水中的氨氮进行处理,通过批实验考察了电化学氧化过程对废水中氨氮的氧化性能,并对相关氧化机制进行了讨论,以期为应用电化学氧化技术去除四氧化三锰生产废水中的氨氮提供参考。
1 实验部分
1.1 实验材料
试剂药品:氯化钠、氢氧化钠,西陇化工股份有限公司,分析纯;硫酸,株洲市星空化玻有限责任公司,分析纯。实验用水均为去离子水。
废水:四氧化三锰生产废水取自湖南某四氧化三锰生产企业,该初始废水中锰离子含量较高,企业采用液碱沉淀、絮凝剂絮凝的方法回收金属离子,经该工序处理后,废水中金属离子含量、COD、SS均较低,NH3-N、TN含量较高,超过《无机化学工业污染物排放标准》(GB 31573—2015)直接排放限值。处理后的废水 pH=9.85,NH3-N、TN、Mn2+、SS、COD 分别为 220、223、0.85、8.80、38.3 mg/L,Cl-1.02 g/L,SO42-未检出。
1.2 实验装置
实验装置主要由直流电源、电解槽、电极板、蠕动泵、储水容器等组成。阳极板选用钛镀钌铱(100 mm×100 mm)、阴极板选用网状(3.0 mm×3.0 mm网孔)钛金属(100 mm×100 mm,宝鸡昌立特种金属有限公司)。直流稳压电源(DH171A-5,北京大华无线电仪器厂)用来提供持续稳定的直流电流。图1为实验装置示意图。
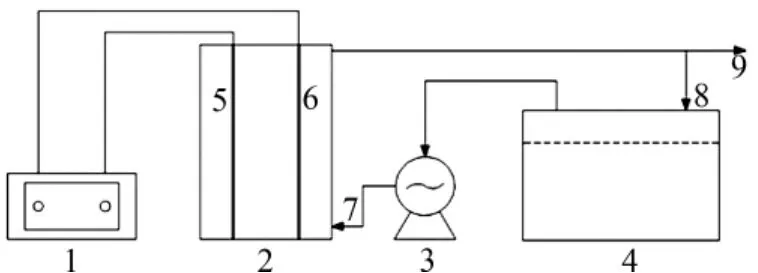
图1 实验装置
1.3 实验设计
1.3.1 电化学氧化处理氨氮批实验
取500 mL处理后的生产废水若干份,用硫酸或氢氧化钠溶液调节pH,用氯化钠调节废水中氯离子浓度,设计不同初始pH、电流密度、氯离子浓度、极板间距条件下四氧化三锰生产废水中氨氮去除实验,分别于 15、30、45、60、90、120 min 时取样测定氨氮、总氮含量。
1.3.2 间歇、循环、连续进水优化效果对比
在电化学氧化处理氨氮的最佳实验条件下,分别采用间歇、循环、连续进水方式进行废水中氨氮去除效果对比实验。其中间歇进水是指将一定体积废水加入电解槽中;循环进水是指废水由进水口泵入电解槽,由出水口1返回储水容器;连续进水是指废水由进水口泵入电解槽,由出水口2流出。所有实验每个处理均设3个重复,取平均值。
1.4 样品测定与数据分析
废水pH采用pH计(pHS-3C,上海仪电科学仪器股份有限公司)测定,氨氮含量采用纳氏试剂光度法测定,总氮含量采用碱性过硫酸钾消解紫外分光光度法测定。数据处理由Origin Pro 2016软件完成。
1.5 反应机理
氨氮电化学氧化机理主要分为直接氧化理论和间接氧化理论。直接氧化时,氨氮在铂、铱等电极表面发生氨氮连续脱氨及中间产物形成等一系列复杂的多步反应过程〔14〕;间接氧化时,氯离子在阳极上被氧化为游离氯,游离氯溶解在水溶液中形成活性氯并将氨氮氧化为氮气去除〔15〕。
2 结果与讨论
2.1 初始pH对氨氮电化学氧化的影响
在电流密度12 mA/cm2,氯离子质量浓度1.0 g/L,极板间距5.0 mm,初始pH依次为5、7、9、11条件下,考察初始pH对氨氮去除的影响,结果见图2。
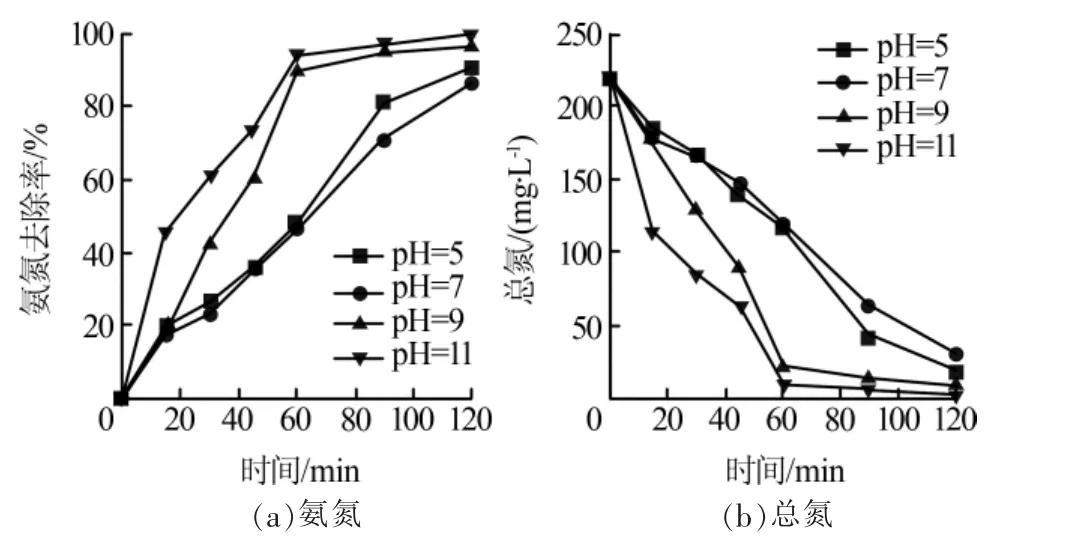
图2 初始pH对氨氮、总氮去除的影响
由图2可知,碱性条件下废水中氨氮去除率高于酸性条件下,弱酸性条件下氨氮去除率高于中性条件下。当初始pH分别为9、11时,相同反应时间内氨氮去除率分别为96.8%、99.5%,总氮质量浓度依次降至8.27、2.33 mg/L。酸性条件下,一方面阳极析出的氯气易逸出,造成氨氮降解量较低,另一方面溶液中氨氮主要以NH4+形态为主,难以氧化;弱碱性条件下,阳极产生的氯气在溶液中溶解度增大,体系中氯离子形成Cl-—Cl2—ClO-—Cl-氧化还原循环,氨氮去除率随之增大〔16〕。当初始pH为11时,一方面次氯酸根离子发生还原反应和副反应生成活性物质减少,电化学氧化作用下氨氮去除率降低;另一方面,强碱性条件下氨氮主要以NH3形式存在,逸出占主要作用,因此去除率反而有所升高〔17-18〕。这与前期报道的弱碱性条件下电化学氧化处理氨氮效果最佳的结果相一致〔19〕。
2.2 电流密度对氨氮电化学氧化的影响
在初始pH=9,氯离子质量浓度1.0 g/L,极板间距 5.0 mm,电流密度依次为 4、8、12、16 mA/cm2条件下,考察电流密度对氨氮去除的影响,结果见图3。
由图3可知,随着电解时间延长,不同电流密度条件下氨氮含量均呈下降趋势。同一反应时间条件下,氨氮去除率随电流密度增大而增加。当电流密度为12 mA/cm2时,氨氮去除率为95.8%,氨氮及总氮质量浓度分别降至9.32、8.00 mg/L,继续增大电流密度,氨氮去除率略有上升;当电流密度为16 mA/cm2时,相同反应时间内总氮去除率略低于氨氮去除率,这可能是因为高电流密度虽然能够提高氯气或次氯酸根生成量,但此时氨氮易被氧化为硝酸根离子〔20〕。弱碱性含氯体系中,电化学氧化氨氮过程以间接氧化为主,增大电流密度能够提高电子迁移转化速率,促使中间产物次氯酸或次氯酸根离子生成,提高氨氮去除率〔11〕。但电流密度过高易导致阳极发生析氧副反应,增加能耗〔21〕。

图3 电流密度对氨氮、总氮去除的影响
2.3 氯离子浓度对氨氮电化学氧化的影响
在初始pH=9,电流密度12 mA/cm2,极板间距5.0 mm,氯离子质量浓度依次为 1.0、2.0、3.0、4.0 g/L条件下,考察氯离子浓度对氨氮去除的影响,结果见图4。

图4 氯离子浓度对氨氮、总氮去除的影响
由图4可知,氨氮去除率随氯离子浓度增大而增加。当氯离子质量浓度为1.0 g/L时,反应120 min后氨氮去除率为96.8%,之后随着废水中氯离子浓度增大,氨氮去除率逐渐增加。氯离子浓度是次氯酸形成的重要因素,溶液中有氯离子存在时,电解过程中氯离子优先在阳极放电被氧化为氯气,进而水解形成次氯酸和次氯酸根离子〔22〕。如式(1)~式(4)所示,次氯酸及次氯酸根离子氧化电位较高,能够将氨氮氧化为氮气或硝酸根离子,硝酸根离子在阴极能够被还原为亚硝酸根离子、氮气或氨氮〔23〕,但在次氯酸存在情况下,亚硝酸根离子及氨氮能够很快被再次氧化〔24-25〕。实验过程中总氮的测定结果也表明,几乎没有硝酸根或亚硝酸根残留。这与前期报道的电化学氧化过程中氯离子浓度越高,氨氮去除效果越好的结果相一致〔26-27〕。
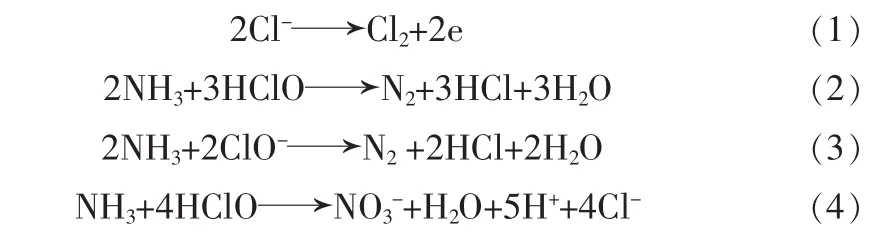
2.4 极板间距对氨氮电化学氧化的影响
在初始pH=9,电流密度12 mA/cm2,氯离子质量浓度1.0 g/L,反应时间120 min,极板间距依次为2.0、5.0、10.0、15.0、20.0 mm 条件下, 考察极板间距对氨氮去除的影响,结果见表1。

表1 极板间距对氨氮、总氮去除的影响
由表1可知,极板间距对氨氮去除率影响较小。氨氮电解能耗随极板间距的增大呈先降后升趋势,当极板间距为5.0 mm时,电解能耗最低,为53.6 kW·h/kg。极板间距过小,电极表面易钝化,导致能耗增加、电解效率降低;极板间距过大,电极之间电阻增大、电压升高,能耗随之增加〔28〕。这与前期报道的极板间距过大或过小均能导致氨氮处理能耗增加的结果相一致〔29〕。
2.5 间歇、循环、连续进水优化效果对比
在初始pH=9、电流密度12 mA/cm2、氯离子质量浓度1.0 g/L、极板间距5.0 mm、反应时间120 min的最优条件下,考察电化学氧化过程中不同进水方式对氨氮处理效果的影响,结果见表2。

表2 进水方式对氨氮、总氮去除的影响
由表2可知,3种进水方式中,间歇进水时氨氮处理效果最好,反应120 min后氨氮去除率为96.8%,循环进水和连续进水时氨氮去除率分别为95.2%和93.4%,且间歇进水时氨氮处理能耗较循环进水和连续进水时分别降低了4.68%、20.2%。间歇进水时,废水在电解槽中反应更为充分,且只有电解过程耗能,因此处理效果优于循环进水和连续进水。
3 结论
(1)采用电化学氧化法处理四氧化三锰生产废水中的氨氮,当废水初始pH=9、电流密度12 mA/cm2、氯离子质量浓度1.0 g/L、极板间距5.0 mm时,反应120 min后废水中氨氮去除率为96.8%,处理后氨氮、总氮质量浓度分别由220、223 mg/L降至7.04、7.03 mg/L,达到《无机化学工业污染物排放标准》(GB 31573—2015)直接排放标准,有望应用于四氧化三锰生产废水中氨氮的工业污染治理。
(2)弱碱性条件下氨氮去除率随电流密度、氯离子浓度的增大而增加。对比电化学氧化过程中不同进水方式对氨氮去除效果的影响,发现间歇进水时氨氮去除率最高,且其氨氮处理能耗较循环进水和连续进水时分别降低了4.68%、20.2%。

