替罗非班在急性颅内大血管闭塞血管内治疗中应用的安全性分析
周腾飞 朱良付 李天晓 李钊硕 李强 吴立恒 管民 周志龙 贺迎坤 刘焕焕
随着数个大型临床试验结果的发布[1-5],使用新一代可回收支架的血管内机械再通治疗成为治疗急性缺血性脑卒中的首选治疗方案,越来越多地应用于大血管闭塞性脑卒中的治疗。然而,大血管机械开通存在一系列的问题,如早期再闭塞、远端血栓形成等,另外,对于可回收取栓装置治疗效果欠佳的患者,往往需要支架置入补救治疗,这类情况的发生往往需要给予术中抗血小板治疗。
替罗非班是一种可逆性的非肽类血小板GP[1]Ⅱb/Ⅲa受体拮抗剂,通过阻止纤维蛋白原与GPⅡb/Ⅲa受体结合,从而阻断血小板的交联及血小板的聚集。相比传统的药物具有起效迅速、效果显著以及半衰期较短的特点,因此特别适用于对急性期血栓形成的治疗中。临床指南在静脉溶栓后24 h内不推荐使用抗血小板药物治疗[6],部分研究将替罗非班合并溶栓药物对患者进行静脉内溶栓治疗[7],具有提高再通率、降低卒中再发风险的作用,同时没有增加出血风险。对于颅内大血管闭塞性脑卒中血管内再通治疗合并使用替罗非班的安全性尚未可知,部分小样本临床研究结果不一[8-9],临床指南对其应用的具体适应症及使用方法缺乏相关指导。本研究旨在探讨抗血小板药物替罗非班在血管内治疗过程中对再灌注后出血并发症的影响。
资料与方法
一、一般资料
连续纳入我中心2016年1月至2017年12月接受血管内再通治疗的急性颅内大血管闭塞性急性脑梗塞患者的相关资料进行分析,入组标准:(1)年龄≤80岁;(2)发病时间至手术时间前循环 <8 h,后循环 <24 h;(3)手术前经影像学检查(CT、MRI)排除颅内出血;(4)经血管影像学(CTA、MRA、DSA)证实颅内大血管闭塞;(5)患者NIHSS评分≥6分;(6)患者或家属知情同意。
排除标准:(1)有出血性脑血管病史或有出血倾向的患者;(2)6个月内有严重脑卒中史;(3)基于非增强CT的ASPECT<6分患者;(4)术前收缩压≥185 mmHg或舒张压≥110 mmHg;(5)基线NIHSS评分>30分患者;(6)排除已知非替罗非班因素导致的围手术期颅内出血;(7)术中使用了盐酸替罗非班以外的抗血小板药物。
二、治疗方法
血管内机械再通前,所有在静脉溶栓时间窗内符合静脉溶栓适应症的患者进行溶栓治疗,效果不佳的患者进行血管内机械再通治疗。所有的血管内再通治疗均在全麻或局麻下进行,全脑血管造影明确血管闭塞部位后,使用血管内治疗器材对患者进行机械再通治疗,所使用的血管内治疗方式包括Solitaire可回收支架取栓、血栓抽吸系统吸栓、球囊扩张、支架置入、动脉内溶栓。一般情况下先行造影术明确闭塞部位,根据闭塞部位长度、性质等判断选择治疗方式,当一种治疗方式效果欠佳时,考虑更换其他治疗方式,可同时联合两种治疗方式进行开通,对于存在串联性闭塞的患者,一般采用机械开通方式先开通近心端闭塞,后开通远心端闭塞血管。在选择球囊扩张术时,选择的球囊直径要略大于血管闭塞段,在选择支架的种类时,要求支架易达闭塞部位,支架直径略大于血管内径,长度大于闭塞段两端各5 mm,各器材操作过程均采用其标准治疗方式进行操作,治疗过程中全身肝素化。
三、替罗非班使用适应症及使用方法
使用适应症:(1)血管再通后出现急性期再闭塞或经评估存在潜在再闭塞风险;(2)再通术中出现栓子脱落远端或局部血栓再形成并发症;(3)行支架永久性置入的患者。
动脉内替罗非班使用方式:通过微导管将盐酸替罗非班注射入目标部位,根据具体造影评估结果选择注射剂量,注射剂量在6~10 μg/kg之间。
静脉内替罗非班使用方式:首次8 μg/kg负荷剂量静脉推注,3 min推注完毕,后给予静脉每分钟0.1 μg/kg维持至术后24 h,替罗非班停用前2 h给予负荷剂量氯吡格雷300 mg和肠溶阿司匹林100 mg或300 mg,同时替罗非班静脉维持剂量减半;术后2 d起每天给予常规剂量氯吡格雷75 mg和肠溶阿司匹林100 mg,行抗血小板聚集治疗。
四、疗效及随访
术后即刻脑血管造影进行脑血管再通评价,成功再通定义为脑梗死溶栓血流评分(thrombolysis in cerebral infarction,TICI)达到2 b或3级。术中栓塞并发症定义为脑血管造影下术中肉眼可视的栓子脱落远端或血栓形成。术后即刻、术后24 h以及48 h行头颅CT检查,明确颅内出血情况,颅内出血分级按照以下分级标准进行分级:HI1型-梗塞区域边界处有小的瘀点样出血,PI2型-梗塞区域内由聚集性的淤点样出血,PH1型-不超过梗塞面积30%的团块样出血,PH2型-超过梗塞面积30%,较浓密的团块样出血[10]。症状性出血转化定义为任何形式的颅内出血且较基线NIHSS评分增加≥4分。术后3个月随访患者改良Rankin量表(modifed Rankin Score,mRS)评分和3个月死亡率。
五、统计学分析
应用SPSS 22.0软件进行统计学分析,正态分布的计量资料以±s 表示,计量资料数据差异显著性检验采用方差分析,P<0.05为差异有统计学意义。
结 果
共计纳入患者173例,其中男性112例,女性61例,平均年龄61±13岁,前循环闭塞患者123例,后循环闭塞56例,术中使用替罗非班患者共计87例,其中静脉途径64例,动脉途径15例,动静脉联合途径8例,术中未使用替罗非班的患者为86例。两组患者在年龄未见差异,替罗非班组在男性性别、高血压、糖尿病、高血脂症、后循环比例高于非替罗非班组,其中糖尿病存在有显著性差异(24.14%vs 10.47%,P=0.026),在替罗非班组中后循环比例显著高于非替罗非班组(39.08% vs 25.58%,P=0.034),非替罗非班组中房颤比例显著高于替罗非班组(P<0.001)。两组基线NIHSS评分未显示出差异 。
两组患者术前接受静脉溶栓的比例未见差异(P=0.736),首次使用可回收支架取栓的比例达到91.33%(158/173),32.95%的患者接受了永久性支架置入治疗,替罗非班组行支架置入治疗的比例显著高于非替罗非班组(P<0.001)。患者总体成功再通率为88.44%,两组再通率相比未见差异(P=0.254)。术中14例患者发生术中栓塞事件(8.09%),两组总体出血率未见差异(28.48% vs 27.59%,P=0.620),各种亚型的出血率未见差异,两组症状性出血率差异无统计学意义(P=0.339)。术后三个月随访两组预后良好的比例未见差异(P=0.448),随访期间患者死亡率也未见明显差异(P=0.729)。(表 1)
讨 论
急性颅内大血管闭塞患者血管再通后仍存在着一定的再闭塞风险,这可能和机械开通过程中器材对血管壁的损伤有关,激活体内凝血系统,导致患者再通后发生再闭塞,对再通治疗后合并原味狭窄的患者,其狭窄基础上容易形成新鲜血栓,从而导致血管急性期再闭塞,既往研究显示血管早期在再闭塞风险在22%~34%之间[11],一系列报道应用替罗非班治疗血管再闭塞,取得了良好的效果[12-13]。在取栓过程中会发生成千上万的血栓形成,但因为组织较小所以很难观察得到,部分大的血栓形成的时候将造成远端栓塞,严重者将影响患者预后,远端栓塞患者难以使用取栓器材解除栓塞,使用抗血小板药物对这类并发症可以起到较好的效果,本组中对部分早期再闭塞及血栓形成患者围手术期使用盐酸替罗非班治疗取得了较好的效果。
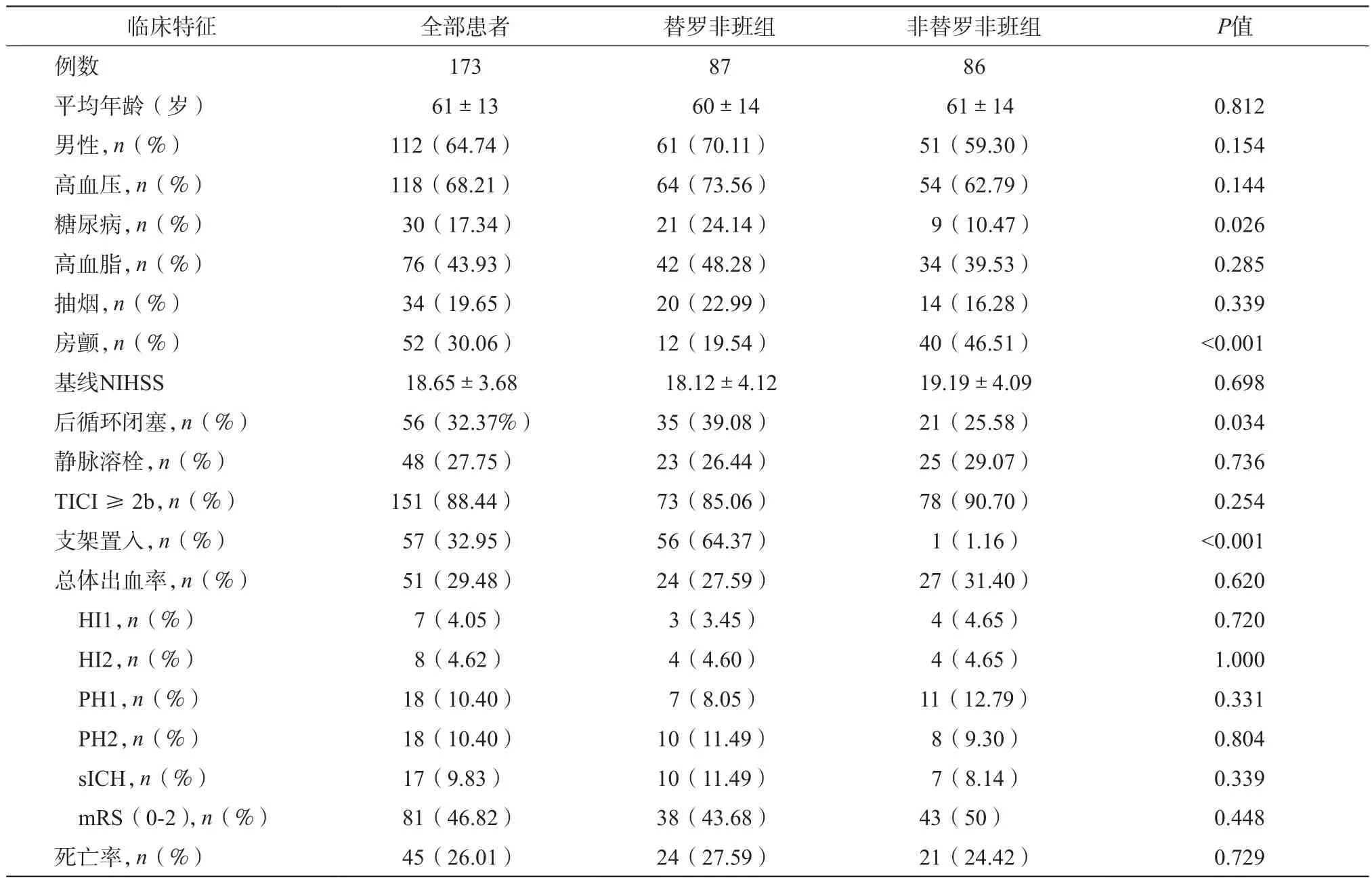
表1 入组患者临床基线特点及围手术期相关信息
本组患者中大部分患者使用了可回收支架作为首选治疗措施进行大血管闭塞开通治疗,相比于房颤引起的栓塞性大血管闭塞,在动脉性硬化基础上导致大血管闭塞对可回收取栓装置反应欠佳[14],其合并的原位狭窄往往需要支架置入作为进一步治疗措施,另外取栓后残余狭窄有着较高的再闭塞风险,因此这类患者术中应用抗血小板的比例较高。而对于房颤引起的栓塞性大血管闭塞,依靠单纯的取栓装置大多能够实现成功再通,因此非替罗非班组中房颤患者比例较高,而替罗非班组中动脉硬化性大血管闭塞性比例相对较高,因此该组中相关动脉硬化性高危因素如高血压、糖尿病、抽烟等比例也较非替罗非班组高[15]。本研究中替罗非班组相比非替罗非班组其后循环闭塞所占比例较高,相比前循环闭塞,后循环大血管闭塞患者其由动脉硬化基础上导致的闭塞比例较高,其后循环开通过程中使用支架置入比例较高,因此后循环动脉开通治疗中应用抗血小板的比例较高。
因其较高的出血风险,静脉溶栓后早期不推荐使用抗血小板药物治疗,然而将替罗非班合并溶栓药物对患者进行静脉内溶栓治疗,研究结果显示并没有增加出血风险[7,9]。另有一些研究显示在静脉溶栓后早期使用抗血小板药物也是安全的,同时可能提高再通率、降低卒中再发风险等[16]。部分将盐酸替罗非班用于血管内再通治疗的回顾性研究显示,血管内机械再通过程中合并替罗非班可以减少患者早期再闭塞,提高患者血管再通的疗效,结果显示并未增加颅内出血风险。然而,也有相关研究显示,替罗非班在血管内再通治疗联合应用时可能存在增加患者颅内出血的风险,影响患者改善预后[8]。梗塞脑组织急性期再灌注后,脑组织保护屏障将受到一定程度的受损,部分梗塞面积较大、血脑屏障受损严重的易发生出血并发症,而抗血小板药物可能并不会直接导致血脑屏障的破坏,但对于一些存在微出血或者较轻类型的出血患者,抗血小板药物可能会加重其出血程度。研究显示,对于围手术期使用抗血小板药物的患者,患者的症状性出血率显著高于围手术期未使用抗血小板药物治疗的患者[17]。在本组患者中替罗非班组相比非替罗非班组其出血率并未增加,且两组症状性出血率未显示差异。
我们的分析显示,机械开通术中合并使用替罗非班并未增加患者出血风险,但本研究属于回顾性研究,具有非随机性的缺点,两组入组基线特点存在差异,替罗非班应用适应症并不统一。未来能否将替罗非班常规应用于大血管闭塞血管内再通治疗,有待进一步评估。

