糖尿病视网膜病变患者泪膜脂质层厚度与黄斑微血管改变的相关性
郭建新,韩佳欣,李明新,王 贺
0 引言
干眼是普通人群中最常见的眼部疾病,可导致干燥、刺激、异物感等眼部不适,干扰日常生活,是一个严重的公共卫生问题[1]。干眼的确切发病机制尚未完全明确。2017年国际泪膜与眼表协会将干眼定义为以泪膜稳态失衡为主要特征并伴有眼部不适症状的多因素眼表疾病,强调泪膜稳定性在干眼诊疗中的关键地位[2]。泪膜脂质层主要由睑板腺分泌,脂质层退化使眼表稳定性降低,进而导致干眼[3-4]。
糖尿病已被证实与多种眼部慢性疾病有关。我国糖尿病发病率逐年升高,已经成为威胁人民身体健康的第三大疾病,有报道称每年新发人数递增100万人,到2020年将达到1亿人,糖尿病患者眼病发病率约90%,其中干眼症的发病率约为70.77%[5]。糖尿病患者角膜敏感性的降低、反射性泪液分泌的减少以及高糖刺激导致的眼表炎症可促进干眼的发展。有研究表明,糖尿病合并干眼症的发生与眼底病变程度有关[6],但其发病后的特征与眼底改变是否具有相关性尚未明确,与正常人相比,糖尿病患者泪膜脂质层厚度的监测也缺乏相关的对照研究。借助Lipiview眼表面干涉仪及OCT血流成像(optical coherence tomography angiography,OCTA)技术,本研究将系统观察糖尿病视网膜病变(DR)患者泪膜脂质层厚度(lipid layer thickness,LLT)与黄斑微血管改变的特点,了解糖尿病患者泪膜损伤的临床特征。
1 对象和方法
1.1对象选取2018-01/12就诊于我院内分泌科,血糖控制平稳,并经眼科医师确诊的2型糖尿病合并非增生期糖尿病视网膜病变(NPDR)患者60例60眼(双眼患者使用简单随机抽样法选取一眼数据进行分析),其中男37例,女23例;年龄49~68(平均57.54±6.18)岁;糖尿病病程5~20(平均11.93±4.53)a;糖化血红蛋白(HbA1c)4.5%~8.0%,平均(6.2±1.3)%。选取同期确诊的2型糖尿病合并增生期糖尿病视网膜病变(PDR)患者60例60眼(双眼患者使用简单随机抽样法选取一眼数据进行分析),其中男35例,女25例;年龄53~71(平均57.39±10.42)岁;糖尿病病程6~22(平均12.24±5.23)a;HbA1c 4.6%~8.2%,平均(6.4±1.5)%。另选取年龄、性别相匹配的健康志愿者60例60眼(使用简单随机抽样法选取一眼数据进行分析)作为正常对照组,其中男38例,女22例;年龄45~73(平均55.24±5.78)岁;HbA1c 4.4%~6.3%,平均(5.3±0.8)%。三组受检者年龄、性别、糖化血红蛋水平,NPDR组与PDR组患者糖尿病病程差异均无统计学意义(P>0.05),见表1。本研究经徐州医科大学伦理委员会批准(批件号:XYFY2018-KL033-01),于中国临床试验注册中心注册(注册号:ChiCTR1900021243)。受试者均签署知情同意书,受试者、项目参与人员仔细阅读知情同意书后,签名并注明日期。
1.1.1纳入标准(1)DR的诊断以眼底荧光素血管造影(FFA)为基础,符合2014年我国DR临床诊疗指南中的分期标准[7];(2)糖尿病的诊断符合1999年世界卫生组织糖尿病和糖尿病前期诊断标准。
1.1.2排除标准(1)玻璃体积血;(2)糖尿病黄斑水肿;(3)合并玻璃体视网膜界面疾病如玻璃体黄斑牵拉综合征、特发性黄斑前膜等,以及视神经相关疾病者;(4)合并视网膜脉络膜炎、葡萄膜炎者;(5)既往有玻璃体切割、视网膜激光光凝或玻璃体腔抗血管内皮生长因子(VEGF)药物注射等手术史者;(6)患有其他可能导致黄斑结构形态学变化的疾病;(7)近1mo配戴角膜接触镜者;(8)近1mo患有各种原因引起的结膜炎、睑腺炎、睑缘炎、角膜炎、睑内翻、倒睫、眼睑闭合不全等可能影响泪液分泌的眼表疾病者;(9)泪道阻塞或慢性泪囊炎患者;(10)屈光介质不清影响观察者;(11)视力极差或眼球震颤、不能固视者;(12)全身状况不佳,合并糖尿病肾病者。
1.2方法所有受检者均行OCTA和Lipiview检查。(1)黄斑区OCTA检查:检查由同一名检查者独立完成。设备光源波长840nm,带宽45nm,轴向扫描分辨率70kHz,扫描范围3mm×3mm;每次扫描包含304条B扫描。单次OCTA图像采集包含1次水平扫描叠加1次垂直扫描,以去除眼球运动伪迹。图像信号强度>60。采用设备自带软件系统进行图像分析,系统将单次采集的数据自动合成为视网膜浅层毛细血管层(SCL)、视网膜深层毛细血管层(DCL),SCL为内界膜上3μm至内丛状层(IPL)下15μm,包含视神经纤维层和节细胞层;DCL为IPL下15~70μm,主要包含内核层。利用设备自带量化分析软件Angio Analytics分析SCL和DCL血管密度。同时观察黄斑中心凹无血管区面积(FAZ)完整性。(2)Lipiview检查:Lipiview眼表面干涉仪检查为非接触式检查,患者取坐位,下颌和前额紧贴支架。操作员调整患者眼位高度,使之对准检测探头。拍摄图像需20s,其间患者可以自然眨眼。检测结果以干涉色单位(interferometric color units,ICU)表示,1ICU约等于1nm,可代表LLT。
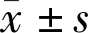
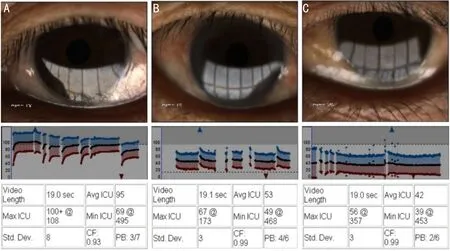
图1各组受检者泪膜脂质层厚度变化A:正常对照组,泪膜形态完好;B:NPDR组,泪膜变薄,LLT值下降;C:PDR组,泪膜稳定性明显降低。

表1 各组受检者基线资料比较
注:正常对照组:健康志愿者。
2 结果
2.1各组受检者泪膜脂质层厚度比较使用Lipiview眼表面干涉仪评估LLT,结果显示,正常对照组受检者泪膜形态完好,平均LLT为69.87±11.401nm;NPDR组患者平均LLT为54.87±7.453nm,干涉图可见泪膜颜色变暗,提示泪膜稳定性下降;PDR组患者平均LLT为42.67±5.246nm,泪膜脂质层更薄,且三组受检者LLT差异有统计学意义(F=131.790,P<0.01),各组之间两两比较差异均有统计学意义(t正常对照组 vs NPDR组=12.462,t正常对照组 vs PDR组=10.941,tNPDR组 vs PDR组=6.428,均P<0.05),见图1。
2.2各组受检者黄斑区微血管结构参数比较使用OCTA观察黄斑区微血管结构,结果显示,正常对照组受检者黄斑区血管密度均匀,拱环规则,无血管区面积较小;NPDR组患者黄斑区拱环欠规则,无血管区面积扩大,血管密度降低,可见片状视网膜无灌注区;PDR组患者黄斑区拱环失去正常环形结构,血管密度更加稀疏,无灌注区面积增大。三组受检者FAZ、SCL和DCL血管密度差异均有统计学意义(FFAZ=244.778,FSCL=65.426,FDCL=176.448,均P<0.01),见图2,表2。
2.3泪膜脂质层厚度与黄斑区微血管结构参数的相关性使用Pearson线性相关分析方法探讨LLT与FAZ、SCL和DCL血管密度的相关性,并绘制散点图。结果显示,正常对照组受检者LLT与FAZ、SCL和DCL血管密度均无相关性(rLLT/FAZ=-0.27,P=0.837;rLLT/SCL=-0.091,P=0.489;rLLT/DCL=0.227,P=0.082);NPDR组患者LLT与FAZ呈负相关关系(r=-0.922,P<0.01),与SCL血管密度呈正相关关系(r=0.798,P<0.01),与DCL血管密度无相关性(r=0.140,P=0.285);PDR组患者LLT与FAZ呈负相关关系(r=-0.923,P<0.01),与SCL血管密度呈正相关关系(r=0.902,P<0.01),与DCL血管密度无相关性(r=0.073,P=0.581),见图3。
3 讨论
国际糖尿病联合会的报告指出,目前我国是世界上糖尿病患病人数最多的国家,据统计,在20岁以上人群中,糖尿病的患病率高达9.7%[8]。糖尿病除可引起心脑血管疾病、糖尿病肾病、糖尿病神经病变外,尚可导致一系列眼部并发症,如DR、糖尿病相关白内障等,导致视力下降,甚至失明。近年研究表明,糖尿病同样是引起干眼发病的重要病因,但往往受到人们的忽视。一项为期10a,针对2766例糖尿病患者的随访调查结果显示,约50%糖尿病患者合并干眼[9],干眼的发病率与HbA1c水平和糖尿病病程密切相关[10-11],因此干眼国际诊疗指南已将糖尿病列为干眼发生的危险因素。
多种技术手段可用于观察泪膜脂质层,如使用色谱分析仪或光谱测定法测定泪液的化学成分及比例,但这些均是体外检测方法,影响因素较多,结果稳定性较差[12-13]。Lipiview脂质干涉成像仪采用白光干涉原理,通过镜面反射能够对泪膜进行干涉颜色评估,光源发出的光通过泪膜,再经过镜面反射到摄像头内,通过摄像镜头反射回的光形成干涉图样,称为“干涉图”。Lipiview干涉仪使用这些图像,可直接定量检测 LLT,自动分析LLT的分布情况(ICUmax或ICUmin),同时可记录眨眼的频率及不完全眨眼次数。Lipiview眼表面干涉仪是目前第一种可以在体检测LLT的仪器[14]。研究表明,LLT<60nm提示存在睑板腺功能障碍(MGD),LLT<75nm具有较高的诊断敏感性[15]。
图2各组受检者黄斑无血管区面积和视网膜血管密度的变化正常对照组受检者黄斑区拱环规则,无血管区面积较小;NPDR组患者黄斑区拱环欠规则,无血管区面积增大;PDR组患者无血管区面积更大,失去正常环形结构,血管密度更加稀疏,无灌注区数量增多。
表2 各组受检者FAZ、SCL和DCL血管密度参数比较
注:正常对照组:健康志愿者。
目前,FFA检查是诊断 DR并分级的“金标准”。FFA通过造影剂在血管中的流动显现血管形态,早期可看到针尖样的微血管瘤,提示 DR存在,随检查时间的推移高荧光病灶越发清晰,同时低荧光病灶对应无灌注区,提示视网膜处于缺血状态。但当出现大范围渗漏时,渗漏的高荧光常易遮盖视网膜无灌注区缺血病灶,影响疾病的判断。此外 FFA是有创检查,需注入造影剂,可能引起过敏反应。同时需要技术熟练的人员操作,耗时长,很难在无明确DR患者中开展筛查工作。OCTA是近年出现的新技术,具有实时、快速、无创、高分辨率等优点,无需造影剂就能清晰显示黄斑拱环区及视盘区的微血管结构,可测量黄斑区视网膜大血管和毛细血管网的血流密度和 FAZ形态及面积,且具有较高的可重复性和一致性,可对微血管病变程度进行量化评估,敏感性高于FFA[16]。DR与干眼的关系比较复杂,有研究表明,与正常人相比,DR患者泪液相关指标如泪膜破裂时间(BUT)、Schirmer试验、眼表炎症指数、泪河高度等指标均有所改变,但与病变严重程度有无相关性尚不清楚[17],也有证据显示糖尿病主要引起泪膜脂质层改变,影响泪膜稳定性,而水样液的分泌变化不大,眼表症状评分也无显著性差异[18]。既往干眼的检查手段(如BUT、角膜荧光素染色评分)主观性较大,医生往往需要凭借临床经验做出判断,得益于检测技术的进步,我们能够使用更加精密的仪器定量观察泪膜指标和眼底微血管病变指标,因此能够得出更有说服力的结论。

图3各组受检者LLT与黄斑区微血管结构参数的相关性。
本研究通过Lipiview眼表面干涉仪检测LLT,采用OCTA检测黄斑区微血管结构参数,结果发现,与正常人相比,DR患者LLT明显降低,且与视网膜微血管病变指标 FAZ、SCL血管密度间存在相关关系。三组受检者LLT与DCL血管密度并无相关关系,究其原因,可能是因为DCL变异较大,测量的准确性和稳定性远不如SCL,因此临床研究主要以SCL作为糖尿病微血管改变的指标,较少使用DCL[19]。糖尿病相关干眼的诊断和治疗应纳入糖尿病整体治疗体系和慢病管理,临床工作者在关注DR严重程度的同时,更应注意干眼发生的可能,以提高患者生活质量,减少并发症。
糖尿病相关干眼的发病机制尚未完全明确,目前普遍认为角膜神经的损伤可能在疾病的发展中起到关键作用,角膜神经密度降低会导致角膜敏感性下降,进而引起眨眼频率降低,泪液蒸发过强,泪膜稳定性下降[20-21]。已有证据表明,糖尿病患者视网膜微血管改变的发生早于临床可见的糖尿病视网膜病变,使用OCTA可发现糖尿病患者已出现的早期微血管改变,主要表现为FAZ扩大和黄斑血流密度下降,同时伴有视觉电生理指标的异常,且微血管改变的程度与DR的严重程度相关[22-23],因此推测糖尿病微血管改变可导致神经缺血、损伤,进而引起泪膜稳定性下降,这或许可解释本研究发现的LLT与视网膜微血管改变之间具有相关性。此外,眼睑肌肉的收缩对睑板腺导管系统和腺泡施加压力,有助于从睑板腺释放脂质[24],因此眼睑组织的缺血和神经功能异常也可能加重患者的泪膜不稳定状态。
不仅如此,糖尿病相关炎症也与干眼的发生发展有关,微血管病变是全身血管异常的一部分,微血管改变与组织缺氧、氧化应激和炎症关系密切,尤其在糖尿病患者,早期即可出现心脏、肾脏等全身微血管异常及炎症反应。Suzuki等[24]研究发现糖尿病患者常伴随有睑板腺炎,影响腺体的分泌功能,炎症状态的腺体也会释放炎性介质和游离脂肪酸(freefatty acids,FFAs),从而形成恶性循环,引发眼表炎症和角化过度。关于糖尿病相关干眼的发病机制,有必要进行更深入的分子生物学研究,以指导临床治疗的开展。

