玻璃体腔注射抗氧化剂NAC对早期糖尿病大鼠视网膜的保护作用
陈 玲,刘彦芳,林 萍
0 引言
随着生活水平的提高,糖尿病(diabetes millitus,DM)患者在全世界快速增加。国际糖尿病协会发声,糖尿病的发展将面临失控,没有哪一个国家完全有能力遏制糖尿病的发展。糖尿病视网膜病变(diabetic Retinopathy,DR)是糖尿病最为常见和严重的神经及微血管并发症之一,成为全球性四大主要致盲原因之一[1-2]。前期研究表明,抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)对早期糖尿病大鼠视网膜有保护作用[3-4],其可以抑制糖尿病时活性氧簇(reactive oxygen species,ROS)的生成增加,下调血管内皮生长因子(vascular endothelial growth factor,VEGF)、细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)在视网膜血管的表达[4]。色素上皮衍生因子(pigment epithelium-derived factor,PEDF)作为神经营养因子,在眼部主要由视网膜色素上皮细胞合成,在DR的进程中作用广泛。本实验拟在既往研究的基础上,观察抗氧化剂NAC对早期糖尿病大鼠视网膜内核层厚度、神经节细胞数量及视网膜中PEDF表达情况的影响,探讨NAC对视网膜保护作用的机制,为更早期的DR进行有效治疗提供理论基础。
1 材料和方法
1.1材料健康成年雄性SD大鼠30只(由西安交通大学实验动物中心提供,眼部检查无异常,体质量约180~220g,实验动物饲养管理室内有通风换气设备,保持空气新鲜,饲料为西安交通大学实验动物中心供应的标准饲料。按照随机分配的原则分为正常对照组(normal control group,CON组,n=10)和糖尿病组(DM组,n=20)。糖尿病组(DM组)禁食12h后,按照60mg/kg体质量剂量一次性左下腹腔注射10g/L链脲佐菌素(streptozotocin,STZ)溶液,正常对照组(CON组)注入等量的柠檬酸缓冲溶液。用药72h后,鼠尾静脉取血检测血糖,≥16.7mmol/L者定为糖尿病模型动物。成模大鼠随机分为糖尿病对照组(D组,n=8只)和NAC治疗组(N组,n=8只)。模型建立后,N组大鼠每周通过玻璃体腔注射4μL 1.6μg/μL的NAC,CON组、D组大鼠则给予玻璃体腔注射4μL 0.01mmol/L的磷酸缓冲盐溶液(PBS),不限饮食水,分组喂养。实验动物在麻醉下进行所有手术(10%水合氯醛腹腔注射过量麻醉大鼠),并尽一切努力最大限度减少其疼痛、痛苦和死亡,符合实验动物伦理要求。
兔抗大鼠Thy-1.1多克隆抗体检测视网膜神经节细胞数量,购于北京博奥森,工作浓度1∶50兔抗大鼠PEDF多克隆抗体购于上海研晶生物,工作浓度1∶50;FITC标记山羊抗兔IgG购于北京博奥森,工作浓度1∶200。图像信号采集与分析系统:德国Leica 公司(q550cw);荧光显微镜,日本OLYMPAS BX51;荧光图像采集系统:美国QE SPOT INSIGHT。
1.2方法
1.2.1取材糖尿病大鼠成模2mo后,10%水合氯醛腹腔注射过量麻醉大鼠,迅速摘除眼球,在眼球角膜距角巩缘0.5mm针刺定位,将眼球固定脱水后常规包埋,根据针刺定位点过视神经垂直于子午线平面切成5μm厚的切片。
1.2.2 HE及免疫荧光染色每只眼选择6张切片,每张切片随机选取视网膜中央部、中周部、周边部共5个视野,6张切片测量平均值作为1个样本。采用计算机图像分析系统观察视网膜结构改变,并测量内核层厚度,并以此作为视网膜组织损伤的判断指标。采用免疫荧光法,按照说明书,结果判定标准:阳性细胞胞浆为荧光绿。
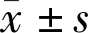
2 结果
2.1各组大鼠视网膜内核层厚度各组大鼠视网膜内核层厚度测定显示,CON组、D组、N组视网膜内核层厚度(32.062±1.543、21.207±3.603、31.187±1.004μm)比较,差异有统计学意义(F=53.322,P<0.001,图1)。D组视网膜内核层厚度较CON组下降,差异有统计学意义(P<0.01),N组视网膜内核层厚度较CON组略下降,差异无统计学意义(P>0.05)。D组视网膜内核层厚度较N组下降,差异有统计学意义(P<0.01)。
2.2各组大鼠视网膜神经节细胞数量各组大鼠视网膜神经节细胞数量检测表明,CON组、D组、N组视网膜神经节细胞数量(25.25±4.268、5.13±1.808、23.63±3.159个)比较,差异有统计学意义(F=95.334,P<0.001,图2)。D组视网膜神经节细胞数量较CON组减少,差异有统计学意义(P<0.01);N组视网膜神经节细胞数量较CON组略下降,差异无统计学意义(P>0.05)。D组视网膜神经节细胞数量较N组下降,差异有统计学意义(P<0.01)。
2.3免疫荧光法观察视网膜各层PEDF表达情况PEDF阳性反应主要分布于视网膜内核层及神经节细胞层。糖尿病2mo后,大鼠视网膜中PEDF平均光密度的测定表明,CON组、D组、N组视网膜中PEDF平均光密度值(1.363±0.190、0.688±0.119、1.304±0.218)比较,差异有统计学意义(F=34.403,P<0.001,图3)。D组PEDF表达较CON组下降,差异有统计学意义(P<0.01)。N组PEDF表达较CON组略下降,差异无统计学意义(P>0.05)。D组PEDF表达较N组下降,差异有统计学意义(P<0.01)。
3 讨论
DR是糖尿病最为常见和严重的神经及微血管并发症之一,也是影响患者生活质量的主要原因。PEDF是目前发现的最重要的新生血管抑制因子[5],属于丝氨酸蛋白酶抑制剂超家族的一种糖蛋白,在眼部主要由视网膜色素上皮细胞合成,1987年Tombrn-Tink等[6]从胎儿视网膜色素上皮细胞培养液中第一次发现。Ogata等[7]检测糖尿病患者玻璃体及房水中PEDF含量较正常人明显降低,而同时VEGF含量增加,提示PEDF除了是一种神经营养因子外还可以抑制新生血管的生成。作用机制主要有:在DR早期通过抑制NADPH氧化酶来发挥抗氧化保护作用[8];上调Fasl,促进活化的血管内皮细胞凋亡等[9]。糖尿病慢性并发症的统一机制学说认为:引起糖尿病各并发症的四条经典通路,即多元醇通路激活、晚期糖基化终末产物(advanced glycosylation end products,AGEs)增加、蛋白激酶C(protein kinase C,PKC)激活及氨基己糖途径,实质上都是高糖诱导过氧化物过多表达的结果,氧化应激是糖尿病并发症发生、发展的重要因素[10]。因而抗氧化治疗也逐渐被人们所关注。研究表明,腺病毒介导的PEDF以玻璃体腔注射的方式转染视网膜组织后,视网膜内核层较前增厚,视网膜神经节细胞密度增高,提示外源性PEDF能够保护视神经损伤后的视网膜神经节细胞,促进视网膜神经节细胞损伤修复,具有神经保护作用[11]。近期也有研究发现,新型PEDF小肽可以减少脉络膜及视网膜新生血管生成[12]。本实验中,糖尿病大鼠2mo时,视网膜内核层变薄及视网膜神经节细胞数量减少,从而导致视网膜缺血缺氧可能与视网膜组织中PEDF水平减少有关。

图1各组大鼠视网膜组织的形态学改变(×400)A:CON组;B:D组;C:N组;GCL;神经节细胞层;IPL:内网层;INL;内核层;OPL;外网层;ONL:外核层;PEL:色素上皮层。
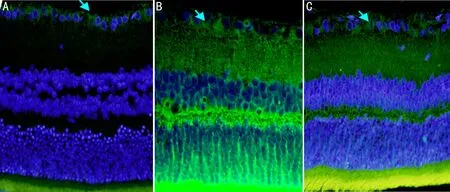
图2免疫荧光法检测各组大鼠视网膜神经节细胞(×400)A:CON组;B:D组;C:N组;图中箭头所指为显色的视网膜神经节细胞的胞膜及树突。
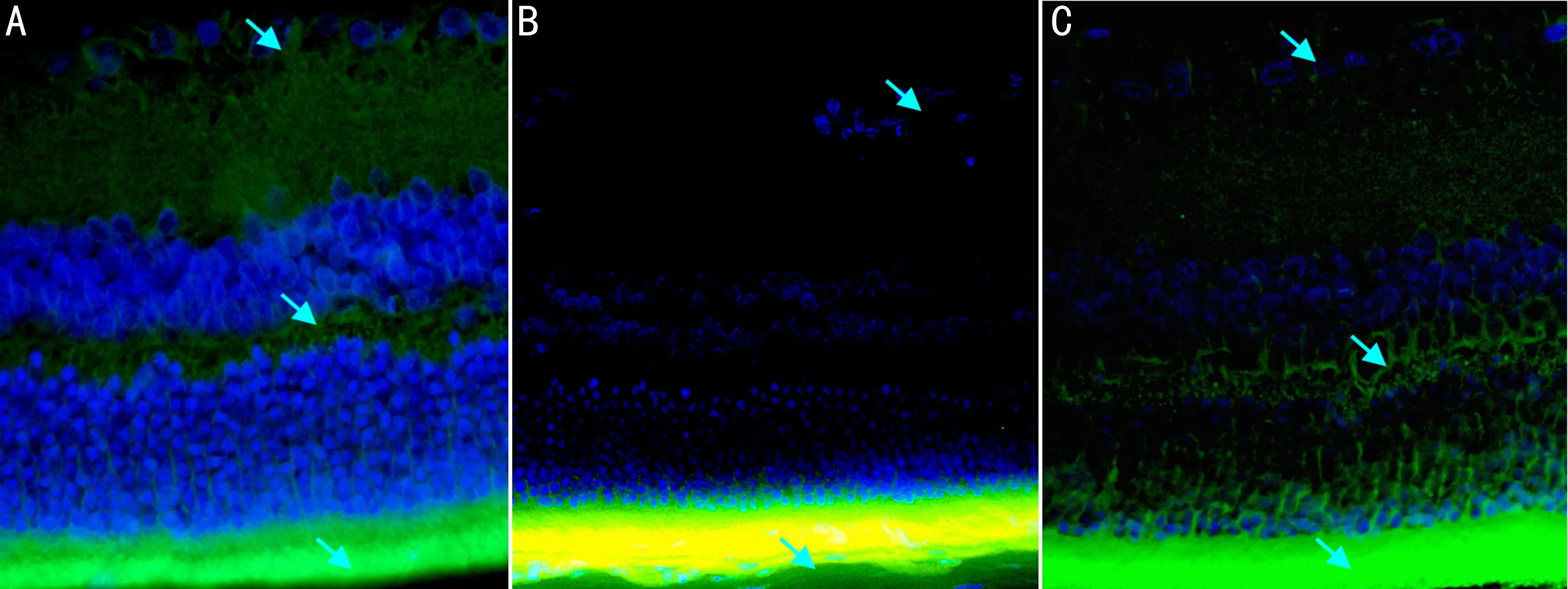
图3各组大鼠视网膜中PEDF表达情况(×400)A:CON组;B:D组;C:N组;图中箭头所指为PEDF表达情况。
NAC是一种含有巯基的抗氧化剂,在以往主要用于呼吸系统疾病的治疗。近年研究发现,其不但对于呼吸系统疾病起重要作用,同时在干细胞保护及抗肿瘤的过程中也有重要的保护作用。大量研究发现,其具有抗氧化、减少活性氧簇(reactive oxygen species,ROS)生成、清除自由基、调节细胞代谢活性、抗细胞凋亡等作用[13]。NAC起作用的优点有:为小分子物质,易于进入细胞,脱乙酰基后成为谷胱甘肽(glutathione,GSH)合成的前体,从而提高组织内GSH含量,增加体内GSH贮存。体内实验中发现NAC能提高红细胞、肝脏组织和肺组织中细胞内的GSH水平[14]。有研究显示:抗氧化剂NAC能不同程度恢复糖尿病大鼠各组织抗氧化水平,从而起到阻止或延缓糖尿病相关的靶器官功能损害的作用[15]。前期研究发现,NAC抗氧化应激可减轻视网膜缺血缺氧状态,从而减轻视网膜新生血管的生成[4]。本实验研究发现,糖尿病大鼠2mo时视网膜中PEDF水平已明显降低,而通过玻璃体腔注射NAC后视网膜中PEDF水平较D组明显提高,同时视网膜组织较D组破坏减少,提示NAC对早期糖尿病大鼠视网膜组织保护作用,可能是通过NAC的抗氧化应激作用,减轻了视网膜缺血缺氧状态,从而上调了视网膜中PEDF水平相关。
综上所述,在糖尿病早期,视网膜缺血缺氧的环境已经使PEDF水平下降,抗氧化剂NAC对早期糖尿病大鼠视网膜组织有保护作用的机制可能是通过上调视网膜中PEDF水平,提示NAC及PEDF有潜在的临床应用价值。

