荧光定量PCR测定HBV DNA的抗干扰能力评价*
李育敏,阚丽娟,张水兰,汤花梅,许晓清,熊丹,张秀明(深圳市罗湖区人民医院医学检验科,广东深圳 518001)
按照ISO 15189: 2012要求和CNAS-CL02-A009《医学实验室质量和能力认可准则在分子诊断领域的应用说明》[1],定量检测方法和程序的分析性能验证应包括抗干扰能力。《乙型肝炎病毒脱氧核糖核酸定量检测试剂注册技术审查指导原则》要求必须验证的干扰物质有三酰甘油、胆红素、血红蛋白和IgG。本研究参照美国临床和实验室标准化协会(CLSI)EP7-A2方案[2],进行系列干扰评价试验,验证血红蛋白、三酰甘油、总胆红素和总IgG对HBV DNA检测的干扰,对存在干扰的物质评价其浓度和干扰程度之间的关系,确定和量化干扰效应,为临床实验室进行分子诊断定量检测方法和程序的分析干扰性能验证提供参考。
1 材料与方法
1.1试剂与仪器 HBV DNA荧光定量PCR试剂盒(批号:2017012,湖南圣湘公司);cobas®z480全自动荧光定量PCR分析仪(Roche公司)。
1.2配对差异试验 参照EP7-A2方案,验证干扰物是否对荧光定量PCR法测定HBV DNA存在干扰。
1.2.1样本 厂家声明三酰甘油≤3 000 mg/dL(34.0 mmol/L)、总胆红素≤476.0 μmol/L、血红蛋白≤2 g/dL和总IgG≤40 g/L对检测结果无影响。收集三酰甘油、总胆红素和总IgG浓度与厂家声明接近以及溶血(检测血红蛋白浓度)且HBV DNA阴性的血清样本作为干扰物,制备HBV DNA分析浓度在高、低2个水平(103和106IU/mL)的血清样本作为测试样本。配制方法:以三酰甘油为例,取HBV DNA浓度为105IU/mL、三酰甘油<1 mmol/L的血清样本和三酰甘油浓度为34.0 mmol/L、HBV DNA阴性的血清样本,按1∶100比例配制成三酰甘油浓度为34.0 mmol/L、HBV DNA分析浓度为103IU/mL的测试样本(由于稀释比例为1∶100,前者对后者血清样本中三酰甘油浓度的影响可以忽略不计);HBV DNA分析浓度为106IU/mL水平的测试样本则选取108IU/mL的血清样本以相同方法配制。其余干扰物配制同三酰甘油。对照样本按同样方法配制为HBV DNA分析浓度相同的血清样本,不含血红蛋白,仅含少量三酰甘油(<1 mmol/L)、总胆红素(<6 μmol/L),与测试样本相比,所含干扰物浓度可忽略不计。但由于总IgG干扰样本浓度较低(40 g/L),而正常血清中IgG平均浓度约10 g/L,故对照样本选取12 g/L的总IgG正常标本,即约40 g/L的干扰样本与12 g/L的对照样本进行比较。作为干扰物(三酰甘油、总胆红素、血红蛋白和总IgG)的血清均各选择3个与厂家声明的干扰浓度接近的临床样本,3个样本均存在干扰作用再进行剂量效应试验。所有实验样本均排除丙肝DNA阳性。
1.2.2测定流程 取HBV DNA分析浓度分别为103IU/mL和106IU/mL的2个血清样本,每个样本重复测定20次,得到均值和批内标准差(s)。确定最大允许干扰值(dmax)为国家卫生和健康委员会临检中心室间质评评价界限0.4(LOG值),分别计算2个浓度水平的dmax/s,查附表得出2个浓度水平的重复次数(n)。测试样本和对照样本同批检测,按重复次数测定。样本检测前校准仪器,每天进行室内质量控制,质控在控时数据可接受。
1.2.3数据分析 计算测试样本和对照样本的测量均值间的差值,差值≤±0.4(LOG值),符合厂家声明。
1.3剂量效应试验 参照EP7-A2方案,对存在干扰的物质确定干扰物浓度与干扰程度之间的关系(干扰效应)。
1.3.1样本 高浓度干扰物样本(H)选取高于厂商声明浓度的病理血清样本,低浓度干扰物样本(L)选取正常平均浓度的血清样本。高、低浓度干扰物样本均检测HBV DNA为阴性后制备成5个系列浓度(4L,3L+1H,2L+2H,1L+3H,4H)的干扰样本。取HBV DNA浓度为105IU/mL和108IU/mL的血清和各浓度梯度的干扰样本,配制HBV DNA分析浓度在103IU/mL和106IU/mL 2个水平的测试样本,配制方法同配对差异试验。
1.3.2测定流程 每个样本重复测量3次,在1个分析批次内完成检测。
1.3.3数据分析 计算低浓度水平(4L)标本的测量均值,各浓度水平的测定结果减去低浓度标本的均值为干扰效应。以干扰物浓度为x轴,以干扰效应为y轴,绘制剂量-效应回归分析图,如呈线性效应,采用线性回归分析;如呈非线性效应,则采用非线性回归分析,选择合适的模型拟合回归方程计算给定干扰物浓度的干扰程度。
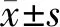
2 结果
2.1样本的重复次数 HBV DNA在103IU/mL浓度水平,s为0.09 IU/mL,dmax/s为4.62;在106IU/mL浓度水平,s为0.05 IU/mL,dmax/s为7.85,查附表,2个浓度水平的样本重测次数(n)均为3。
2.2配对差异试验 结果见表1。34.0 mmol/L的三酰甘油和2 g/dL的血红蛋白对HBV DNA检测无干扰,差值<0.4(LOG值),符合厂家声明。476.0 μmol/L的总胆红素对103IU/mL 浓度水平的HBV DNA检测无干扰;在106IU/mL水平处测试样本和对照样本差值为0.44(LOG值),按四舍五入原则,符合厂家声明。40 g/L的总IgG对103IU/mL浓度水平的HBV DNA检测有负干扰,需进一步利用剂量效应试验测定干扰效应。

表1 干扰物对HBV DNA检测的配对差异实验结果(LOG值)
注:*,表示有干扰。
2.3剂量效应试验 总IgG干扰效应测试样本的5个系列浓度分别为12.0 g/L、21.0 g/L、30.0 g/L、39.0 g/L和48.0 g/L。总IgG≤48.0 g/L时,对HBV DNA检测为非线性负干扰,剂量-效应曲线见图1、图2。非线性方程分别为y=1.693 2-1.509 3In(x) (R2=0.92,P=0.01),y=0.046 1-0.002 2x-0.000 3x2(R2=0.98,P=0.02)。

图1 总IgG对103 IU/mL浓度HBV DNA检测的干扰效应

图2 总IgG对106 IU/mL浓度HBV DNA检测的干扰效应
3 讨论
EP7-A2文件是目前分析干扰评价试验的规范标准[3],EP7-A2采用配对差异、剂量效应和利用患者标本作偏倚分析,但都存在局限性。前2种添加外源性干扰物,实验样本基质不代表典型有问题的临床样本;第3种方案参照EP9-A2,选择真实的特定患者标本(如高血脂等)以减少基质效应,但只能证明偏倚和估计的干扰物某水平的相关性,不能证明因果关系。本研究参照EP7-A2采用配对差异和剂量效应实验进行干扰评价,但样本选择患者标本,将EP7-A2的3种方案结合应用于干扰评价,既达到统计学要求的检验水准,又可减少基质效应。
我国2015年《中国慢性乙型肝炎防治指南》[4]推荐接受抗病毒治疗的人群为HBeAg阳性患者HBV DNA≥20 000 IU/mL;HBeAg阴性患者HBV DNA≥2 000 IU/mL。本研究选择103和106IU/mL的2个病理浓度水平作为HBV DNA检测干扰评价实验的高、低分析物浓度,结果表明三酰甘油、血红蛋白和总胆红素对HBV DNA检测的干扰评价均符合厂家干扰声明。方芳等[5]研究表明总胆红素在274.6 μmol/L时即对HBV DNA检测存在干扰,崔蕾蕾等[6]表明总胆红素高于400 μmol/L对结果存在影响,但是2项研究均添加商品化外源性胆红素作为测试样本,不能代表真实的患者病理标本,而本研究分析患者的真实标本,能直接评价病理血清标本中存在的干扰物及其干扰效应。
人血清中存在的IgG是PCR抑制剂,但目前国内对HBV DNA检测的IgG干扰验证报道较少。本研究表明40 g/L的总IgG对HBV DNA检测存在负干扰,进一步用剂量效应实验测定其干扰效应为非线性负干扰。拟合非线性回归模型时既要考虑决定系数(R2),又要有统计学意义(P<0.05),但同时也应注意如果为了单纯得到较大R2,模型形式可能会很复杂,使其中参数无法解释实际意义,也不可取,应结合实际解释和应用效果来确定最终曲线。本研究在低浓度水平选择对数曲线,高浓度水平选择抛物线拟合非线性方程,可通过回归方程估计不同浓度总IgG对HBV DNA检测的干扰程度,如40 g/L的总IgG对103IU/mL浓度HBV DNA检测的干扰效应为-0.72 LOG,在106IU/mL浓度处的干扰效应为-0.52 LOG。剂量效应试验在计算干扰效应时,低浓度水平(12 g/L)处为各测定结果减去低浓度标本的均值,即低浓度干扰效应标示值在0左右。配对差异试验为40 g/L的干扰样本直接与12 g/L的对照样本进行偏倚评估,故差值(-0.62 LOG)与剂量效应试验的干扰程度(-0.72 LOG)有差异,在评价干扰效应时通常采用剂量-效应回归分析。通过干扰评价,实验室可认为HBV DNA呈-0.72 LOG的改变是有意义的干扰,即该变化是由40 g/L的总IgG干扰所致,而不是临床治疗的效果。本研究所采用的干扰评价新方法学和总IgG对HBV DNA测定结果的干扰现象仍需临床试验进一步验证。

