羊乳中牛乳成分的直接实时环介导等温扩增检测
澹台玮,徐秦峰,马西亚,张文娟
(陕西科技大学食品与生物工程学院国家羊乳制品加工技术研发专业中心,西安710021)
0引言
乳制品营养丰富,易被人体消化吸收,同时作为加工食品原辅料的重要来源,在世界各地有着巨大的消费群体[1]。尤其是羊乳以其更高的营养价值使得其价格远高于牛乳[2]。一些不法商家为了寻求商业利益,在羊乳中掺入牛乳,以次充好,且掺入手段多样,不易辨别。这种掺假行为不仅会给消费者造成直接的经济损失,而且还涉及到某些特殊的医疗要求、食物过敏甚至是宗教信仰问题[3]。因此,建立牛、羊源性的品种鉴别方法以保证乳品真实性是必要的。
目前用于乳制品来源鉴别方法主要有分析蛋白、脂肪和核酸的方法,这些方法在一定程度上都可以实现牛、羊乳品种鉴别[4]。但是,相比于蛋白质和脂肪,核酸分子的稳定性更高,且在个体细胞间具有良好的保守性[5-6]。因此基于DNA的检测方法不仅适用于生乳样品,也适用于热加工的乳品[7]。基于核酸发展的牛、羊乳的品种鉴别技术有普通PCR[8]、real-time PCR[9]等,但大多操作繁杂,设备昂贵,且需专业操作人员才能完成。Notomi等[10]研发的一种新型核酸扩增方法,即环介导等温扩增技术(Loop mediated isothermal amplification,LAMP)通过4条特异性引物,快速识别靶序列上的6个位点,结合具有链置换活性的DNA聚合酶,实现在恒温条件下,特异、高效、快速地扩增核酸序列,已被成功应用于物种鉴定。Deb R等[11]通过对LAMP反应体系进行优化,实现在2 h内对羊奶/肉类样品中掺入5%牛成分的检测。Cho A R等[12]建立了LAMP熔解曲线分析方法,实现对8种肉制品进行了识别和鉴定。然而,这些研究都需要进行过程繁琐、耗时较长的DNA提取过程,限制了对现场快速检测的应用。本研究建立了一种在不进行DNA提取的情况下直接实时LAMP检测方法,同时检测时可以采用更少量的样品,实现对羊乳及其制品中掺入牛乳成分的检测。
1材料与方法
1.1实验材料
鲜奶牛乳样品,西安市未央区草滩奶牛场;鲜羊乳样品-20℃保存备用,市售;用于验证引物特异性的非目标DNA(鸡、猪、马、兔和鸽子)均购于四川华汉三创有限公司;不同品牌的羊乳产品(液态乳、羊奶片、全脂羊乳粉、淡奶粉及配方奶粉),市售,用于验证所建立方法的实际应用价值。
模拟掺假样品的制备:将牛乳按不同比例掺入羊乳中(100%、80%、50%、10%、5%、1%、0.1%、0%),制备成具有不同含量的模拟掺假样品。
1.2主要试剂和仪器
(1)试剂:磁珠法血液基因组DNA提取试剂盒购自天根有限公司;甜菜碱(Sigma公司);dNTP混合液,Bst 2.0 WarmStar DNA聚合酶,MgSO 4,均采自New England Biolabs。
(2)仪器:高速冷冻离心机(5424R),Eppendorf有限公司;琼脂糖水平电泳仪(DYCP-31DN),北京六一生物科技有限公司;电热恒温水槽(DK-8D),上海精宏实验设备有限公司,荧光定量PCR仪(qTOWER 2.2),德国耶拿分析仪器股份公司;超微量分光光度计(Q 6000),美国Quawell。
1.3 DNA提取
按照磁珠法血液基因组DNA提取试剂盒说明书,提取新鲜乳品或乳粉中的DNA,采用超微量核酸定量仪测定DNA的浓度和纯度后,将DNA溶液稀释到7 ng/μL,保存于-20℃冰箱中备用。
1.4 LAMP引物设计及筛选
本研究涉及的牛、羊特异性引物以线粒体保守序列为靶基因,依据引物设计原则使用PrimerExplorerV4在线设计并进行实验的可行性验证,经过多次设计及筛选比对,最终使用SN/T 4419.21-2016[13]标准中的牛特异性引物及文献报道的羊特异性引物[14],如表1所示。引物由生工生物(上海)有限公司合成。
1.5 LAMP反应体系建立
LAMP反应体系为10μL,包括:1μL 10×Thermol Pol buffer,外引物F3和B3(10μmol/L)各0.2μL,内引物FIP和BIP(40μmol/L)各0.2μL,1.4μL dNTPs(10 mmol/L),1.6μL甜菜碱(0.8M),0.4μL MgSO 4(100 mmol/L),0.4μL Bst DNA聚合酶(8 U/μL),20×Eva Green荧光染料0.25μL,加入待测DNA 1.2μL,以超纯水为空白对照,最后用水补齐到10μL,混匀。反应条件:64℃恒温反应45 min。

表1本实验中LAMP扩增引物序列
1.6直接实时LAMP反应体系建立
对于直接实时LAMP反应体系,所有的待测样品都不需要进行DNA提取。首先取5μL样品(对市售的羊奶粉,取0.1 g奶粉溶于1 mL水中混匀,制成液态乳)放入含有55μL磷酸盐(PBS)缓冲液的PCR反应管中,在98℃下孵育5 min,然后取1.2μL上层清液直接作为模板用于上述LAMP反应。
1.7特异性试验
分别提取牛、羊、鸡、猪、马、兔、鸽子的DNA为模板,按照LAMP体系配置反应液,加入不同模板DNA,在最适反应温度下扩增,结果通过扩增曲线及2%的琼脂糖凝胶电泳进行分析鉴定,以验证LAMP引物的特异性。
1.8灵敏度试验
将DNA提取液进行10倍梯度稀释,使反应体系中DNA浓度分别为7、0.7、0.07、0.007、0.0007、0.00 007 ng/μL,将每个梯度的稀释液取1.2μL作为模板进行LAMP反应检测,并建立标准曲线进行单个物种DNA检测灵敏度的测定。
2结果与分析
2.1特异性检测
采用牛、羊、鸡、猪、马、兔、鸽子等样品DNA为模板,进行LAMP反应,以验证引物的特异性,扩增曲线如图1所示,针对牛、羊源性成分设计的特异性引物,仅含有目标成分DNA检测结果为阳性,空白对照和其他动物源性样品均未发生扩增,结合凝胶电泳结果显示,只有牛、羊乳DNA中分别加入牛、羊特异性引物才出现典型的梯形条带(图1中的泳道1),与扩增曲线结果一致,表明LAMP引物的特异性良好。
2.2灵敏度检测
为了确定设计的LAMP方法能够检测到的牛、羊乳DNA的含量,将10倍稀释的牛、羊源性成分DNA(7 ng/μL、0.7 ng/μL、0.07 ng/μL、0.007 ng/μL、0.0 007 ng/μL、0.00 007 ng/μL)分别用于LAMP反应,以超纯水作为空白对照。图2结果表明,牛源性成分检测的灵敏度可达到0.07 pg/μL,羊源性成分检测的灵敏度可达到0.7 pg/μL,表明检测体系具有较高的灵敏度。同时,牛、羊源性成分浓度与LAMP方法检出时间具有良好的线性关系,随着模板DNA浓度的降低,其检出时间越长。

图1牛、羊源性成分LAMP引物特异性验证

图2牛、羊源性成分LAMP反应灵敏度检测
2.3实时LAMP技术对掺假样品检测
考虑牛源性成分为羊乳中最为常见的掺假成分,为了确定其检出限,将试剂盒提取的羊乳DNA稀释液制成混合样品(掺入牛乳DNA含量分别为100%、80%、50%、10%、5%、1%、0.1%),使用牛特异性引物进行LAMP扩增。从图3可以看出,以不同比例的DNA混合液为模板,均可以出现明显的扩增曲线,表明本方法对羊乳中掺入牛源性成分的检测限为0.1%。
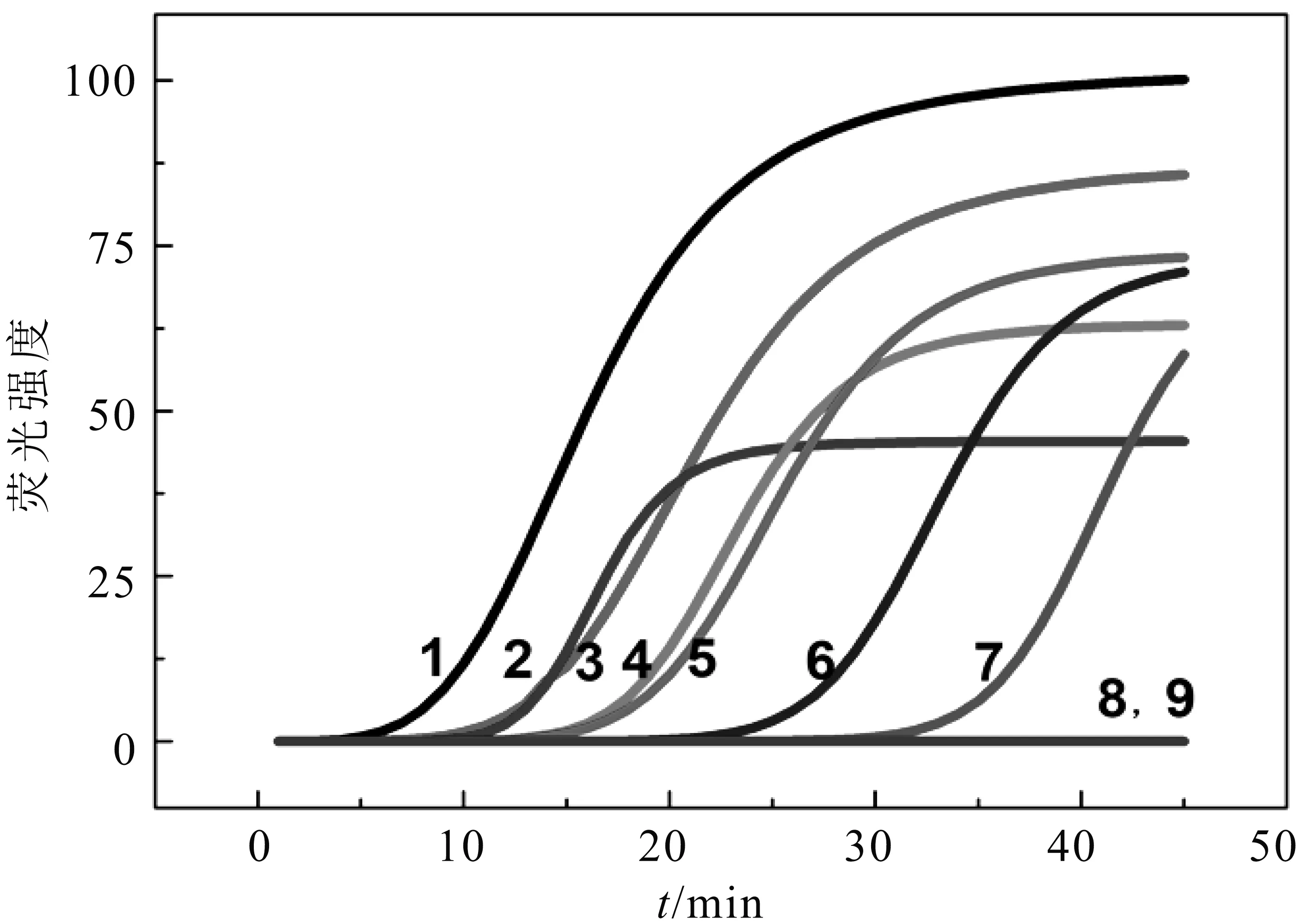
图3牛羊乳DNA混合样品中牛源性成分分析(1~9分别为掺入牛乳DNA比例为100%、80%、50%、10%、5%、1%,0.1%、0%和空白对照)
2.4直接实时LAMP技术对掺假样品检测
为了验证建立的直接实时LAMP方法的应用性,将牛乳按不同比例掺入羊乳中(100%、80%、50%、10%、5%、1%、0.1%、0%),制备成不同含量的混合样品,每个样品只需孵育5分钟,使细胞裂解释放出DNA,然后直接作为模板进行LAMP扩增。结果如图4所示,建立的直接实时LAMP方法可成功对乳制品进行检测,在不同比例的混合样品中,该方法能检测出羊乳中低至1%的牛乳成分,明显低于由试剂盒提取的DNA制成混合样品的检出限。这是因为乳体系内部的复杂性和乳中体细胞含量分布的不均匀性,将乳混和直接进行扩增时会有部分损失。

图4牛羊乳直接混合样品中牛源性成分分析(1~9分别为掺入牛乳比例为100%、80%、50%、10%、5%、1%,0.1%、0%和空白对照)
2.5实际样品检测
为了验证直接实时LAMP方法对市售样品检测的适用性,采用上述建立的检测体系对10种商业乳品进行直接检测,并通过试剂盒提取DNA的实时LAMP方法验证其准确性,检测结果见表2。结果表明,三个商业乳品(样品1、2、3)标记为只含有羊乳被加有牛特异性引物的LAMP反应体系扩增,显示了在羊乳中不同程度的掺入牛乳成分;而标识有生羊乳、乳清粉的样品8仅检测出牛乳成分,与标识的主成分不符。尽管牛乳清粉在羊奶粉中的添加和替换一直存在,但是错误标注会对过敏人群造成危害[15-16]。同时,直接实时LAMP与经DNA提取的实时LAMP反应相比,结果完全一致,但检测时间均有延迟,根据Tanner N A等人[17]对实时LAMP检测研究表明,在某些引物不足或不纯样品(即样品直接作为模板扩增)情况下时间阈值范围可在45-60 min,即为阳性结果,对比该研究表2可以发生扩增反应的时间可作为判定方式,即时间阈值小于60 min,为阳性结果,反之,则为阴性。相较于通过试剂盒提取乳中DNA到LAMP结果检测,简化了实验过程,缩短了时间。本实验证明了直接实时LAMP方法在不提取DNA的情况下实现对牛羊乳成分进行检测的能力,并且适用于现场快速检测。因此,本研究可实现对市售羊乳制品中掺入牛源性成分的检测。

表2市售羊乳制品中牛、羊乳成分的LAMP检测
3结论
现如今,羊乳及其制品掺入牛源性成分鉴别是乳制品质量安全控制面临的重要挑战。根据标准NY/T 3050-2016《羊奶真实性鉴定技术规程》规定,基于DNA的PCR方法,适用于生羊奶、UHT灭菌液态羊奶及羊奶粉中掺入牛源性奶成分的定性检测。但是该PCR方法需要专门的仪器以及复杂的DNA提取过程,无法实现羊奶真实性的现场快速检测,限制了此方法的推广应用。LAMP法作为一种新兴分子生物学方法,无需复杂的热循环体系,仅在恒温条件下扩增,因其高效、快速、便捷的特点已应用于动物源性成分及多种致病菌的检测[18-20]。本研究根据线粒体保守序列选取牛、羊特异性引物,建立了快速鉴别羊乳及其制品掺假的直接实时LAMP检测方法,该方法具有良好的特异性,仅对含有目标成分的样品有扩增,对其他动物源性成分没有交叉反应。该方法对牛、羊源性成分的检测灵敏度可达到0.07 pg/μL和0.7 pg/μL。对羊乳中掺入不同比例牛乳混合物进行5min热处理,可检测出掺入1%的牛乳,能够满足羊乳中掺入牛源性成分的检测。通过对市售羊乳及其制品中掺入牛源性成分的检测,无需核酸提取的直接实时LAMP检测结果与实时LAMP技术结果相一致,在1 h内即可对样品进行鉴定,极大地简化了实验过程,缩短了时间,同时直接实时LAMP技术无需核酸提取,减少了样品DNA提取过程的污染风险,同时检测时仅需采用更少量的样品即可实现乳制品中牛、羊源性成分的现场快速检测。

