大豆球蛋白兔源多克隆抗血清的制备及其免疫学特性鉴定
姚利利,席 俊,陈慧彬,陈 阳,刘德果,陈珍妮
河南工业大学 粮油食品学院,河南 郑州 450001
大豆具有较高的营养价值,蛋白含量高达38%,是人和动物获取植物蛋白的主要来源[1]。随着大豆蛋白广泛应用于食品行业,大豆成为增加食物过敏的潜在隐患,大豆过敏反应过程中,主要发生的是IgE依赖性的I型超敏反应[2-5]。研究发现,大豆包含多种过敏原,如大豆球蛋白(11S)、Gly m Bd 60k和Gly m Bd 30k[6],大豆过敏影响全球大约6%的婴儿和2%的成人[7]。大豆球蛋白约占总球蛋白含量的40%,分子质量为300~380 kDa[8-9],且该蛋白是大豆主要抗原蛋白之一,由 G1、G2、G3、G4和G5亚基组成,5个亚基中致敏性最突出的是G1、G2[10-14],每种11S蛋白的亚基可以在还原条件下解离成酸性(A,31~45 kDa)和碱性(B,18~20 kDa)肽链。目前,大部分研究主要是针对大豆球蛋白的结构和功能,关于其免疫学的分析以及建立该蛋白快速检测方法的相关研究非常有限。作者从脱脂豆粉中提取大豆球蛋白,用琼脂糖凝胶CL-6B过柱纯化后免疫新西兰兔制备多克隆抗血清(简称多抗血清),并进行免疫学特性分析,为建立大豆球蛋白致敏原检测方法和该蛋白致敏性亚基的表位定位提供了基础条件。
1 材料与方法
1.1 材料与试剂
脱脂豆粉:鲲华生物技术有限公司;雄性新西兰兔:郑州中原玉花种兔公司;弗氏不完全佐剂(FIA)、琼脂糖凝胶CL-6B、HRP标记羊抗兔IgG、弗氏完全佐剂(FCA):北京索莱宝科技有限公司;β-伴大豆球蛋白、花生蛋白、芝麻蛋白、麦朊蛋白:自制;化学发光辣根过氧化物酶底物液(ECL):美国millipore公司。
1.2 仪器与设备
Tanon 2500凝胶图像分析系统:上海天能科技有限公司;D500-D数显均质乳化器:德国Wiggens公司;Multiskan FC 酶标仪、Nanodrop ND-2000超微量核酸蛋白测定仪:美国Thermo公司。
1.3 试验方法
1.3.1 免疫原的制备
参照Puppo等[15]的方法从脱脂豆粉中提取大豆球蛋白,参照韩景华[16]的方法进行凝胶过滤层析纯化该蛋白,用Nanodrop ND-2000和SDS-PAGE进行蛋白浓度与纯度测定。参照文献[17]配制蛋白电泳胶,初始电压80 V,待样品跑出浓缩胶,调节电压至120 V。取出凝胶室温染色3 h,脱色液脱色到蛋白条带清晰为止,再用Tanon 2500仪器进行分析。
1.3.2 兔源多抗血清的制备
以制备的大豆球蛋白对3只体质量为2.5 kg的新西兰兔进行免疫,喂养一周无异样后,耳缘静脉取阴性血清。参照文献[18-19]的方法并稍加改进,设计免疫方案(表1),最后取心脏血,37 ℃恒温箱放置2 h,4 ℃冰箱过夜,使血清充分析出,-20 ℃分装保存。
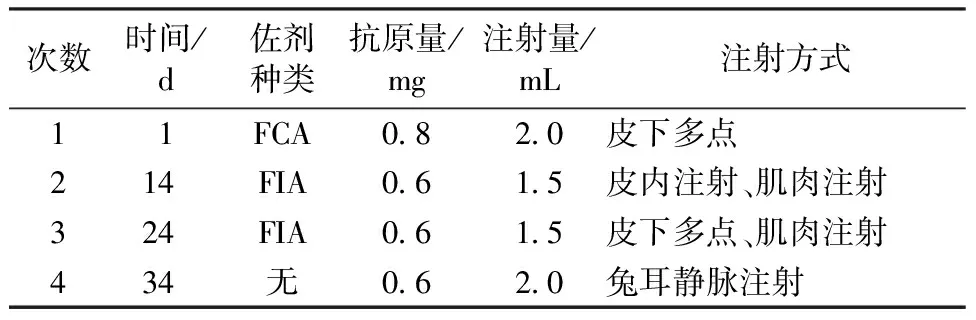
表1 免疫方案Table 1 Immunization program
1.3.3 大豆球蛋白抗血清效价测定
参照文献[22-23]用间接ELISA法测定抗血清效价并稍加改进,用CBS(0.05 mol/L碳酸盐缓冲液,pH 9.6)将大豆球蛋白稀释为10 μg/mL,4 ℃包被14 h,PBST洗板,拍干;BSA封闭;加入梯度稀释的一抗与包被抗原反应,以未免疫血清与PBS(0.01 mol/L磷酸盐缓冲溶液)为阴性和空白对照;加酶标二抗(1∶ 5 000倍稀释)与一抗反应;加显色液用锡纸包住孔板避光显色15 min;用2 mol/L H2SO4终止反应;用酶标仪测定每孔OD450。
1.3.4 大豆球蛋白抗血清敏感性测定
将效价测定过程中的加一抗改为加入配制成4 800~0 ng/mL的大豆球蛋白100 μL/孔,同时加入等量的抗血清(稀释倍数为效价测定时OD450在1.0左右倍数值),此法为间接竞争ELISA。参照文献[24]绘制曲线,曲线的半数抑制浓度(IC50)即为抗血清敏感性。
1.3.5 大豆球蛋白抗血清特异性测定
参考文献[25]测定多抗血清与花生蛋白、β-伴大豆球蛋白(7S)、芝麻蛋白、麦朊蛋白的交叉反应,与敏感性测定方法类似,将标准梯度的大豆球蛋白溶液替换为标准梯度的其他蛋白溶液。交叉反应率(CR)=(大豆球蛋白IC50/其他竞争物IC50)×100%。
1.3.6 硫酸铵沉淀纯化多抗血清
多抗血清的纯化[20-21]:为防止多抗血清活性降低,将分装的多抗血清先在4 ℃冻融,再置于室温,取2 mL多抗血清与2 mL PBS混合,加入4 mL饱和硫酸铵溶液(SAS)使最终溶液的饱和度达到50%,为使沉淀充分析出,放入4 ℃冰箱静置30 min,离心后将沉淀用PBS溶解,同上操作使溶液饱和度达到33%。再用PBS将沉淀物溶解,于4 ℃下透析3 d后分装保存到-20 ℃冰箱。
1.3.7 大豆球蛋白Western blot鉴定
蛋白质印迹是用于检测生物样品中特定蛋白质的最常用技术。免疫印迹的测定参考文献[26-27]的方法并稍加改进,大豆球蛋白凝胶电泳后,110 mA电流下电转150 min至PVDF膜。电转完成后,将PVDF膜封闭1 h,洗膜, 4 ℃下与1∶10 000倍稀释的多抗血清反应18 h,洗膜4次,每次10 min,加二抗孵育1 h,洗膜,加ECL工作液显影,定影。
2 结果与分析
2.1 大豆球蛋白SDS-PAGE鉴定
由图1可知,1泳道为大豆分离蛋白,2、3泳道为纯化前后的大豆球蛋白,可以看出其中还混有7S蛋白和其他的蛋白质组分,经过琼脂糖凝胶CL-6B纯化后,蛋白的纯度得到提高,杂蛋白的含量相对减少。经过Gel-Pro Analyzer分析,目标条带的光密度所占该条泳道光密度总和的百分比为大豆球蛋白的纯度,得知纯化前大豆球蛋白纯度为70%,纯化后纯度为81%。
2.2 多抗血清的鉴定
2.2.1 多抗血清效价鉴定
影响多抗血清效价的因素较多,包括免疫原在体内的滞留时间、免疫原注射方式等,且不同动物对免疫原的反应也会有很大差别。按照上述的免疫方法和程序,对每次免疫所得的血清进行检测,结果见图2,图中纵坐标为每次免疫后多抗血清稀释倍数为1 600时在450 nm下的吸光度。由图2可知,在4次免疫过程中,1号兔的抗血清效价在4次时是3只新西兰兔中抗血清效价最高的,每只新西兰兔的多抗血清效价随免疫次数增加呈递增趋势,表现为450 nm的吸光度逐渐增加,总体来看,所制备的多抗血清效价逐渐升高。
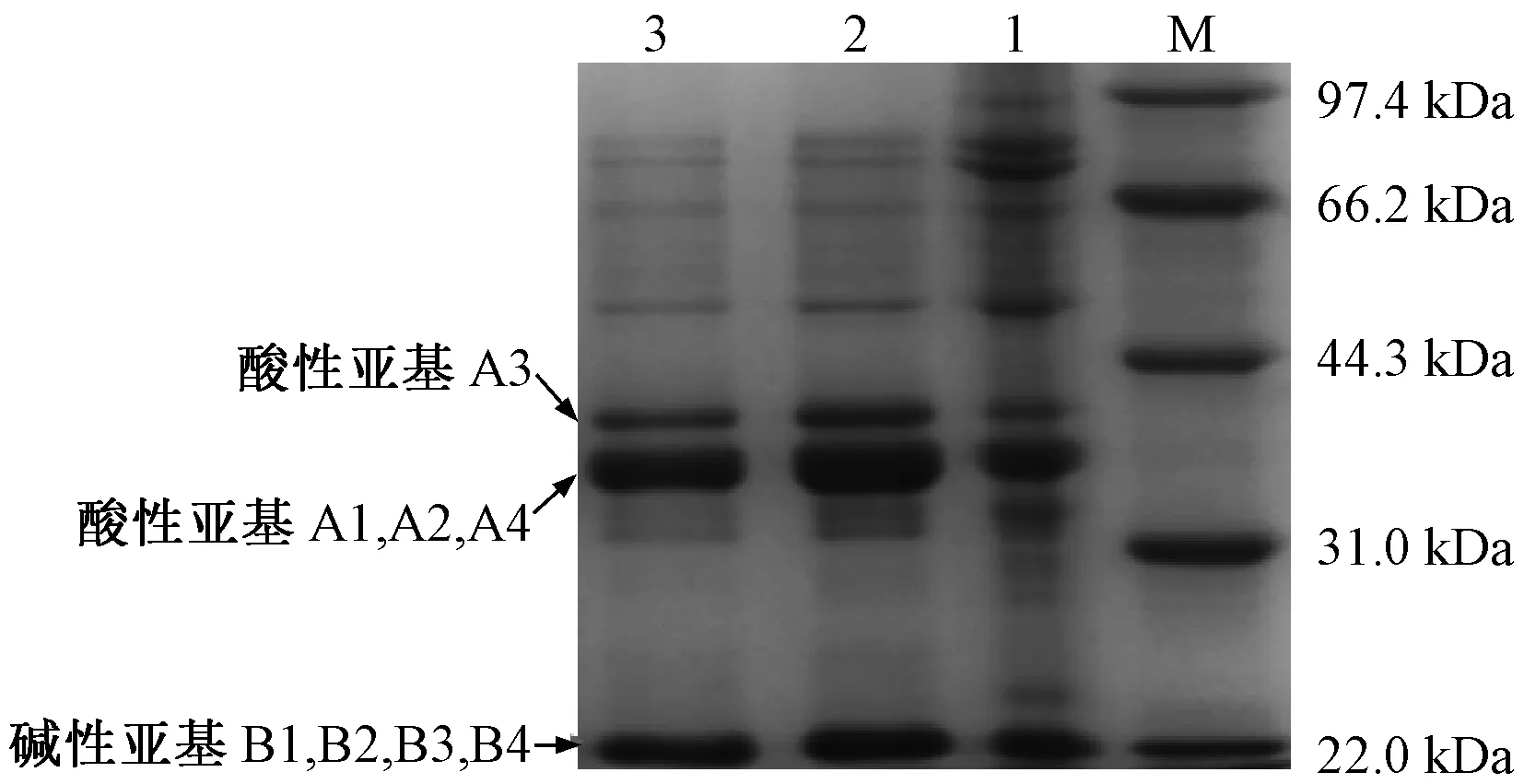
注:M为蛋白质Marker;1为脱脂豆粉;2为粗提大豆球蛋白;3为过柱后大豆球蛋白。图1 大豆球蛋白SDS-PAGEFig.1 SDS-PAGE of soybean glycinin
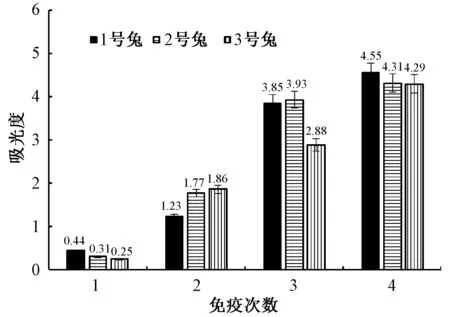
图2 多抗血清效价Fig.2 Polyclonal antiserum titer
根据OD检测孔/OD阴性孔≥ 2.1为阳性,设置空白和阴性对照,第4次免疫后效价测定结果见表2。由表2可知,1、2、3号的兔源血清效价分别为1∶ 6×104,1∶ 2.6×104和1∶ 5.8×104,因此1号兔和3号兔的效价较高。制备的抗大豆球蛋白多克隆抗体效价达60 000,比陈婧舒等[8]制备的效价高出6倍。

表2 第4次免疫后多抗血清OD450Table 2 OD450 value of polyclonal antiserum after the fourth immunization
2.2.2 多抗血清敏感性鉴定
选取效价较高的1号兔和3号兔的多抗血清,用间接竞争ELISA法测定多抗血清的敏感性。参照文献[17]的方法,以抑制率(B/B0值)与竞争蛋白质量浓度的对数进行线性拟合,不同质量浓度下的大豆球蛋白对多抗血清产生的抑制效果如表3所示。

表3 多抗血清抑制效价Table 3 Inhibitive titers of polyclonal antiserum ng/mL
由图3、图4可以看出,y=-0.275 2x+1.447 5为1号兔的线性回归方程,R2=0.993 8, 多抗血清对大豆球蛋白的半数抑制率IC50为527 ng/mL。3号兔的线性回归方程为y=-0.280 8x+1.473 4,R2=0.983 2,多抗血清对大豆球蛋白的IC50为582 ng/mL。相比3号兔,1号兔的多抗血清敏感性更高。
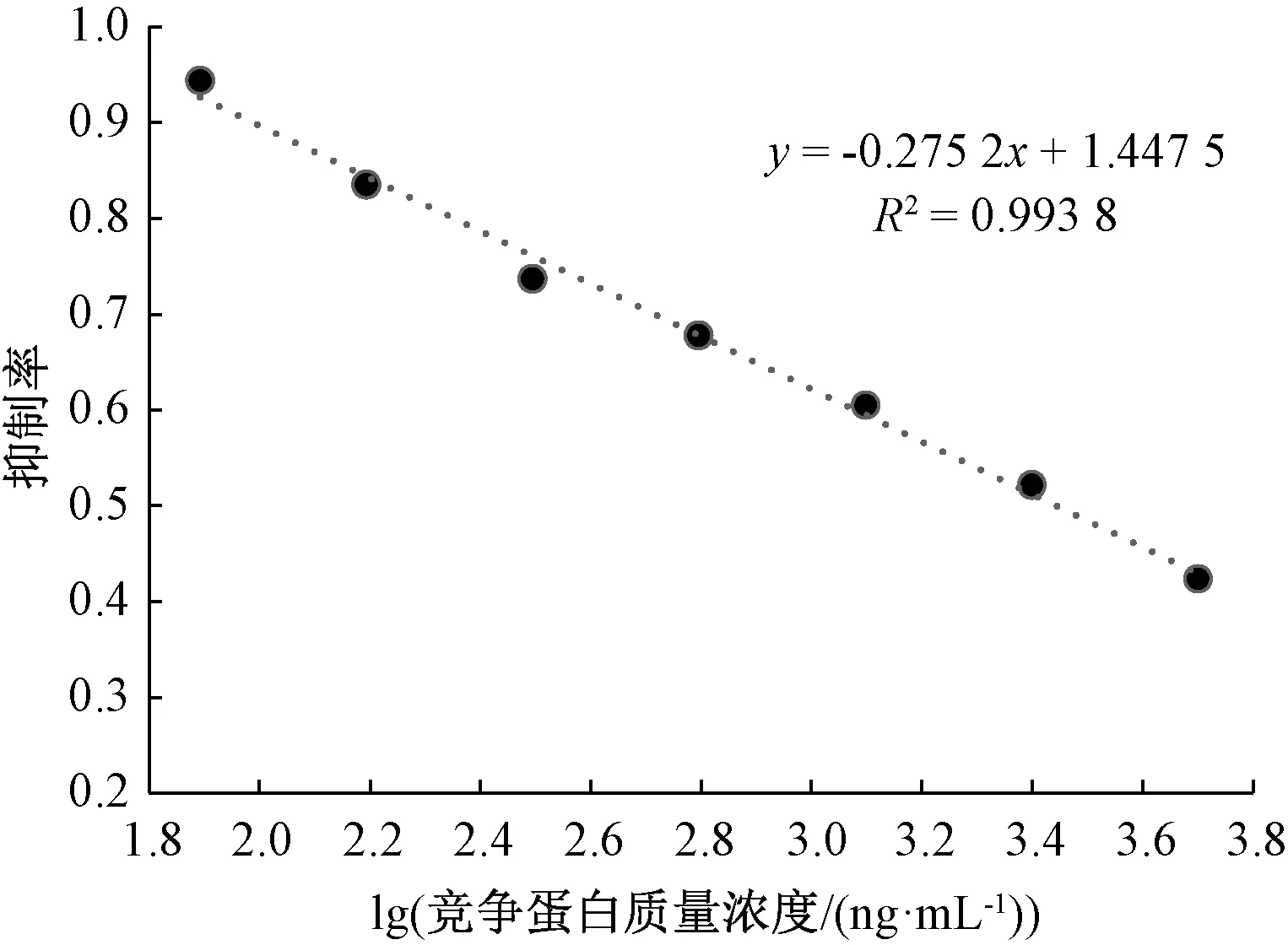
图3 1号兔多抗血清抑制曲线Fig.3 The inhibitive curve of polyclonal antiserum of rabbit No.1
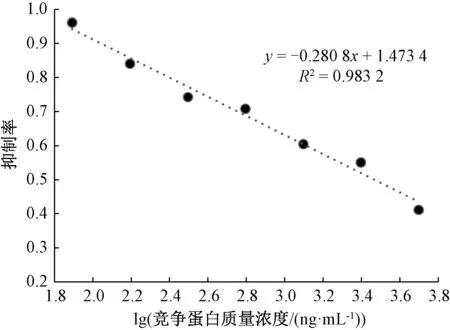
图4 3号兔多抗血清抑制曲线Fig.4 The inhibitive curve of polyclonal antiserum of rabbit No. 3
2.2.3 多抗血清特异性鉴定
选取免疫效果最好的1号兔的多抗血清进行特异性分析,根据大豆球蛋白多抗血清的IC50值为527 ng/mL,间接竞争ELISA试验发现,制备的多抗血清与花生蛋白和β-伴大豆球蛋白的交叉反应率为4.6%和8.6%,这可能是大豆蛋白与花生蛋白具有潜在同源性,与麦朊蛋白和芝麻蛋白的交叉反应率均小于0.2%,基本无交叉反应,证明所制备的兔源多抗血清具有较高的特异性。
2.2.4 纯化前后多抗血清的SDS-PAGE
由图5可知,1和2泳道为多抗血清纯化前后的蛋白条带,纯化之后仍含有部分杂蛋白,相比纯化前可以明显看出经硫酸铵分级沉淀纯化后,多抗血清中的大部分的杂蛋白被去除,即图1泳道中的蛋白分子量较大的部分被去除,结果显示多抗血清中所含的IgG抗体的纯度提高。
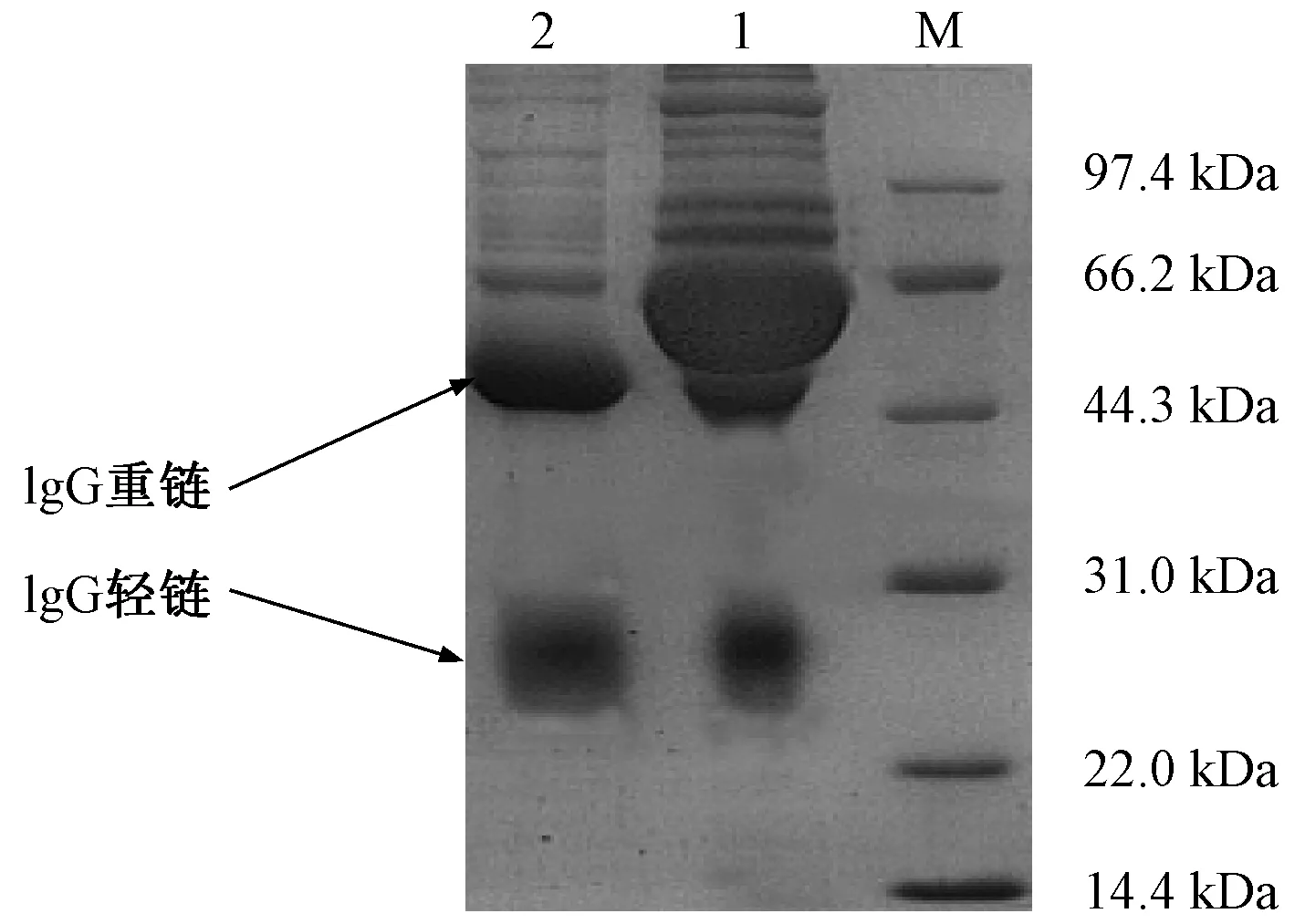
注:M为Marker;1为纯化前的多抗血清;2为纯化后的多抗血清。图5 纯化前、后血清IgG含量Fig.5 Serum IgG contents before and after purification
2.2.5 大豆球蛋白的Western blot 鉴定
如图6所示,大豆球蛋白Western blot测定结果表明蛋白与多抗血清结合,证明成功制备了大豆球蛋白兔源多抗血清,并且提取过程并未破坏大豆球蛋白的抗原表位,纯化后的蛋白能和多抗血清反应,经纯化后的大豆球蛋白具有免疫活性。
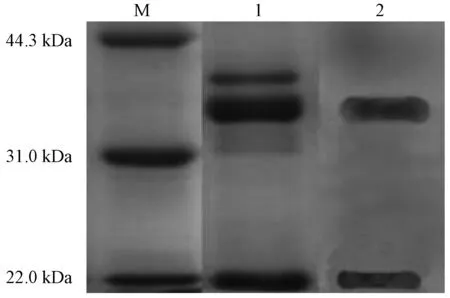
注: M为低分子量Marker;1为11S;2为11S Western blot。图6 大豆球蛋白与多抗结合Western blot图谱Fig.6 Identification of soybean glycinin and polyconal antiserum by Western blot
3 结论
本研究对大豆球蛋白进行提取纯化,测定蛋白纯度达81%,多抗血清中含有较多的杂蛋白和其他成分,不同浓度的盐离子可以使不同的蛋白质发生沉淀,选择硫酸铵是因其具有易溶解、不容易使蛋白质变性的优点,经过硫酸铵分级沉淀法对大豆球蛋白多抗血清进行纯化,蛋白电泳试验表明大部分的杂蛋白被除去。免疫学特性结果显示,1号兔的多抗血清效价1∶ 6 ×104,3号兔的多抗血清效价1∶5.8 ×104,对效价较高的1号和3号测定敏感性,1号兔的多抗血清对大豆球蛋白的IC50为527 ng/mL,3号兔对大豆球蛋白的IC50为582 ng/mL,即1号兔的多抗血清敏感性更高。总体来说1号兔的免疫效果优于3号兔。选取1号兔进行特异性分析,发现所制备的多抗血清与芝麻蛋白和麦朊蛋白交叉反应率几乎为零,与花生蛋白和β-伴大豆球蛋白交叉反应率为4.6%和8.6%。对制备的大豆球蛋白多克隆抗体进行全面免疫学特性分析,得到了效价高、敏感性好的多抗,并对抗体进行了初步纯化,免疫印迹表明大豆球蛋白具有免疫活性,所制多抗为大豆球蛋白不同种致敏性亚基的结构定位以及研究大豆致敏蛋白中的大豆球蛋白快速检测提供了基础条件。

