鹿皮胶的毒理安全性评价研究
孙琪瑶,康樱樱,王庆,沈明浩
(吉林农业大学食品科学与工程学院,吉林长春130118)
鹿皮作为一种中药,无毒,具有补气补血、补肾等多种功效。因此,鹿皮常被用于开发鹿皮胶和各种营养保健品[1-4]。鹿皮胶是由梅花鹿或马鹿的皮制成[5],可治疗溃疡、妇女白带、出血、肾虚滑精等各种疾病[6]。还具有增加白细胞的功能,能显著提高动物的免疫功能,具有滋阴、润燥、养血、止血的作用。其功效在《本草纲目》[7]和《四川中药志》中均有记载。而现代郭骏骐[8]、杨丽等[9]对鹿皮胶的研究进一步证实了鹿皮胶具有补血、增强免疫力的作用。目前,国内对鹿皮胶的研究主要是从药理角度进行的,主要研究了其补血和免疫调节功能,以及能够显著提高血清睾酮的相关功能[10]。而关于是否还有其他功能,国内外鲜有鹿皮胶功能研究的报道。
鹿皮胶作为食材的开发利用缺乏明确的毒理安全评价资料。在其大量使用之前还需要进行更全面、更深入的研究。因此我们对鹿皮胶进行了急性毒性实验、亚慢性毒性实验、骨髓细胞微核实验、精子畸形实验和Ames 试验等毒理学试验[11],以初步了解鹿皮胶是否具有食用安全性,这对鹿皮胶产品的日后开发利用具有重要意义。
1 材料与仪器
1.1 材料与试剂
鹿皮胶:吉林海王健康生物科技有限公司;顶层培养基、底层培养基、肉汤培养基:北京谱析科技有限公司;鼠伤寒沙门氏菌(Salmonella typhi-murium)(组氨酸营养缺陷型菌株 TA97、TA98、TA100、TA102 菌株):军事医学科学院毒物药物研究所;环磷酰胺:江苏恒瑞医药股份有限公司;苦味酸、伊红染色液:南京建成生物工程研究所;氯化钠、甘油、无水乙醇;浓盐酸:北京化工厂;小牛血清:Dr.Ehrenstorfer 公司;吉姆萨应用液、敌克松(Dexon)、1,8-二羟基蒽醌(1,8-HAQ):Dr.Ehrenstorfer 公司;叠氮钠(NaN3):Solarbio 公司;2-氨基芴(2-AF):Lancaster 公司;大鼠代谢活化酶(S9):Moltox 公司。
1.2 主要仪器
DHG-9140A 电热鼓风恒温干燥箱:杭州蓝天仪器有限公司;CCT-3320 超纯水机:四川卓越水处理设备有限公司;DS-671 电子秤:上海寺冈电子有限公司;CM1900 冷冻切片机、XSZ-7G 细胞计数器、XS212-202双目生物显微镜:重庆光电仪器有限公司;BS-180 全自动生化分析仪:深圳迈瑞生物医疗电子股份有限公司;OLYMPUS CX21 生物显微镜:日本日立公司;NikonE2000 型光学显微镜:Nikon 公司。
1.3 实验动物
昆明种小白鼠:辽宁长生生物技术股份有限公司,SPF 级,体重约 18 g~22 g,4 周龄~6 周龄,使用许可证号:SCXK(辽)2015-0003。
1.4 方法
1.4.1 小鼠急性毒性实验
1.4.1.1 预试验
根据经验和文献寻找动物100%、0%死亡剂量。在试验前,取60 只健康小鼠单纯禁食16 h。将小鼠随机分为6 个剂量组,每组10 只。标记小鼠并精确称重。鹿皮胶样品分设6 个梯度剂量,灌胃给药量为0.2 mL/10 g,以确定引起动物 0%(Dn)和 100%(Dm)死亡的剂量。观察2 周,记录小鼠中毒和死亡情况,为正式试验提供参考。
1.4.1.2 正式试验
根据相关要求,应用寇氏(Korbor)法[12]进行小鼠急性毒性正式试验。选取70 只健康小鼠,雌雄各半。将小鼠随机分为6 个剂量组和空白对照组。标记小鼠并精确称重。根据初步试验得到的剂量结果,计算出6 个剂量组:15.0、12.5、10.0、7.5、5.0、2.5 g/kg 。配置所需浓度,一次性分别灌胃给予鹿皮胶提取物,采用两次等容灌胃给药,给药体积为0.2 mL/10 g,对照组灌胃给予生理盐水。观察给药后反应,记录14 d 动物毒性反应及死亡情况。死亡动物及时尸检,观察各器官的变化。
1.4.2 小鼠亚慢性毒性实验
参照三七的经口急性毒性及亚慢性毒性研究[13]实验方法,将80 只小鼠随机分为4 组:每组20 只,雌雄各半,分别为实验组1~3 组,即高、中、低剂量组和第4 组空白对照组。实验组分别以人体摄入量的100、50倍和10 倍剂量灌胃。鹿皮胶样品的剂量分别为10.0、5.0、1.0 g/kg。空白组每天定期给小鼠9 g/L 生理盐水。每组连续喂养30 d 后剖杀采样,并进行相关指标的测定。
1.4.3 小鼠骨髓细胞微核实验
将50 只昆明小鼠随机分为5 组,每组10 只,雌雄各半。鹿皮胶的3 种剂量分别为10.0、5.0、2.5 g/kg 剂量组,以经口灌胃方式给予受试物X。采用4 次染毒方法,各组小鼠在最后一次给药后第2 天处死。每只小鼠计数200 个嗜多染红细胞,并对成熟红细胞计数,计算骨髓嗜多染红细胞(polychromatic erythrocytes,PCE)与成熟红细胞(mature erythrocyte,NCE)比值。每只小鼠通过计数1 000 个嗜多染红细胞的方法进行评估,计算微核发生率(‰):
嗜多染红细胞微核率/‰=含微核的嗜多染红细胞数/嗜多染红细胞总数×1 000。
1.4.4 小鼠精子畸形实验
参照灵芝功能性食品遗传毒理学实验[14],鹿皮胶样品的3 个剂量分别为10.0、5.0、2.5 g/kg (分别是人体摄入量的 100、50、25 倍)剂量组,然后以 0.02 mL/g体积对动物进行灌胃,阴性对照组给予同样体积的纯水,阳性对照组给予同样体积的2 mg/mL 环磷酰胺溶液。连续5 d,每天给药一次。最后一次给药后的第30 天处死动物,取副睾丸的精子涂片,甲醇固定,伊红染色。计数1 000 个精子,并计算精子畸形发生率:
精子畸形发生率/%=精子畸形总数/检查精子总数×100
1.4.5 Ames 试验
鹿皮胶样品在0.103 MPa 下高温灭菌20 min,无菌条件下用无菌蒸馏水稀释。将样品制成如下5 个剂量组,分别为 5 000、1 000、200、40、8 μg/皿。阴性对照组蒸馏水用量为0.1 mL/皿。阳性对照组试剂采用敌克松、叠氮钠、2-氨基芴和1,8-二羟蒽醌,在加与不加S9 混合物状况下,试验均采用平板掺入法进行。制备顶层培养基,并分装于无菌小试管内2 mL,在45 ℃水浴中保温。依次加入0.1 mL 新鲜菌液,混匀,加0.1 mL受试物,混匀。快速倒入底部培养基中,旋转平皿,平放固化,37 ℃培养48 h。每个剂量做3 个平行皿,阳性试验结果做3 次测试,阴性试验结果做两次测试。
1.5 数据分析
2 结果与分析
2.1 小鼠急性毒性实验结果
2.1.1 小鼠急性毒性症状及死亡情况
鹿皮胶样品急性毒性实验死亡动物数见表1。
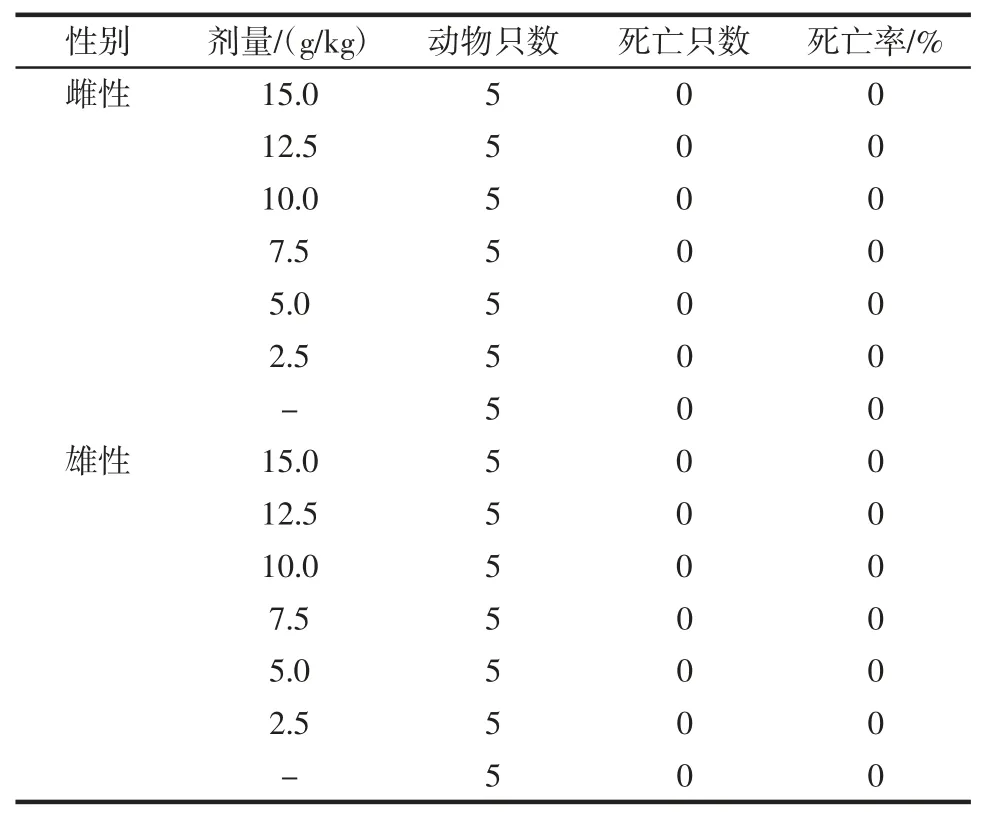
表1 鹿皮胶样品急性毒性实验死亡动物数Table 1 Number of dead animals in acute toxicity test of deer hide glue samples
试验观察期间,对照组和剂量组小鼠均处于良好状态,无明显不良反应和死亡情况。饲养结束后,解剖小鼠,肉眼观察各器官无病变情况。由表1 可知,鹿皮胶样品剂量为15.00 g/kg 时,动物未出现死亡,说明鹿皮胶样品的经口急性毒性LD50>10.00 g/kg,可知鹿皮胶样品属于无毒物质。
2.1.2 小鼠体重变化情况
对小鼠给药后,观察药物对小鼠的体重质量的变化情况见表2。

表2 给药后小鼠体重质量变化Table 2 Changes of body mass in mice after administration
如表2 所示,小鼠体重变化情况在小鼠急性毒性实验中,各组小鼠的初始体重相近,2 周后,空白组体重增加显著。说明正常情况下,实验动物体重应持续增加。剂量组和对照组的雄、雌小鼠的初始体重、7、14 d 体重差异无统计学意义(P>0.05),说明灌胃剂量对小鼠体重影响并不明显。
2.1.3 小鼠主要脏器指数变化情况
脏器指数是实验动物的脏器重量与其自身体重的比值,评价器官和组织状态的重要指标。产生致敏t 细胞和浆细胞。鹿皮胶样品对小鼠脏器指数的影响分析见表3。
由表3 可知,空白对照组无明显异常,雄雌剂量组与空白对照组的心、肝、肾、脾进行比较,均无显著性差异(P>0.05)。
表3 给药后小鼠脏器指数的影响(,n=10)Table 3 Effect of administration on organ index in mice(,n=10)
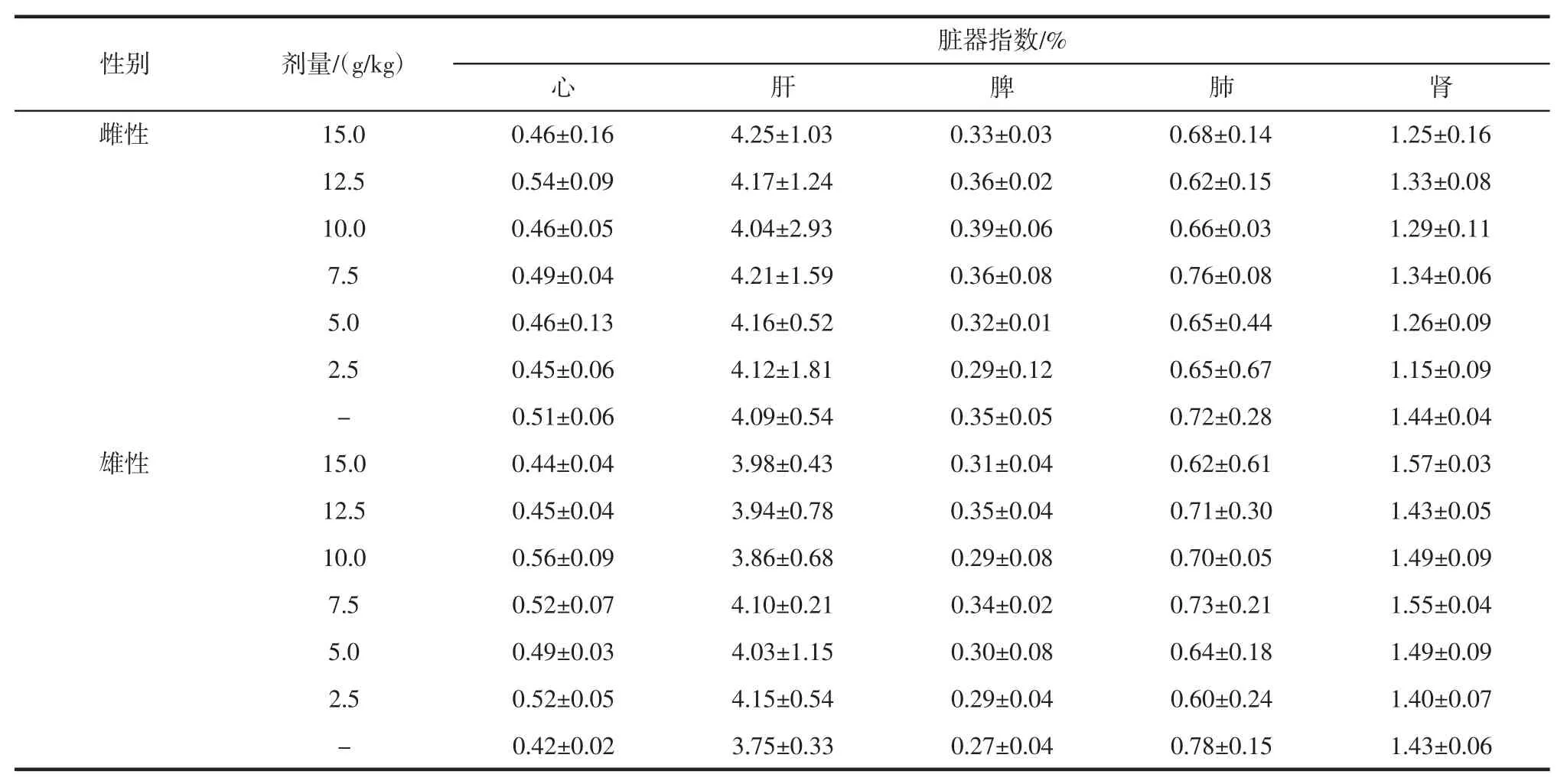
表3 给药后小鼠脏器指数的影响(,n=10)Table 3 Effect of administration on organ index in mice(,n=10)
注:-表示空白对照组。
性别剂量/(g/kg)脏器指数/%心肝脾肺肾雌性 15.0 0.46±0.16 4.25±1.03 0.33±0.03 0.68±0.14 1.25±0.16 12.5 0.54±0.09 4.17±1.24 0.36±0.02 0.62±0.15 1.33±0.08 10.0 0.46±0.05 4.04±2.93 0.39±0.06 0.66±0.03 1.29±0.11 7.5 0.49±0.04 4.21±1.59 0.36±0.08 0.76±0.08 1.34±0.06 5.0 0.46±0.13 4.16±0.52 0.32±0.01 0.65±0.44 1.26±0.09 2.5 0.45±0.06 4.12±1.81 0.29±0.12 0.65±0.67 1.15±0.09-0.51±0.06 4.09±0.54 0.35±0.05 0.72±0.28 1.44±0.04雄性 15.0 0.44±0.04 3.98±0.43 0.31±0.04 0.62±0.61 1.57±0.03 12.5 0.45±0.04 3.94±0.78 0.35±0.04 0.71±0.30 1.43±0.05 10.0 0.56±0.09 3.86±0.68 0.29±0.08 0.70±0.05 1.49±0.09 7.5 0.52±0.07 4.10±0.21 0.34±0.02 0.73±0.21 1.55±0.04 5.0 0.49±0.03 4.03±1.15 0.30±0.08 0.64±0.18 1.49±0.09 2.5 0.52±0.05 4.15±0.54 0.29±0.04 0.60±0.24 1.40±0.07-0.42±0.02 3.75±0.33 0.27±0.04 0.78±0.15 1.43±0.06
2.2 小鼠亚慢性毒性实验结果
2.2.1 鹿皮胶样品对小鼠体重的影响
对小鼠给药30 d 后,观察药物对小鼠的体重质量的变化情况见表4。
与对照组相相比,3 个剂量组雌雄大鼠的初始体重、1 周~4 周体重和 30 d 体重无显著性差异(P>0.05)。
2.2.2 鹿皮胶样品对小鼠食物利用率的影响
食物利用率是指实验动物每食入100 g 饲料所增长的体重克数。对小鼠给药30 d 后,观察药物对小鼠的食物利用率的影响情况见表5。
表4 鹿皮胶样品对小鼠体重的影响(,n=10)Table 4 Effect of deer hide dlue on body weight of mice(,n=10)

表4 鹿皮胶样品对小鼠体重的影响(,n=10)Table 4 Effect of deer hide dlue on body weight of mice(,n=10)
注:-表示空白对照组。
性别剂量/(g/kg)始重/g体重/g30 d/g第一周 第二周 第三周雄18.95±0.87 26.40±0.96 29.39±1.16 31.84±1.48 34.62±2.08 1.0 18.32±0.78 26.55±0.90 30.14±0.98 32.80±1.22 35.72±1.29 5.0 19.10±0.70 26.69±1.07 29.88±1.34 31.78±1.54 33.85±1.38 10.0 18.25±0.91 25.95±1.15 29.15±1.40 31.96±1.17 35.06±1.24雌-18.95±0.87 26.40±0.96 29.39±1.16 31.84±1.48 34.62±2.08 1.0 18.32±0.78 26.55±0.90 30.14±0.98 32.80±1.22 35.72±1.29 5.0 19.10±0.70 26.69±1.07 29.88±1.34 31.78±1.54 33.85±1.38 10.0 18.25±0.91 25.95±1.15 29.15±1.40 31.96±1.17 35.06±1.24-
表5 鹿皮胶样品对小鼠食物利用率的影响(,n=10)Table 5 Effect of deer hide dlue on food utilization rate in mice(,n=10)

表5 鹿皮胶样品对小鼠食物利用率的影响(,n=10)Table 5 Effect of deer hide dlue on food utilization rate in mice(,n=10)
性别 剂量/(g/kg) 总增重/g第一周食物利用率/% 第二周食物利用率/% 第三周食物利用率/% 第四周食物利用率/% 总食物利用率/%雄- 12.25±6.76 57.31±4.34 44.33±4.81 36.12±4.61 29.48±3.43 38.85±3.19 1.0 16.90±1.70 55.78±5.23 40.38±5.30 36.63±4.19 30.71±4.34 38.03±3.08 5.0 16.80±2.13 55.02±5.47 44.17±4.60 34.30±2.48 29.52±4.40 37.80±2.00 10.0 13.50±5.33 57.14±4.65 45.60±3.02 37.69±5.89 30.15±5.38 39.38±4.04
续表5 鹿皮胶样品对小鼠食物利用率的影响(,n=10)Continue table 5 Effect of deer hide glue on food utilization rate in mice(,n=10)

续表5 鹿皮胶样品对小鼠食物利用率的影响(,n=10)Continue table 5 Effect of deer hide glue on food utilization rate in mice(,n=10)
注:-表示空白对照组。
性别 剂量/(g/kg) 总增重/g第一周食物利用率/% 第二周食物利用率/% 第三周食物利用率/% 第四周食物利用率/% 总食物利用率/%雌- 12.25±6.76 53.12±3.95 29.68±3.10 17.61±2.51 14.29±3.99 25.35±1.74 1.0 16.90±1.70 50.52±4.35 26.61±5.70 20.21±5.29 14.43±2.74 24.49±2.55 5.0 16.80±2.13 50.16±5.01 24.92±7.55 18.50±3.48 12.55±3.12 23.27±2.79 10.0 13.50±5.33 47.80±6.08 25.55±6.57 18.39±4.51 13.44±4.32 23.26±3.13
与对照组比较,3 个剂量组雄性和雌性大鼠每周食物利用率和总食物利用率无显著性差异(P>0.05)。
2.2.3 鹿皮胶对小鼠脏器系数的影响
肉眼观察各组被剖杀的小鼠的主要脏器,观察是否出现病理变化。测定小鼠肝、脾、肾等主要器官的绝对重量,得出其脏器系数见表6。其中结果表明,各实验组脏器系数与空白对照组比较,差异无统计学意义(P>0.05)。各组测得的脏器系数均正常,由此可说明鹿皮胶样品对小鼠的脏器系数无不良影响。
2.2.4 鹿皮胶样品对小鼠血液生化指标的影响
血液生化指标数据对于评估药物对实验动物的器官功能或损伤改变情况起着决定性或提示性作用。对小鼠给药30 d 后,观察药物对小鼠的血液生化指标的影响见表7。与对照组比较,3 个剂量组雄性和雌性大鼠的血液学指标无显著性差异(P>0.05)。
表6 鹿皮胶对小鼠脏器系数的影响(,n=10)Table 6 Effect of deer hide glue on visceral coefficient in mice(,n=10)

表6 鹿皮胶对小鼠脏器系数的影响(,n=10)Table 6 Effect of deer hide glue on visceral coefficient in mice(,n=10)
注:-表示空白对照组。
性别剂量/(g/kg)脏器系数/%肝脾肾雄- 5.43±0.15 0.31±0.04 1.09±0.10 1.0 4.72±0.09 0.32±0.03 1.13±0.07 5.0 5.58±0.16 0.30±0.04 1.11±0.08 10.0 5.34±0.14 0.31±0.06 1.08±0.11雌- 5.39±0.24 0.40±0.05 1.04±0.07 1.0 5.33±0.14 0.36±0.03 1.16±0.10 5.0 5.50±0.25 0.32±0.09 1.12±0.08 10.0 5.04±0.16 0.36±0.01 1.23±0.06
表7 鹿皮胶样品对小鼠血液生化指标的影响(,n=5)Table 7 Effect of deer hide glue on blood biochemical indexes in mice(,n=5)

表7 鹿皮胶样品对小鼠血液生化指标的影响(,n=5)Table 7 Effect of deer hide glue on blood biochemical indexes in mice(,n=5)
注:-表示空白对照组。
性别剂量/(g/kg)血红蛋白/(g/L) 红细胞计数/(1012/L) (109/L) 中性粒细胞/% 淋巴细胞/% 血小板数/(109/L)雄-121.20±12.40 9.01±0.84 6.95±0.80 13.46±2.32 69.71±2.41 168.93±2.32白细胞计数/1.0 125.60±12.70 8.61±1.08 5.97±0.52 12.52±4.53 52.25±4.50 170.60±1.73 5.0 125.33±10.80 9.16±0.90 7.70±0.88 11.67±1.62 60.07±3.36 169.13±5.41 10.0 127.50±11.22 9.38±1.96 8.53±0.96 13.23±3.32 66.77±1.41 167.11±2.30雌-120.20±9.40 8.93±0.54 8.13±0.81 12.75±3.57 72.23±2.40 149.65±5.75 1.0 125.00±4.60 9.10±1.09 9.26±0.52 11.31±3.07 81.82±3.52 150.82±3.85 5.0 133.67±7.83 9.31±0.90 8.50±0.77 13.21±1.41 75.30±3.90 145.73±1.42 10.0 126.67±12.19 8.65±0.96 7.62±0.57 13.41±1.62 69.70±4.20 142.72±5.51
2.2.5 鹿皮胶样品对小鼠血液生化指标的影响
鹿皮胶样品对小鼠血液生化指标检验结果见表8。经统计学处理,与对照组相比,3 个剂量组的末期血生化指标检测结果中,雄鼠高剂量组总蛋白明显升高(P<0.05),其余指标均无显著性差异(P>0.05)。上述测量值均在本研究的正常范围内。
2.2.6 病理学检查
随机解剖各组中的5 只小鼠,观察药物对小鼠内脏器官的影响。如图1~图3 所示。肝、肾、脾的形态、颜色、质地未见异常变化,组织病理学检查未见明显异常病理变化。由此可见,鹿皮胶样品对小鼠内脏器官无不良影响。
2.3 小鼠骨髓细胞微核实验结果
微核试验用于检测受试物在哺乳动物所引起的染色体或原红细胞有丝分裂器损伤,以确定该受试物有无诱变性。对小鼠给药30 d,观察药物对小鼠骨髓嗜多染红细胞微核发生率的影响结果见表9。由表9 可知,小鼠的骨髓嗜多染红细胞微核率在阳性对照物(环磷酰胺)中最高,与阴性对照组比较差异显著(P<0.01)。3 个受试物剂量组分别与相应的阴性对照组的微核率(以0.1%表示)进行比较,均无显著性差异(P>0.05),各个剂量组之间也无差异(P>0.05)。在本试验中,3 个剂量组鹿皮胶样品的小鼠骨髓细胞微核试验结果为阴性。
表8 鹿皮胶样品对小鼠血液生化指标检验结果(,n=5)Table 8 Testing results of blood biochemical indexes of mice with deer hide glue samples(,n=5)
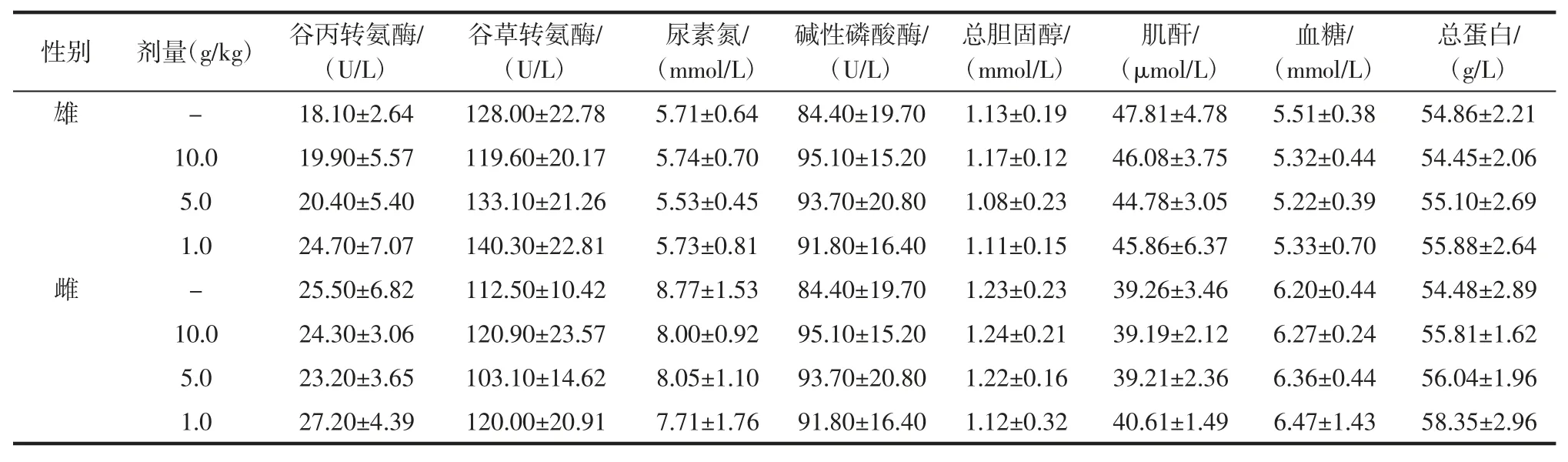
表8 鹿皮胶样品对小鼠血液生化指标检验结果(,n=5)Table 8 Testing results of blood biochemical indexes of mice with deer hide glue samples(,n=5)
注:-表示空白对照组。
性别 剂量(g/kg) 谷丙转氨酶/(U/L)总蛋白/(g/L)雄- 18.10±2.64 128.00±22.78 5.71±0.64 84.40±19.70 1.13±0.19 47.81±4.78 5.51±0.38 54.86±2.21 10.0 19.90±5.57 119.60±20.17 5.74±0.70 95.10±15.20 1.17±0.12 46.08±3.75 5.32±0.44 54.45±2.06 5.0 20.40±5.40 133.10±21.26 5.53±0.45 93.70±20.80 1.08±0.23 44.78±3.05 5.22±0.39 55.10±2.69 1.0 24.70±7.07 140.30±22.81 5.73±0.81 91.80±16.40 1.11±0.15 45.86±6.37 5.33±0.70 55.88±2.64雌- 25.50±6.82 112.50±10.42 8.77±1.53 84.40±19.70 1.23±0.23 39.26±3.46 6.20±0.44 54.48±2.89 10.0 24.30±3.06 120.90±23.57 8.00±0.92 95.10±15.20 1.24±0.21 39.19±2.12 6.27±0.24 55.81±1.62 5.0 23.20±3.65 103.10±14.62 8.05±1.10 93.70±20.80 1.22±0.16 39.21±2.36 6.36±0.44 56.04±1.96 1.0 27.20±4.39 120.00±20.91 7.71±1.76 91.80±16.40 1.12±0.32 40.61±1.49 6.47±1.43 58.35±2.96谷草转氨酶/(U/L)尿素氮/(mmol/L)碱性磷酸酶/(U/L)总胆固醇/(mmol/L)肌酐/(μmol/L)血糖/(mmol/L)

图1 鹿皮胶对亚慢性毒性小鼠肝组织的病理组织学观察Fig.1 Histopathological observation of deer hide glue on liver tissue of subchronic toxic mice

图2 鹿皮胶对亚慢性毒性小鼠脾组织的病理组织学观察Fig.2 Histopathological observation of deer hide glue on spleen tissue of subchronic toxic mice
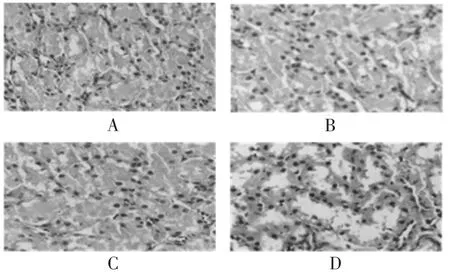
图3 鹿皮胶对亚慢性毒性小鼠肾组织的病理组织学观察Fig.3 Histopathological observation of deer hide glue on kidney tissue of subchronic toxic mice
表9 受试物对小鼠骨髓嗜多染红细胞微核发生率的结果(,n=10)Table 9 The results of micronucleus incidence of bone marrow polychromatic erythrocyte in mice(,n=10)

表9 受试物对小鼠骨髓嗜多染红细胞微核发生率的结果(,n=10)Table 9 The results of micronucleus incidence of bone marrow polychromatic erythrocyte in mice(,n=10)
注:与阴性对照相比,*表示差异极显著,P<0.01;-表示空白对照组。
组别 剂量/(g/kg)受试细胞数含微核细胞数 微核率/‰ PCE/NEC高剂量组 10.0 1 000 14 1.40±0.97 2.76/1中剂量组 5.0 1 000 11 1.10±0.88 2.93/1低剂量组 2.5 1 000 17 1.70±1.07 2.97/1阴性对照 - 1 000 13 1.30±1.16 3.01/1阳性对照 环磷酰胺 1 000 219* 21.9±7.62* 1.73/1*
2.4 小鼠精子畸形实验结果
每只动物观察到1 000 个完整的精子,精子畸形分为无定形、香蕉形、胖头、无钩、双头和双尾,分别记录畸形精子数见表10。各个样品剂量组与阴性对照组比较,差异无统计学意义(P>0.05),阳性对照组与阴性对照组比较,有显著差异(P<0.01)。不同剂量的小鼠精子畸形发生率无明显变化,说明该样品对小鼠精子畸形无影响。
表10 鹿皮胶样品对小鼠精子畸变的影响(,n=5)Table 10 Effect of deer hide glue on sperm aberration in mice(,n=5)

表10 鹿皮胶样品对小鼠精子畸变的影响(,n=5)Table 10 Effect of deer hide glue on sperm aberration in mice(,n=5)
注:与阴性对照相比,*表示差异极显著,P<0.01,-表示空白对照组。
组别剂量/(g/kg) 观察精子数 精子畸形数 畸形率/%阴性对照 - 1 000 74 1.48±0.23低剂量组 2.5 1 000 69 1.37±0.37中剂量组 5.0 1 000 89 1.78±0.29高剂量组 10.0 1 000 95 1.90±0.19阳性对照 环磷酰胺(40 mg/kg)1 000 335* 6.70±0.48*
2.5 Ames试验结果
Ames 试验结果是直接计数培养基上的突变菌落数,其检测鹿皮胶的体外致突变性见表11 和表12。在背景生长良好的条件下,试验组中的突变菌落数量增加一倍以上(即突变菌落数量等于或大于未处理菌落数量的2 倍)且存在剂量-反应关系,或至少有一个测试点具有可重复性和显著性差异,即认为该受试物诱变试验阳性。如表11 和12 所示,Ames 试验的结果均显示,与未处理对照组相比,鹿皮胶样品的5 个不同剂量组(5 000、1 000、200、40、8 μg/皿)对鼠伤寒沙门氏菌组氨酸缺陷型 4 菌株 TA97、TA98、TA100、TA102 有或无S-9 活化系统,其回变菌落数,均未超过自发回变菌落数的2 倍,并且阳性对照组菌落数均超过未处理对照组的2 倍(P<0.01)。结果表明,在体外试验中未发现致突变性。
表11 鹿皮胶样品第一次Ames 试验结果(,n=3)Table 11 First Ames test results of deer hide glue samples(,n=3)
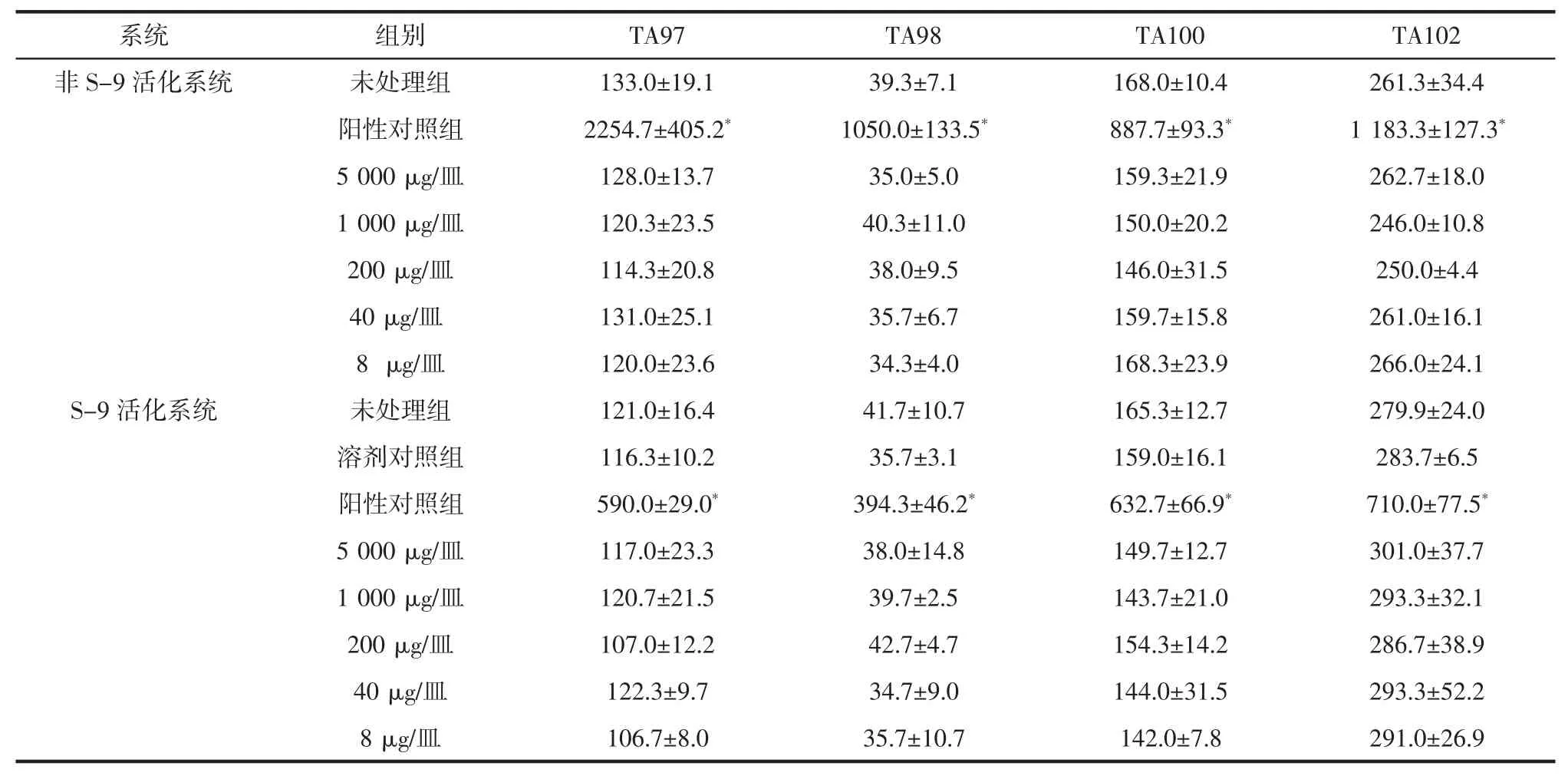
表11 鹿皮胶样品第一次Ames 试验结果(,n=3)Table 11 First Ames test results of deer hide glue samples(,n=3)
注:与溶剂对照组比,*表示差异极显著,P<0.01。
系统 组别 TA97 TA98 TA100 TA102非S-9 活化系统 未处理组 133.0±19.1 39.3±7.1 168.0±10.4 261.3±34.4阳性对照组 2254.7±405.2* 1050.0±133.5* 887.7±93.3* 1 183.3±127.3*5 000 μg/皿 128.0±13.7 35.0±5.0 159.3±21.9 262.7±18.0 1 000 μg/皿 120.3±23.5 40.3±11.0 150.0±20.2 246.0±10.8 200 μg/皿 114.3±20.8 38.0±9.5 146.0±31.5 250.0±4.4 40 μg/皿 131.0±25.1 35.7±6.7 159.7±15.8 261.0±16.1 8 μg/皿 120.0±23.6 34.3±4.0 168.3±23.9 266.0±24.1 S-9 活化系统 未处理组 121.0±16.4 41.7±10.7 165.3±12.7 279.9±24.0溶剂对照组 116.3±10.2 35.7±3.1 159.0±16.1 283.7±6.5阳性对照组 590.0±29.0* 394.3±46.2* 632.7±66.9* 710.0±77.5*5 000 μg/皿 117.0±23.3 38.0±14.8 149.7±12.7 301.0±37.7 1 000 μg/皿 120.7±21.5 39.7±2.5 143.7±21.0 293.3±32.1 200 μg/皿 107.0±12.2 42.7±4.7 154.3±14.2 286.7±38.9 40 μg/皿 122.3±9.7 34.7±9.0 144.0±31.5 293.3±52.2 8 μg/皿 106.7±8.0 35.7±10.7 142.0±7.8 291.0±26.9
表12 鹿皮胶样品第二次Ames 试验结果(,n=3)Table 12 Second Ames test results of deer hide glue samples(,n=3)

表12 鹿皮胶样品第二次Ames 试验结果(,n=3)Table 12 Second Ames test results of deer hide glue samples(,n=3)
系统 组别 TA97 TA98 TA100 TA102非S-9 活化系统 未处理组 129.3±8.5 45.0±12.5 174.3±36.5 254.3±13.5阳性对照组 2 085.7±294.9* 1 291.3±187.0* 760.3±113.8* 1 261.0±136.7*5 000 μg/皿 140.0±23.1 38.0±3.6 155.3±11.0 269.0±25.9 1 000 μg/皿 128.0±9.5 37.7±9.9 164.0±7.9 275.0±25.1 200 μg/皿 126.3±8.6 40.3±6.1 180.7±10.7 261.3±25.1 40 μg/皿 114.3±11.7 35.3±6.0 171.7±11.1 272.0±21.0 8 μg/皿 126.7±17.6 37.3±2.5 179.7±12.1 274.7±21.5
续表12 鹿皮胶样品第二次Ames 试验结果(,n=3)Continue table 12 Second Ames test results of deer hide glue samples(,n=3)

续表12 鹿皮胶样品第二次Ames 试验结果(,n=3)Continue table 12 Second Ames test results of deer hide glue samples(,n=3)
注:与溶剂对照组比,*表示差异极显著,P<0.01。
系统 组别 TA97 TA98 TA100 TA102 S-9 活化系统 未处理组 127.3±7.6 37.3±2.5 145.3±9.7 269.7±43.6溶剂对照组 123.7±15.3 38.7±6.7 154.0±9.6 276.0±11.1阳性对照组 547.0±109.3* 426.0±38.4* 577.3±93.3* 736.3±89.9*5 000 μg/皿 130.7±11.5 40.3±8.3 152.7±9.3 285.7±26.0 1 000 μg/皿 129.3±11.6 35.0±5.6 143.3±25.5 267.0±17.1 200 μg/皿 131.3±13.3 30.7±2.1 153.0±22.5 271.7±31.1 40 μg/皿 133.3±3.8 33.3±4.0 143.7±16.0 278.7±18.0 8 μg/皿 121.3±23.7 41.0±2.6 135.3±11.7 266.7±19.1
3 讨论
试验可知鹿皮胶样品的小鼠经口急性LD50>10 g/kg,所以鹿皮胶属于无毒物质。各个灌胃剂量对小鼠的质量、脏器指数、肝、肾功能无显著影响,初步说明鹿皮胶样品具有较高的食用安全性。亚慢性毒性试验中,各剂量组与对照组在血常规、血液生化指标、脏器系数、病理组织学等方面均无明显差异,说明鹿皮胶样品在合理使用范围内不会对受试动物产生慢性毒性。
本研究参考陈文学等的相关毒理学试验[15,19],采用小鼠骨髓嗜多染红细胞微核试验,对鹿皮胶样品致突变作用进行了评价。结果表明,在雌雄兼有小白鼠,剂量低于10 g/kg 的鹿皮胶样品不能引起小鼠雌雄骨髓细胞微核率升高,不具有致突变作用。精子畸形试验结果表明,各剂量组小鼠精子畸形无异常,表明鹿皮胶样品在此次试验条件下对雄性小鼠无生殖毒性。Ames 试验[20]结果表明鹿皮胶样品5 个剂量对鼠伤寒沙门氏菌组氨酸缺陷型4 菌株均无致突变作用。可判定鹿皮胶样品的Ames 试验结果为阴性。

