糖尿病肾病足细胞损伤的表观遗传调控
周 乐 郭兆安 综述 李 伟 审校
表观遗传修饰是指在核苷酸序列不发生改变的情况下,基因的表达水平和功能发生可遗传的改变,包括DNA甲基化、组蛋白转录后修饰、非编码RNA(non-coding RNA,ncRNA)。表观遗传学的改变导致了靶细胞高糖“代谢记忆”的产生,从而导致了糖尿病肾病(DN)等并发症,而足细胞损伤是DN进展的核心事件,因此,探索足细胞损伤的表观遗传调控机制,对于DN的诊疗意义重大。
DNA甲基化
DNA甲基化是指在DNA甲基转移酶(DNA methyltransferases,DNMTs)的催化下将甲基转移给启动子区CpG岛的胞嘧啶5’-碳原子,形成甲基化的胞嘧啶,阻碍转录因子与启动子结合以抑制转录[2]。目前研究已发现高糖微环境导致的DNA甲基化改变在DN的病程进展中发挥了重要作用。
足细胞结构DNA甲基化异常可改变足细胞结构和功能的完整性,从而导致蛋白尿的发生。足细胞裂孔膜上的跨膜蛋白nephrin和podocin对维持足细胞裂孔膜的正常功能及足突的完整性非常重要。高糖可造成多种因子的表达发生变化,进而通过干扰nephrin启动子甲基化水平对足细胞结构和功能产生影响。例如,DN动物模型的足细胞中转录因子Kruppel样因子4 (KLF4)表达减少, KLF4过表达可导致nephrin启动子区域的去甲基化,从而增加nephrin启动子活性。同时,编码间充质标志物-波形蛋白的启动子甲基化增加,进而抑制波形蛋白的表达[3]。因此,足细胞表观基因组可作为直接干预靶标来减少蛋白尿。
赖氨酸乙酰转移酶KAT5介导的DNA损伤修复对足细胞维持正常的功能至关重要,DN足细胞中KAT5表达减少,而DNA双链断裂和甲基化增加,通过基因转移恢复KAT5可减弱蛋白尿,同时,KAT5在相同的nephrin启动子区域减少DNA双链断裂和甲基化,表明KAT5介导的DNA修复可能与DNA甲基化状态有关,KAT5可能是DN的治疗靶点[4]。
DNA甲基化主要受DNMTs的调节,其中DNMT1的主要作用是维持DNA复制时的甲基化水平,DNMT1的表达水平、活性及其与基因启动子区的结合均可能影响对靶基因的调控。高糖可使小鼠足细胞DNMT1蛋白表达增加同时减少nephrin、podocin的表达,经DNA甲基化抑制剂处理后,两种膜蛋白表达上调,提示降低DNMT1对高糖刺激下的足细胞具有保护作用,抑制DNA甲基化或许是DN的另一种治疗方法[5]。
足细胞凋亡目前已发现多个足细胞基因的表达受到表观遗传选择性调节,从而直接或间接的影响足细胞功能。有研究对暴露于高糖条件下的足细胞中进行了DNA甲基化和转录组学分析[6],发现谷氨酸离子型受体AMPA型亚基3(GRIA3)的表达受到抑制,而DNMT抑制剂可消除这种抑制。通过GRIA3启动子区域的测序也证实了DNA高甲基化的位点,GRIA3的敲低加剧了足细胞凋亡。这些结果表明了糖尿病患者足细胞GRIA3因DNA甲基化变化而表达下调,进而促进了足细胞凋亡和丢失。
DNA甲基化与足细胞上皮间充质转化上皮间充质转化(EMT)是DN足细胞损伤的重要形式,表现为正常的上皮细胞标志物表达减少,而间充质细胞标志物表达增加。基质金属蛋白酶9(MMP9)的异常表达与DN足细胞EMT相关。高糖处理足细胞可上调MMP9、α-肌动蛋白和纤连蛋白-1的表达,同时下调糖萼蛋白的表达,MMP9启动子区域显示含有多种去甲基化的CpG位点,且高糖处理降低了MMP9启动子甲基化的速率。由此,MMP9启动子的去甲基化状态或可作为DN的重要预后标志物[7]。
由此推测,从DNA 甲基化角度干预DN,一方面需要进一步剖析DNA甲基化的启动、扩展及消除的规律,明确作用靶点,另一方面可尝试通过改变DNMTs的水平或活性等方法改变关键基因启动子区甲基化, 从而延缓DN进程。
组蛋白转录后修饰
组蛋白转录后修饰在肾脏病领域的作用逐渐受到关注,目前研究最多的是发生在组蛋白H3和H4的一些特定氨基酸残基上的乙酰化和甲基化修饰(图1)。
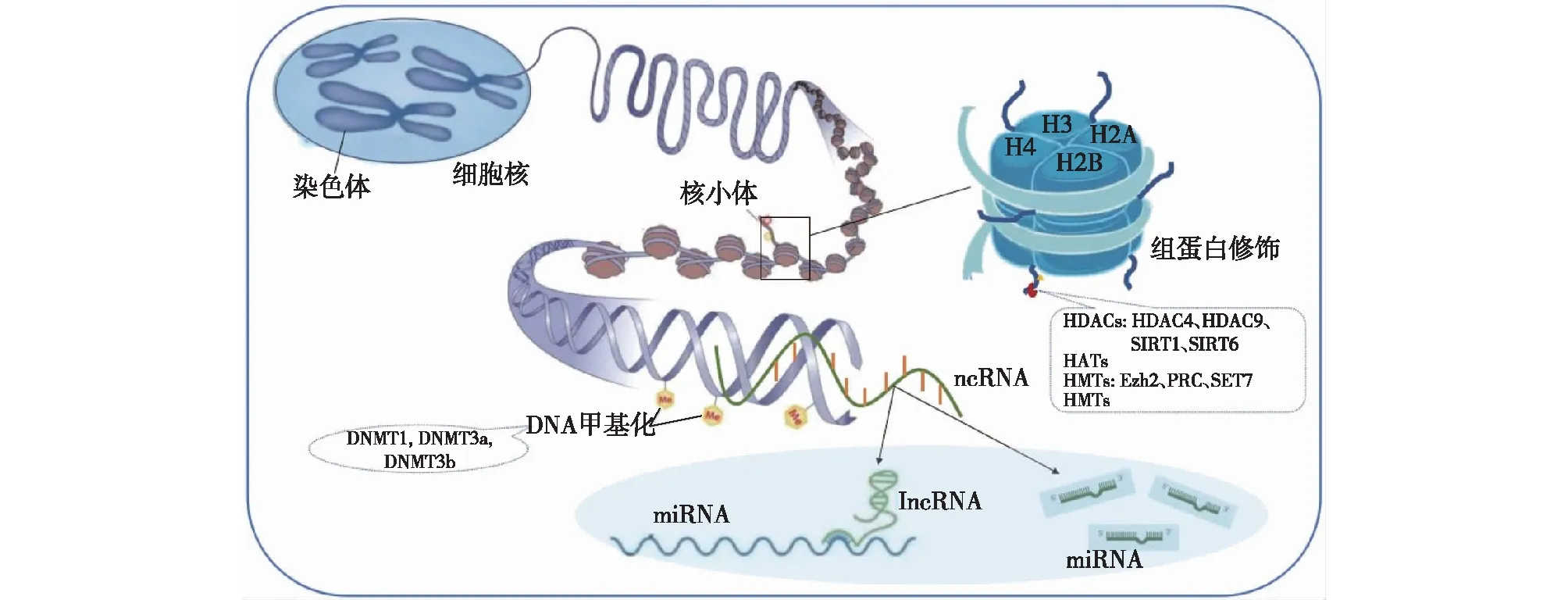
图1 糖尿病肾病足细胞损伤的表观遗传修饰示意图
足细胞自噬及炎症损伤组蛋白去乙酰化转移酶(HDACs)在DN进程中发挥了重要作用。HDACs有多个亚型,不同亚型分布及作用不尽相同,其中HDAC4在促进足细胞炎性反应及调节细胞稳态方面具有关键作用。HDAC4通过降低信号转导和转录激活因子1(STAT1) 的乙酰化水平,激活相应炎性基因的转录与表达,抑制足细胞自噬并加剧炎性反应,导致足细胞损伤[8]。HDAC9在高糖处理的小鼠足细胞中表达显著上调,而敲低HDAC9后则发现其通过Janus激酶2/STAT3途径显著抑制高糖诱导的活性氧产生,抑制了细胞凋亡和炎症[9]。这些研究提示了HDAC的改变会影响DN的进展,而抑制HDAC可能是DN的潜在治疗方法。例如,HDAC抑制剂VPA可通过干预核因子κB(NF-κB)介导的诱导型一氧化氮合酶(eNOS)活化,促进自噬,改善足细胞损伤[10]。
Sirtuins(SIRT)家族属于Ⅲ类HDAC,共有SIRT1- SIRT7七个成员,目前研究已发现SIRT1和SIRT6在减轻DN足细胞损伤中发挥了重要作用。SIRT1具有保护肾小球滤过屏障、抗氧化应激、抗肾纤维化以及调节线粒体功能和能量代谢的作用。SIRT1可下调足细胞中紧密连接蛋白Claudin-1的表达,后者进一步下调缝孔蛋白从而造成足细胞脱落[11]。足细胞特异性敲除SIRT1能够加重蛋白尿和肾脏损伤,SIRT1通过影响NF-κB的p65亚型和STAT3乙酰化水平,加重足细胞炎症反应,使用乙酰化抑制剂阻断p65和STAT3的乙酰化后,蛋白尿和肾损伤减轻,由此推断靶向蛋白乙酰化可能是DN的潜在疗法[12]。
Sirt6在足细胞中也发挥了多重保护作用,包括抗炎、抗细胞凋亡、稳定细胞骨架及促进足细胞自噬。Sirt6可通过Notch信号传导的表观遗传调控——改变Notch1和Notch4启动子区域H3K9位点的乙酰化水平,抑制Notch1和Notch4转录以及下游信号通路的激活,增加自噬通量,从而保护足细胞免于凋亡和炎症[13]。Sirt6还可降低尿激酶纤溶酶原激活物受体的表达,后者是足细胞足突消失和蛋白尿的关键因素。
足细胞损伤组蛋白甲基化由组蛋白赖氨酸甲基化转移酶(HMTs)如 Ezh2、 PRC、 SET7 介导,组蛋白甲基化比乙酰化更加稳定和持久。高糖可通过诱导EZH2的表达下调,促进转录因子Pax6启动子的H3K27me3上调,继而减弱了对Pax6的抑制作用,致使内源性抗氧化抑制剂硫氧还蛋白互作蛋白的表达升高,加剧足细胞氧化应激[14]。Set7为特异性的单甲基化酶靶向作用于H3K4,且Set7富集于NF-κB p65基因的启动子区激活转录,若沉默或敲除Set7,则高糖无法诱导p65基因的高表达。,表明高糖致NF-κB表达增加可能是通过Set7催化H3K4实现的[15]。
非编码RNA
非编码RNA(ncRNA)是不被翻译成蛋白质的一类功能性RNA[16],可在多个遗传学层面调控基因表达,影响DN进程。目前的研究文献中,ncRNA对DN足细胞损伤的影响研究最多,是检出率最高的表观遗传调控方式。ncRNA分两类,其一是短链ncRNA,主要为微小RNA( microRNAs,miRNA),另一是长链ncRNA(long non-coding RNA,LncRNA)。
lncRNA与足细胞损伤lncRNA在DN病理机制中的作用越来越被关注。已证实有数百种lncRNA在DN中失调,并且这些lncRNA可能通过调节多种分子途径而促成DN的发生发展。
lncRNA对足细胞凋亡及自噬具有调控作用。lncRNA Gm5524和Gm15645可能通过调节DN中的B淋巴细胞瘤-2/BCL2家族成员BAX(Bcl2/BAX)和微管相关蛋白1轻链3 /自噬相关蛋白(LC3/Atg)信号通路影响足细胞凋亡和自噬过程。在敲低Gm5524和过表达Gm15645的足细胞中,抗凋亡蛋白Bcl-2表达降低,而促凋亡蛋白Bax表达增加。另外,Gm5524和Gm15645的表达改变也影响了确定自噬激活的标记物(LC3II/LC3I)。因此,Gm5524和Gm15645介导的自噬和凋亡信号通路的调节可能是开发DN替代治疗策略的潜在靶点[17]。
lncRNA参与了足细胞内质网应激和线粒体功能障碍。LINC01619在足细胞胞质中表达并参与了内质网应激信号通路。在糖尿病大鼠和高糖培养的足细胞中,LINC01619作为竞争性内源性RNA,通过调节DN中miR-27a/叉头转录因子1(FOXO1)信号通路,触发了内质网应激和足细胞损伤,使足细胞凋亡增加和足突弥漫性消失[18]。过氧化物酶体增殖物激活受体γ(PPARγ)共激活因子α(PGC-1α)在线粒体生物能量学和呼吸中具有核心作用,是线粒体功能障碍和DN进展的关键介质,其在糖尿病中表达通常是降低的, LncTUG1通过与足细胞中的PGC-1α之间的相互作用,促进了PGC-1α与其自身启动子的结合,使PGC-1α转录表达增加,从而改善足细胞线粒体生物能量学[19]。
lncRNA通过调控足细胞EMT及影响细胞结构导致足细胞损伤。lncRNA ENSRNOG00000037522在DN足细胞EMT中起关键作用,敲低ENSRNOG00000037522可通过调节波形蛋白、糖萼蛋白和nephrin表达而修复足细胞损伤[20]。β连环蛋白(β-catenin)是Wnt信号通路中的关键介质,其异常表达促进了足细胞功能障碍和蛋白尿发生并导致肾纤维化。lncRNA MALAT1在DN中表达增加,致使β-catenin转位至细胞核,增强MALAT1连接蛋白丝氨酸/精氨酸剪接因子1(SRSF1)的表达,使p-钙黏蛋白和紧密连接蛋白ZO-1的表达降低,引发足细胞结构损伤,研究同时发现β-catenin通过与MALAT1的启动子区域结合参与了MALAT1转录,β-catenin敲低也降低了MALAT1水平,表明MALAT1和β-catenin之间存在新的反馈调节。这些发现为MALAT1在DN和高糖诱导的足细胞损伤中的关键作用提供了证据[21]。
miRNA与足细胞损伤miRNA在DN中的作用研究较多,miRNA通过不同分子和信号传导途径参与了DN进程中细胞凋亡、纤维化和细胞外基质积聚等过程[22]。miRNA也参与了足细胞损伤的机制,或促进细胞损伤进程,或起保护作用。
部分miRNA的表达上调会促进足细胞损伤进程。miR-29c在暴露于高糖条件的小鼠足细胞中上调,且 miR-29c的上调与炎性细胞因子的增加呈正相关,miR-29c直接靶向TTP并加重DN炎症反应[23]。 miR-27a通过PPARγ/β-catenin信号轴介导了DN足细胞损伤。高糖刺激使miR-27a表达增加,通过负向靶向PPARγ,激活β-catenin信号传导,并且下调足细胞podocin和特异性突触连接蛋白的表达,从而损伤足细胞[24]。miR-21通过调节磷酸酶和张力蛋白同源物(PTEN)增加足细胞运动性。miR-21的体内和体外抑制消除了大多数DN表现,包括系膜扩张、间质纤维化、足细胞消失和蛋白尿[25]。miR-218在高糖处理的足细胞中表达水平升高,其通过下调血红素氧合酶1(HO-1)及促进p38丝裂原活化蛋白激酶(p38-MAPK)的激活引发了足细胞凋亡[26]。还有一些miRNA则具有足细胞保护作用(表1)。

表1 非编码RNA参与糖尿病肾病足细胞损伤的机制
Atg:自噬相关基因; Bcl2:B淋巴细胞瘤2;Bax:BCL2家族成员;LC3:微管相关蛋白1轻链3;FOXO1:叉头转录因子1;SRSF1:丝氨酸/精氨酸剪接因子1;β-catenin:β连环蛋白;PPARγ:过氧化物酶体增殖激活受体 γ;PGC-1α: PPARγ共激活因子α;PTEN:磷酸酶及张力蛋白同源体; HO-1:血红素氧合酶 1; p38-MAPK:p38 丝裂原活化蛋白激酶;MTDH:异黏蛋白; HDAC4:去乙酰化转移酶4;EMT:上皮间充质转化;SRSF:丝氨酸/精氨酸剪接因子1
表观遗传修饰间相互作用
三种表观遗传方式对DN的调控并不是独立的,而是存在交叉对话、相互调控的作用。ncRNA受到组蛋白修饰和DNA甲基化的修饰,同时,ncRNA也可通过影响表观遗传过程中的关键酶HDAC、DNMT,直接控制表观遗传,由此,ncRNA与表观遗传修饰之间存在双向调控环。Fabbri等人首先发现miR-29家族(29a,29b和29c)可直接调节DNMT-3a和DNMT-3b并间接调节DNMT1,其他可调节DNMT的还有miR-148a/b,miR-152,miR-301,miR-302,miR-342[30]。除了DNMT之外,miRNA还调节组蛋白修饰因子,如miR-449和miR-1分别可以调节HDAC1和HDAC4,进一步发挥调控作用[31]。Lin等[32]研究发现,高血糖加速了足细胞损伤并减少了小鼠肾小球中的nephrin、乙酰化nephrin和miR-29a的水平,强化了HDAC4的作用,而miR-29a的过度表达减弱了HDAC4信号传导,恢复了nephrin乙酰化和足细胞稳态。在敲除miR-29后则出现了完全相反的结果。在体外,HDAC4信号传导的中断减轻了足细胞凋亡和对nephrin乙酰化的抑制, HDAC4本身通过miRNA的启动子区域中的H3K9Ac的低乙酰化状态,减少miR-29a的表达[31]。由此可见,增加miR-29a可维持足细胞微环境中乙酰化反应,预防糖尿病足细胞损伤。另外还发现,miR-155敲减可促进nephrin乙酰化并减轻高糖诱导的肾损伤[32]。miR-93过表达降低了高血糖诱导的足细胞中H3K14Ac的乙酰化,从而阻止足细胞损伤[33]。
小结:表观遗传修饰是DN的重要机制之一,不同表观遗传修饰之间通过交叉对话、相互作用,参与足细胞损伤过程,同时,表观遗传又是可逆的,通过治疗干预来改变表观遗传修饰可能是防治DN的一个重要方向。未来需要通过基因组学全面分析足细胞损伤的表观遗传修饰情况,在此基础上进一步研制特异性表观遗传调控药物,为DN治疗开辟新途径。

