应用18F-FDG PET/CT检查评价肝泡型包虫病肝内病灶活性研究*
韩为清,崔佳宾,杨予川
肝泡型包虫病(hepatic alveolar echinococcosis,HAE)是由多房棘球绦虫所致寄生虫感染性疾病,占肝包虫病的3%左右,早期缺乏典型的临床症状,但晚期多表现为恶病质,甚至引起肝衰竭[1]。目前,多采取手术和药物治疗HAE患者。阿苯达唑作为治疗HAE的一线药物,有资料显示,其脂剂药效高于片剂,治疗效果优于片剂,因脂剂生物利用度较高,能延长药物的半衰期,起到缓慢缓释的作用[2]。影像学诊断技术,包括超声和CT等检查,是评价阿苯达唑治疗HAE患者疗效的重要手段,但有报道称这些检查技术仅通过观察病灶大小、形态、内部回声和密度信号评价疗效,缺乏特异性,无法定量评价病灶的生物学活性状态[3]。另有研究表明,PET/CT检查具有分辨率高和解剖断面清晰的优点,可显示HAE病灶类型、大小、部位、形态、数目,经分析正电子放射性药物的摄取方式和放射性药物代谢能诊断HAE病灶的生物学活性[4]。采用18-氟脱氧葡萄糖(18F-fludeoxyglucose,18F-FDG)PET/CT检查可直接显示泡球蚴病灶的边界,分析病灶的放射性摄取和浓聚情况,能评估药物治疗肝泡球蚴的效果[5],通过观察18F-FDG治疗前后相关参数,为治疗效果评判提供依据。我们采用18F-FDG PET/CT检查评估了109例HAE患者在药物治疗后肝内病灶的活性情况,现将结果报道如下。
1 资料与方法
1.1 一般资料 2016年6月~2018年6月我院收治的HAE患者109例,男60例,女49例;年龄18~78岁,平均年龄为(51.7±9.0)岁。符合《肝两型包虫病诊断与治疗专家共识(2015年版)[6]诊断标准,经B超、CT或MRI等影像学检查诊断,未行病灶切除术或肝叶切除术。排除标准:(1)全肝泡型包虫病灶,呈弥漫性播散和转移;(2)伴肝功能衰竭、败血症;(3)肝外远处转移灶;(4)严重的心、肾、肺等重要脏器功能不全;(5)对造影剂及药物过敏者;(6)中、重度胆汁淤积,或肝硬化;(7)精神疾病;(8)孕妇或哺乳期妇女。患者签署知情同意书,本研究获得我院医学伦理委员会批准。
1.2 药物治疗 给予阿苯达唑脂质体(中国食品药品检定研究所)10 mg·kg-1·d-1,分2次口服,持续治疗6 m;对肝功能异常患者,初始给予5 mg·kg-1·d-1,待肝功能恢复正常后再调整为10 mg·kg-1·d-1,继续治疗至6 m。
1.318F-FDG PET/CT检查 嘱患者检查前1 d进食流质,停止服用可能影响检查的药物。检查前空腹、禁食6~8 h,行呼吸训练,减少呼吸运动幅度。使用Discovery VCT PET/CT显像装置(美国GE公司)。检查前,确保空腹血糖低于7 mmol/L,嘱患者保持平静。根据体质量,给予18F-FDG(美国GE公司,放化纯>95%)7.4 MBq.kg-1静脉注射,注射后20~30 min给予口服温开水800~1000 ml,1 h后排尿,再次口服温开水300 ml,确保胃肠道充盈,行PET/CT显像检查。自颅顶开始扫描,直达股骨中上段,设置CT扫描参数,管电流160 mA(延迟显像260 mA),电压120 kV,探测器准直64×0.625 mm,探测器螺距为0.983,层厚和层间距均为3.75 mm,0.6 ms/r,扫描20~30 s。基于CT同一扫描范围,采集PET三维图像,采集床位6~8个,2~3 min/床位。完成采集后,采用CT数据行PET图像衰减校正,应用有序子集最大期望值迭代法行图像重建,获取矢状面、冠状面、横断面、PET/CT融合图像。所有患者均于注射18F-FDG后3 h行延迟采集。先以目测法评价图像质量,分析患者全身是否存在异常放射性药物浓聚病灶,勾画肝脏病灶生物学边界,测量病灶边缘带最大标准放射性摄取值(maximum standardized uptake value,SUVmax),SUVmax=局部病灶组织摄入正电子显像剂药物放射性活度/全身平均放射性活度。PET/CT检查结果判断[7]:PET/CT示HAE病灶边缘带见放射性、不均匀性团块样和结节样浓聚,SUVmax较肝脏高,或病灶边缘带见放射性、均匀性环形放射性浓聚,则为病灶边缘浸润增殖带阳性,提示病灶活性增强。反之,病灶边缘带见放射性呈较均匀性环形分布,且呈稀疏减低影或缺损,SUVmax等于或低于肝脏,则为病灶边缘浸润增殖带阴性结果,病灶活动小。
1.4 病理学诊断[8]在根治手术后,取病变组织及周边组织行病理学检查和免疫组化检测,确定病变边缘浸润增殖带阳性:病灶边缘带见嗜酸性细胞、浆细胞、巨噬细胞和大量淋巴细胞浸润,形成肉芽肿,病灶边缘带相邻肝组织可见肝细胞受压明显、变性,小胆管内淤胆及增生,部分小血管壁炎性增厚,管腔纤维性闭塞、狭窄。根据Weidner法进行微血管计数,在低倍镜(40×)下整体观察病理切片,寻找3个微血管密度增高区域,再更换至高倍镜(200×)下观察3个视野,并对微血管密度进行计数,记录平均值。边缘带内微血管密度(microvascular density,MVD)计数>15个/高倍视野为边缘浸润增殖带阳性,≤15个/高倍视野为阴性。
1.5 统计学方法 应用SPSS 19.0软件处理数据,以百分率(%)表示计数资料,组间行x2检验,计量资料以±s)表示,组间行t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PET/CT检查表现 在109例患者中,病灶位于肝右叶者64例,位于肝左叶者32例,位于肝左右叶交界区者7例,病灶位于第一肝门区者6例;病灶最大直径<5 cm者12例,≥5 cm且<10 cm者28例,≥10 cm且<15 cm者42例,≥15 cm且<20 cm者17例,≥20 cm者10例。在药物治疗前行PET/CT检查,同机CT示病灶大部分属混杂密度占位,病灶内见液化坏死影、砂砾样、不定型钙化影,病灶边界与正常肝实质界限欠清;PET示病灶边缘见放射性分布浓聚影,其中不均匀团块样和结节样放射性浓聚(SUVmax高于肝脏)62例,病灶周边伴较均匀环形放射性分布浓聚影(SUVmax高于肝脏)15例(图1),放射性分布稀疏缺损或减低(SUVmax低于或等于肝脏)32例(图2);PET/CT检查显示病灶内钙化99例(90.8%),显示病灶边缘带内放射性浓聚影77例(70.6%);PET/CT检查显示HAE病灶呈混杂密度占位灶,形状不规则,内见钙化灶或液化性坏死区,边界不清晰,多呈侵袭性生长,病灶边缘带见放射性药物分布影,且高于肝脏,或者病灶内部未见明显的放射性分布,病灶边缘带见放射性药物分布影,且低于或等于肝脏。在阿苯达唑脂质剂治疗后6个月,行PET/CT检查显示肝内病灶较治疗前体积缩小,其中75例病灶周边放射性浓聚消失或明显降低,34例病灶边缘带放射性分布较治疗前轻度变淡,PET/CT所示治疗效果良好。
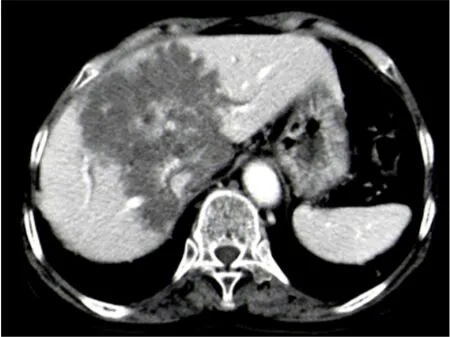
图1 肝包虫病患者治疗前18F-FDG PET/CT检查表现病灶边缘见18F-FDG摄取、强烈浓聚
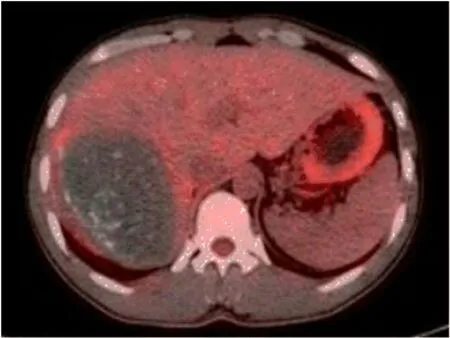
图2 肝包虫病患者治疗后18F-FDG PET/CT检查表现病灶边缘18F-FDG摄取少,无明显浓聚
2.2 阿苯达唑治疗前后HAE病灶边缘带SUVmax值变化情况 在阿苯达唑治疗后,109例患者病灶边缘增殖浸润带放射性分布SUVmax值为(3.6±1.4),显著低于治疗前的(4.9±1.9),差异有显著性统计学意义(t=5.751,P=0.000)。
3 讨论
目前,阿苯达唑属于治疗 HAE的首选药物[9,10],但应用后会出现一系列不良反应,如脱发、恶心、头晕、搔痒、转氨酶增高、中性粒细胞减少等[11]。既往研究报道未能切除病灶而长期服药的HAE患者停药后有1/3复发[12]。HAE患者长期口服阿苯达唑脂质体治疗后,病灶仍可能存在虫体生物学活性[13]。可见,评价HAE治疗后肝内病灶活性尤为重要。
PET/CT扫描作为一项行功能、代谢、受体扫描的新型分子显像技术,可在分子水平上动态观察代谢物质或药物进入人体后的动态变化。扫描常用的葡萄糖代谢放射性药物是18F-FDG。18F-FDG属临床常用的肿瘤代谢显像剂,通过观察肿瘤组织摄取18F-FDG的能力可评价乏氧程度、线粒体磷酸化水平和运转葡萄糖能力。PET/CT检查病灶边缘液化灶状态与病灶增殖状态具有良好的一致性,对于接受阿苯达唑或其他治疗的患者,PET/CT扫描可反映病灶及其边缘组织细胞生物学活性特点,评估治疗效果。使用PET/CT随访HAE病灶部位18F-FDG改变,发现病灶液化处边缘呈放射性核素稀疏下降,显示疾病呈稳定状态,而若病灶边缘自最初的放射性核素稀疏下降转变为局部浓聚,则提示病灶区或病变边缘处增殖浸润带活动,预示病灶在发展[14]。
本研究结果显示,采用18F-FDG PET/CT扫描诊断HAE病灶边缘增殖浸润带活性有一定的临床意义。病灶自身增殖较慢,边缘带巨噬细胞、中性粒细胞等炎性细胞未激活,细胞膜、细胞质葡萄糖转运体表达可无变化。因长期口服阿苯达唑损害肝脏功能,肝细胞受损,肝内放射性分布呈不均匀性增高,而图像分析时病灶边缘带放射性分布表现趋于邻近肝实质,故可能出现病灶不活动的假象。
本研究结果显示,109例患者在阿苯达唑治疗后病灶边缘增殖浸润带放射性分布的SUVmax值显著降低。HAE病灶边缘存在增殖浸润带会导致病变进展。有报道称HAE病灶在18F-FDG PET/CT扫描图片上具有特征性表现,因多房棘球蚴绦虫生长具有特征,18F-FDG PET/CT扫描可区分坏死虫体组织与具有代谢活性的寄生虫组织,泡型包虫病往往经病灶周围虫体组织不断增殖浸润生长,而老化坏死组织堆积于病灶中央,故多数病灶中央充盈缺损,少数病灶中央坏死,而周围呈环形强化[15-18]。本组109例HAE患者治疗前PET/CT检查显示病灶边缘放射性分布浓聚,在治疗后6个月PET/CT扫描显示其中75例病灶周缘放射性浓聚消失或明显降低,34例病灶周边放射性分布变淡。HAE病灶周围缺乏示踪剂表明局部寄生虫组织已经灭活[19]。有人认为18FFDG PET/CT扫描无法区别寄生虫组织自身与它引起的炎性反应,两者都可诱发示踪剂浓聚[20],但放射性浓聚消失总是病变稳定的标志值得肯定。

