二氢杨梅素通过抑制脂质合成途径改善非酒精性脂肪性肝病
冷清阳 李畅 周建华 刘璐 李娜 龚飒 张浩 李晓华
上海中医药大学附属第七人民医院内分泌科 200137
非酒精性脂肪性肝病(NAFLD)是一种在无过量饮酒的前提下,以肝细胞内甘油三酯堆积过多为特征的肝脏疾病,可表现为单纯性脂肪性变、非酒精性脂肪性肝炎、纤维化以及肝硬化。目前尚无美国食品药品监督管理局批准的用于治疗NAFLD的药物,现在临床上主要采取运动和改变饮食方式的方法来对NAFLD进行干预,但大多数患者均表示难以长期坚持[1]。因此,迫切需要开发新型有效的治疗NAFLD的药物。
二氢杨梅素是中药藤茶中活性最高的黄酮类化合物。以往研究显示,其不仅具有黄酮类化合物抗炎、抗氧化应激、抗肿瘤的作用,而且可以降糖、调脂、解酒护肝。但其对NAFLD的影响研究较少,作用尚不明确。本研究旨在通过高脂饮食喂养的NAFLD小鼠模型,初步探讨二氢杨梅素对NAFLD的改善作用及其可能的作用机制。
1 材料和方法
1.1 材料 60%高脂饲料购于美国Research Diets公司;二氢杨梅素购于南京广润生物制品有限公司;甘油三酯测定试剂盒购于美国BioVision公司;RIPA(强)裂解液购于上海碧云天生物技术有限公司;蛋白酶抑制剂(Protease Inhibitor Cocktail)购于美国 Roche 公司;BCATAM蛋白浓度检测试剂盒购于美国Thermo公司;脂肪酸合酶(FASN)抗体及热休克蛋白90抗体(HSP90)购于美国Cell Signaling Technology公司;固醇调节元件结合蛋白-1c(SREBP-1c)抗体购于美国Santa Cruz公司;逆转录PrimeScript®RT reagent Kit及SYBR Premix Ex TaqTM购于日本 Takara 公司。
1.2 方法
1.2.1 动物分组及给药方案 7周龄的C57BL/6J雄性小鼠购于上海斯莱克实验动物公司,适应性喂养1周后,给予60%高脂饲料喂养16周,采用随机数字表法将小鼠分为实验组[高脂加二氢杨梅素组(HFD+DHM组)]和对照组[高脂加溶剂组(HFD+Vehicle组)],每组各15只,HFD+DHM组通过灌胃的方法给予二氢杨梅素(100 mg·kg-1·d-1),HFD+Vehicle组给予相应体积的生理盐水,给药期间每周测量体重及进食量,给药至实验结束共4周。
1.2.2 腹腔葡萄糖耐量实验 小鼠禁食12 h后进行葡萄糖耐量实验,按照2 g/kg体重的剂量腹腔注射葡萄糖,并在0、15、30、60、120 min取血测定血糖水平。
1.2.3 胰岛素耐量实验 小鼠禁食6 h后进行胰岛素耐量实验,按照0.75 IU/kg体重的剂量腹腔注射胰岛素,并在0、15、30、45、60 min取血,测定血糖水平。
1.2.4 胰岛素释放实验 小鼠禁食12 h后进行胰岛素释放实验,按照2 g/kg体重的剂量腹腔注射葡萄糖,并在0、15、30 min取血,测定胰岛素水平。
1.2.5 血清生化指标检测 采用全自动生化分析仪测定甘油三酯、总胆固醇、谷丙转氨酶(ALT)、谷草转氨酶(AST)。
1.2.6 肝组织病理学观察(HE染色) 将黄豆大小的新鲜肝脏组织置于4%的多聚甲醛中固定,24 h后依次进行梯度酒精脱水,二甲苯透明,石蜡包埋。包埋好的组织块进行切片,HE染色,在显微镜下观察并拍照。
1.2.7 肝脏甘油三酯抽提及测定 称取30 mg肝脏组织放置于1.5 ml离心管中,加入500 μl的5% NP40,在组织研磨仪上研磨4次(65 Hz,60 s)制成匀浆,85℃水浴5 min,室温放置10 min,重复1次,14 000 r/min (r=8.48 cm)离心2 min。取上清100 μl置于新的EP管中。用甘油三酯试剂盒检测。
1.2.8 实时荧光定量PCR实验 用Trizol试剂提取肝脏总RNA,逆转成cDNA,用qPCR的方法检测脂代谢相关基因表达情况,引物序列见表1。

表1 引物序列
1.2.9 蛋白免疫印迹法 小鼠肝脏总蛋白采用RIPA裂解液提取,BCA法测浓度,加热变性。取30 μg蛋白样本进行聚丙烯酰胺凝胶电泳,湿转法将蛋白转移到硝酸纤维素薄膜上,5% 脱脂牛奶封闭1 h,一抗4℃摇床过夜。次日TBST洗膜8 min/次,洗3次,随后用过氧化物酶标记的抗鼠/抗兔二抗室温孵育1 h,TBST洗3次,每次10 min。最后使用 Image Quant凝胶图像分析仪曝光成像。
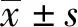
2 结果
2.1 二氢杨梅素对高脂小鼠体重及糖脂代谢的影响 给药前两组体重无明显差异,给药4周后,HFD+DHM组体重明显低于HFD+Vehicle组(t=2.161,P<0.05,图1A),给药过程中两组进食量无明显改变(图 1B)。给药4周后,行腹腔葡萄糖耐量实验、胰岛素释放实验和胰岛素耐量实验。结果显示,二氢杨梅素可明显改善高脂喂养小鼠的糖代谢水平(图1C)和胰岛素敏感性(图 1D),但胰岛功能在两组间无明显变化(图 1E)。进一步检测给药后小鼠血清中甘油三酯和总胆固醇水平的变化,结果发现,给予二氢杨梅素喂养后小鼠血清甘油三酯含量较对照组明显降低(t=3.343,P<0.05,图 1F)。血清总胆固醇结果在两组间无明显变化(图 1G)。
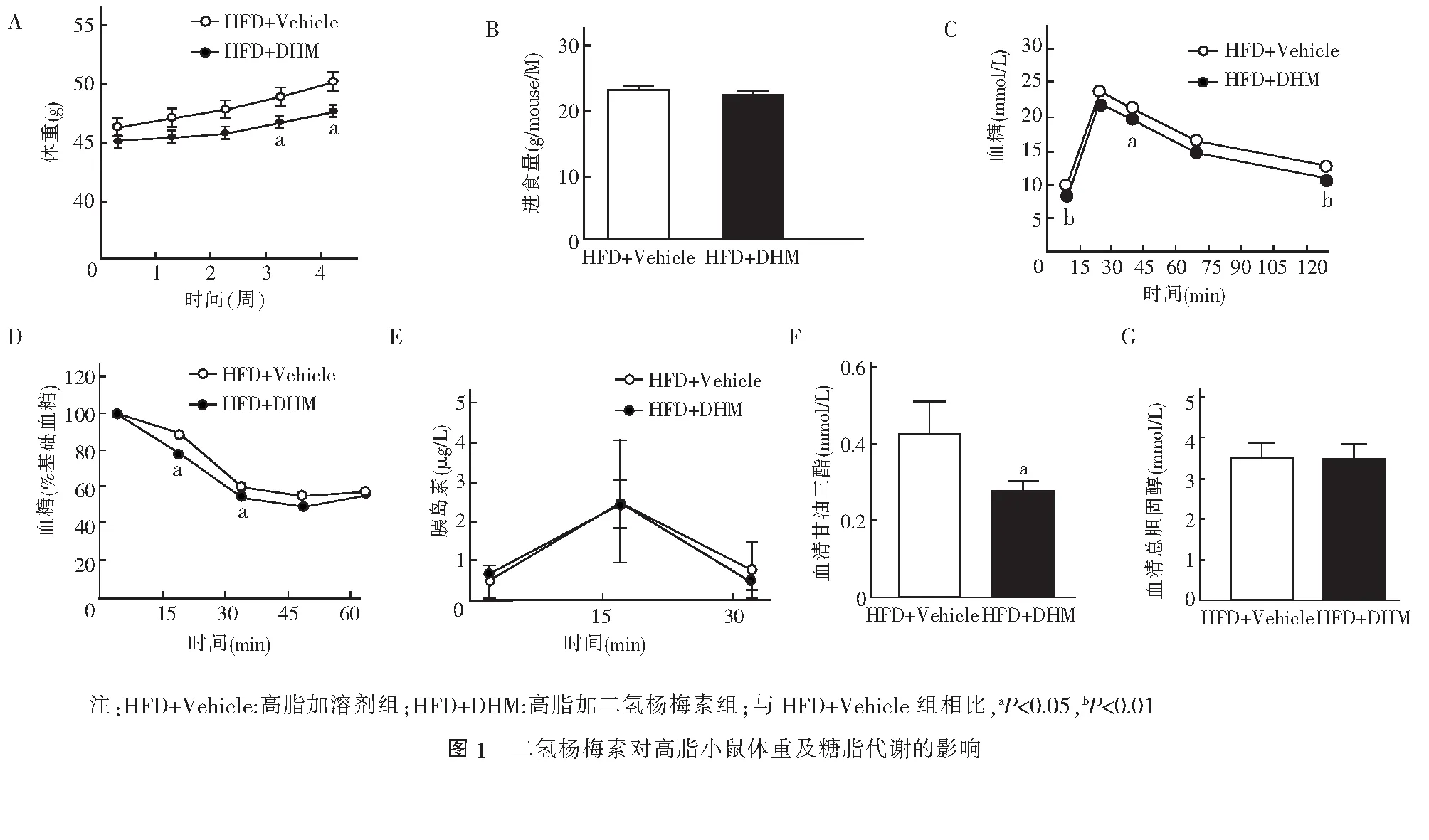
2.2 二氢杨梅素对高脂小鼠肝功能的影响 HFD+DHM组血清AST水平(t=2.562,P<0.05,图 2A)和ALT水平(t=4.293,P<0.01,图 2B)均明显低于HFD+Vehicle组。
2.3 二氢杨梅素对高脂小鼠肝脏脂质沉积的影响 HFD+DHM组肝重明显低于HFD+Vehicle组(t=2.803,P<0.05,图3A,封3)。HE染色结果显示,给予二氢杨梅素治疗后,小鼠肝细胞中的脂滴变小、变少(图3B,封3),肝脂肪变性减轻。HFD+DHM组肝脏甘油三酯含量明显低于HFD+Vehicle组(t=7.315,P<0.01,图 3C,封3)。


2.4 二氢杨梅素对高脂小鼠肝脏脂代谢相关分子表达的影响 HFD+DHM组肝脏脂质合成相关基因如FASN(t=7.116,P<0.01)、乙酰辅酶A羧化酶1(ACC1,t=7.234,P<0.01)、硬脂酰辅酶A去饱和酶1(SCD1,t=5.846,P<0.01)、SREBP-1c(t=3.2,P<0.05)表达均明显下调(图 4A),而脂肪酸线粒体氧化相关的基因,如过氧化物酶体增殖物活化受体α(PPARα)、中链乙酰辅酶A脱氢酶(MCAD)、肉毒碱棕榈酰转移酶(CPT)1、脂酰辅酶A氧化酶(ACOX)表达则无明显变化(图 4B)。进一步检测FASN、SREBP-1c蛋白的表达,结果显示,二氢杨梅素同样可以下调FASN、SREBP-1c的蛋白表达水平(图 4C)。

3 讨论
NAFLD的发生与不良的饮食习惯和不合理的饮食结构密切相关。大量研究已显示,高脂饮食可导致NAFLD的发生[2],且高脂饮食诱导的NAFLD与人类NAFLD发生、发展过程十分相似,故高脂饮食诱导的NAFLD模型被广泛用于NAFLD的研究[3]。本实验中肝脏HE染色显示,采用高脂饮食喂养小鼠16周,成功建立NAFLD小鼠模型。
研究表明,二氢杨梅素具有改善NAFLD患者血糖、甘油三酯、胆固醇以及肝功能的作用,但其作用机制尚不明确[4]。本研究以高脂饮食诱导的肥胖小鼠作为NAFLD模型,研究二氢杨梅素对NAFLD的改善作用及其潜在机制。结果显示,二氢杨梅素可以降低高脂饮食诱导的NAFLD小鼠体重,改善其糖脂代谢及肝功能,肝脏HE及甘油三酯含量测定结果显示,二氢杨梅素可以明显改善肝脏脂肪变性,抑制肝脏脂质沉积。
本研究结果显示,二氢杨梅素可显著降低小鼠体重,改善糖代谢和降低血浆中甘油三酯水平。既往研究发现,二氢杨梅素可通过以下两种途径改善糖代谢水平:(1)激活AMP活化蛋白激酶(AMPK),刺激葡萄糖转运蛋白1从细胞质转移到细胞膜,促进葡萄糖摄取。(2)激活胰岛素受体/磷脂酰肌醇3激酶/蛋白激酶B信号通路,增加葡萄糖6磷酸酶和磷酸烯醇式丙酮酸羧激酶的表达,减少葡萄糖生成[5]。在笔者的研究中显示(未发表数据),二氢杨梅素治疗后小鼠体脂含量减少,同时棕色和腹股沟皮下脂肪中的解耦联蛋白1表达明显升高,提示二氢杨梅素可激活棕色脂肪和米色脂肪。棕色脂肪和米色脂肪由于富含线粒体以及解耦联蛋白1,在寒冷、交感神经系统兴奋以及药物刺激情况下,可燃烧脂滴,将能量以热能的形式释放出去,而被称为产热脂肪。激活产热脂肪可增加能量消耗,降低体重,增加胰岛素敏感性,改善糖代谢[6]。同时产热脂肪的激活也可促进甘油三酯的代谢,降低血浆甘油三酯水平[7]。
肝细胞中甘油三酯的过度蓄积是NAFLD的显著特征和起始步骤[8]。肝脏甘油三酯代谢与肝脏脂质从头合成以及脂肪酸氧化分解密切相关[9]。SREBP-1c是调节肝脏脂质从头合成途径最重要的转录因子,可特异性调节脂质从头合成途径中很多关键酶的表达,如FASN、ACC1、SCD1等。研究显示,高脂饮食诱导的NAFLD小鼠肝脏中SREBP-1c表达明显上调,短期抑制SREBP-1c表达可以逆转由饮食诱导的NAFLD[10]。FASN是脂肪酸合成的限速酶,抑制FASN的表达可以减少脂肪酸的合成,改善肥胖引起的NAFLD[11]。本研究结果显示,二氢杨梅素可下调SREBP-1c及其下游与脂质从头合成密切相关的FASN蛋白的表达水平,提示二氢杨梅素可通过抑制脂质从头合成途径来减少脂肪酸的合成,从而改善NAFLD。SREBP-1c的表达受胰岛素、AMPK、肝X受体(LXR)、脂肪因子等多种因素的调控[12-15]。有文献报道,二甲双胍等AMPK激活剂可通过抑制SREBP-1c表达,改善脂肪肝[16]。既往研究显示,二氢杨梅素具有激活骨骼肌中AMPK信号通路的作用,提示二氢杨梅素可能通过激活肝脏中AMPK来抑制SREBP-1c表达[17]。此外,也有研究证实,棕色脂肪分泌的脂肪因子神经调节蛋白4(Nrg4)可通过激活肝细胞中的表皮生长因子受体3(ErbB3)和表皮生长因子受体4(ErbB4)信号通路,抑制SREBP-1c的表达,改善脂肪肝[15]。而笔者研究发现二氢杨梅素可激活棕色脂肪,提示二氢杨梅素也可能是通过作用于棕色脂肪,促进Nrg4分泌并激活其下游信号通路来调控SREBP-1c表达的。当然,二氢杨梅素究竟是通过何种途径调节SREBP-1c表达的,目前还不清楚,仍需要进一步的研究。NAFLD的实质是甘油三酯在肝细胞内的过度沉积。肝脏甘油三酯的生成和分解都是影响其含量的主要因素。本研究还检测了与脂肪酸β氧化相关的基因如PPARα、MCAD、ACOX、CPT1等的表达,结果发现,二氢杨梅素处理之后上述基因表达无明显变化。但Guo等[18]研究显示,NAFLD大鼠经尾静脉注射二氢杨梅素12周后,肝脏PPARα蛋白和mRNA水平表达均明显上调,提示二氢杨梅素治疗后大鼠肝脏组织脂肪酸氧化分解增强。此研究结果与笔者的结果不一致,推测可能与实验动物物种不同有关,或者是由于给药时间长短不同所致。
血清AST和ALT是肝细胞损伤的重要生化指标,当肝功能发生损伤时,血清中的AST和ALT水平升高。NAFLD时,肝脏中的脂质沉积、炎性反应和肝细胞凋亡均可引起肝细胞损伤。本研究结果显示,二氢杨梅素可通过抑制肝脏脂质沉积,减少肝细胞损伤。但也有研究发现,二氢杨梅素可以通过抑制核因子-κB的激活,减少白细胞介素-6、白细胞介素-1β、肿瘤坏死因子-α等炎性因子的释放,减轻高脂饮食对小鼠肝脏造成的炎性损伤;通过抑制核因子-κB/p53/Bax信号通路,减少肝细胞凋亡,保护肝功能[18]。本研究所发现的小鼠血清AST和ALT水平降低,可能是二氢杨梅素通过多个机制改善了肝功能的结果。
综上所述,本研究表明二氢杨梅素不仅可以降低高脂饮食诱导的NAFLD小鼠体重,改善其糖脂代谢,而且可以改善肝功能,降低肝脏中脂质沉积,进而发挥对NAFLD的改善作用。此外,二氢杨梅素通过降低SREBP-1c/FASN的表达,抑制肝脏脂质从头合成途径,减少肝脏脂质合成,这可能是其改善NAFLD的重要机制之一。

