国际糖尿病足工作组《糖尿病足感染诊断与治疗指南(2019版)》解读
徐俊 许樟荣
1国家卫生健康委员会激素与发育重点实验室(天津医科大学),天津市代谢性疾病重点实验室,天津医科大学朱宪彝纪念医院&天津市内分泌研究所,糖尿病足病科 300134; 2战略支援部队特色医学中心,北京 100101
1 背景
国际糖尿病足工作组是一个专门致力于糖尿病足诊断、治疗、护理、预防的全球性组织。每4年召开1次会议,称为国际糖尿病足论坛(ISDF)。因为国际糖尿病足工作组的发起人是荷兰糖尿病足专家Karel Bakker教授,会议地点固定在荷兰海牙。在2019年召开的第8届ISDF,2019年版的国际糖尿病足指南正式发布,在2015年指南的基础上,2019年版将近年来最新的研究进展融入其中。本次指南一共推出了6个专项指南和1个实践指南,在原有5个指南:《糖尿病足溃疡预防指南》、《糖尿病足溃疡减压指南》、《糖尿病足溃疡周围动脉病变诊断、预后与管理指南》、《糖尿病足感染诊断与治疗指南》、《糖尿病足溃疡创面愈合干预指南》的基础上,增加了《糖尿足溃疡分类指南》,并将这6部分的指南要点择出合并成一个适合基层操作的普及版的实践指南。指南最后一部分即第8部分是介绍该指南制定的方法学。指南英文原文可以从国际糖尿病足工作组的官网(www.iwgdfguidelines.org/contact)获得,中文版可见《感染、炎症、修复》杂志2019年第20卷第3~4期。
笔者有幸参与了这次大会,并得到国际糖尿病足工作组的授权,组织国内专家和笔者一起将该指南翻译成中文[1]。笔者还翻译和介绍过前几个版本的国际糖尿病足工作组糖尿病足指南(2015版)[2-3],也参与中华医学会糖尿病学分会糖尿病足与周围血管病学组制定的《中国糖尿病足防治指南》[4]。结合今年美国糖尿病学会颁布的《诊断与治疗糖尿病足感染》[5]和最近由我国学者发布在《Burns Trauma》上的《糖尿病足多学科预防与管理指南》[6],现对《糖尿病足感染诊断与治疗指南(2019版)》进行解读。
2 解读
本指南是按照患者-干预-比较-结局(PICO)原则,提出了8个临床问题,然后围绕这些问题推出27条推荐要点。同时在部分临床问题和推荐要点内部进一步分为2~3点,层层递进解决临床问题,所以这部感染指南对于临床非常具有实践指导意义。下面将依次展开介绍。
第1个问题:(a)糖尿病足感染(DFI)患者随着感染严重程度的增加,会增加住院、感染难以控制或截肢的不良结局发生吗?(b)哪些DFI患者需要住院?
众所周知,严重的DFI必然会带来不良的结局。这样就引出了怎么判断DFI。虽然DFI非常明确,是病原微生物入侵足部创面,导致组织坏死。但是在诊断DFI 时要依靠临床表现,就是创面局部的表现和全身的炎性反应,而不是绝对依靠足部细菌的培养。对于这个推荐要点,在初次判断糖尿病足创面时一定要牢记在心。因为皮肤本身在没有创面时,就存在大量细菌。一旦出现创面,这些细菌就有可能进入其中,但如果没有引起组织的坏死及红、肿、热、疼等局部炎性反应和全身反应,比如C反应蛋白(CRP)升高,那么即使培养出来的细菌也不是致病菌,而是定植菌。此时这个创面不能认为是感染的创面。尽管糖尿病足患者存在周围神经病变和(或)周围血管病变,创面局部的炎性反应可能不典型,有些不存在疼痛(神经病变),有些没有皮温升高(周围血管病变),但是只要存在感染,一定存在临床表现,比如脓性分泌物,肉芽组织颜色发灰、易出血,血清炎性标志物的升高和足部影像学的改变,这些临床表现有助于确定DFI。仅仅确定DFI还不够,还要进行严重程度的分级。尤其在初次诊断,这就回答了哪些DFI患者需要住院治疗的问题。对于DFI严重程度的分级,现在国内外普遍使用IDSA/国际糖尿病足工作组(IWGDF)的分级方法(表1)。对于糖尿病足溃疡,分为4级,即无感染(1级)、轻度感染(2级)、中度感染(3级)和重度感染(4级)。需要强调的是,糖尿病足创面中有50%存在感染,也就是说还有50%的糖尿病足创面没有感染。没有感染的创面就不需要抗感染治疗。确定了感染以后,轻度与中度的区别主要在于感染的范围和深度,在除外了一些其他因素(如痛风等)后,如果有创面炎性表现,创面周围红肿范围在0.5~2 cm的皮肤感染就是轻度感染。一旦到达皮下组织如肌肉、筋膜、关节、骨骼、韧带,创周红肿范围大于2 cm但没有全身的炎性反应就是中度感染。中度感染加上全身炎性反应综合征(SIRS)就是重度感染。对于全身炎性反应的定义,只要符合表1给出的4项中的2项及以上,即可定义为SIRS。同时,这次指南对表1进行了2012年以来的第一次修订,把糖尿病足骨髓炎(DFO)单独提出来,就是说中度和重度感染时可能合并有骨髓炎,也可能没有,如果存在,则在其后标注“O”。所有的重度感染都需要住院治疗,因为已经引起了脓毒血症,甚至有可能导致感染性休克危及生命。中度感染其实包括了很多种情况,例如1例患者仅仅是足趾的一小节感染,但到达了骨质,而周围无红肿。另1例患者坏死范围广泛,从足趾尖一直坏死到了足底足心部位,大量脓液外流,肌肉、肌腱都受累。只要这些患者没有SIRS的表现,都是属于中度感染。前1例患者门诊治疗即可,后1例患者则一定要住院治疗。所以强烈建议对于所有的DFI都进行严重程度分级,既有利于规范的治疗,也是日后进行临床科研的基础。至于DFO的标注,也是因为其治疗有别于单纯软组织感染。

表1 糖尿病足感染分级系统
第2个问题:如果DFI患者临床症状不典型,通过哪些方法来帮助确诊软组织感染?
首先要想到的是血清炎性标志物。在指南中推荐的有3个指标,分别为CRP、红细胞沉降率(ESR)和降钙素原 (PCT)。这里没有给出白细胞总数和中性粒细胞百分比。但是在感染严重度分级时,重度感染时其中有一条是白细胞总数≥12 000/mm3或≤4 000/mm3,或不成熟细胞≥10%。是否矛盾?其实不然。轻度感染和中度感染的患者白细胞是正常的。如果依靠白细胞来帮助判断DFI就会造成很大程度的漏诊。所以要看CRP、ESR和PCT。存在DFI时,均会升高。DFI如果再细分的话,包括软组织感染和骨组织感染,即DFO。指南中提到了ESR≥70 mm/h时,多提示有DFO。但是笔者发现中国DFO患者其ESR并没有那么高,一般切点会在43 mm/h[7]。指南没有给出明确的CRP和PCT诊断骨髓炎的切点。同时指南也强调,单独使用血清炎性标志物不能区分软组织感染和骨组织感染,一定要结合体征和影像学改变。同时指南第一次否定了电子足部皮温测定和定量微生物的方法用于DFI的诊断。前者是由于DFI患者合并有缺血时,皮温不会升高,而当进行了血运重建以后,皮温会升高,这些皮温的改变不能真实反映足部感染的情况。不论使用16sRNA的方法还是基因测序的方法,还是创面微生物负担的说法,都不能很好的帮助临床判断致病微生物。因为基因检测细菌方法过于灵敏,但凡在创面出现的基因片段,无论活菌还是死菌,都会出现在临床医生的报告中,可达几十种甚至几百种细菌,而面对这些细菌,哪个为优势菌很难判断,随之抗生素敏感试验更是无从选择。鉴于此,故不推荐用于临床DFI诊断。
第3个问题:怎么诊断DFO?
指南再次强调并非所有患者都需要通过骨组织病理学和(或)骨细菌培养来确诊。只要有典型的临床表现,比如“腊肠样趾”、探针探及骨质试验阳性、血清炎性标志物升高加上足部X线平片示骨质破坏,就可以确诊DFO。在这里需要解释的是DFO都是由皮肤软组织感染蔓延至骨质,不存在血行播散所致。对于一个创面,在进行探针探及骨组织试验时,一定要把表面的坏死及胼胝清除后再进行,一旦看见骨或者碰到骨组织,则为阳性。如果此时ESR≥70 mm/h,在我国建议≥43 mm/h时,两者同时阳性则可以早期发现DFO。足部X线出现骨质改变时要比临床晚14 d以上,合并有缺血时时间更长。如果通过以上方法不能确定DFO,但也不能排除。指南推荐使用核磁共振帮助诊断,如果有禁忌证(比如带有起搏器的患者),可以做白细胞标记的核素扫描。如果有条件,可以做18F氟脱氧葡萄糖(FDG)-PET/CT。 其中首选核磁共振,不仅能够确诊DFO,同时对如何进行手术治疗提供详细的解剖定位。那么何时需要做骨活检进行骨组织培养或病理?在需要明确DFO的致病菌并指导临床抗生素的选择的时候。其实骨组织活检的方法可以是经皮穿刺取材,也可以是术中取材。但骨组织活检本身也会因为取材不当导致假阴性和污染导致假阳性。这就需要临床医生具体分析。
第4个问题和第5个问题:怎么进行有效的临床标本的采集?分子生物学方法是否更有效?
因为DFI的元凶是致病微生物,尽管DFI的诊断不是必须依赖微生物培养结果,但这是抗生素治疗前所必须的。这里推荐最好在创面冲洗干净后,取组织送培养,最好是深部组织而不是表浅拭子蘸取。而且再次强调组织微生物培养是目前首选的确定致病微生物及进行抗生素敏感试验的方法。这里特别提醒,软组织培养结果不完全等于骨组织培养结果。
第6个问题:如何治疗?
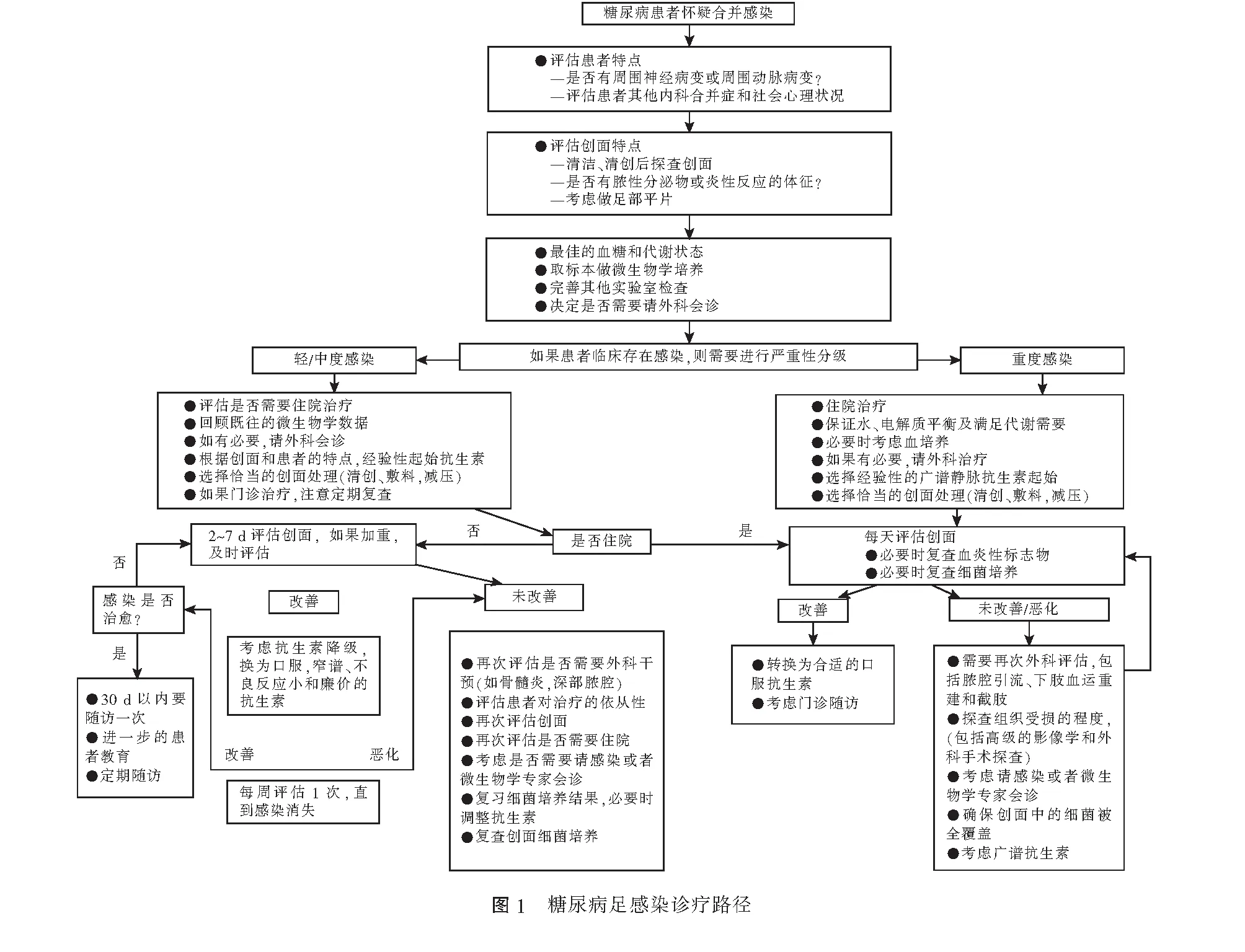
分为软组织感染与骨髓炎的治疗。临床路径见图1。共有10条推荐,首先认为绝大多数抗生素治疗DFI都是有效的。如何选择抗生素?仅仅依据细菌培养的结果和抗生素敏感试验结果还不够,还要考虑到药物之间的相互作用、不良反应、感染的严重程度,患者的经济情况及可利用的抗生素。重度感染必须静脉抗生素起始,轻度感染必须口服抗生素。部分中度感染和重度感染患者静脉治疗有效以后,可以改为口服抗生素。在细菌培养结果出来之前,还是推荐经验性使用抗生素,详细的选择方案见表2。需要注意的是,指南没有推荐升阶治疗或者降阶治疗,而是强调先定感染的严重程度。一旦确定以后,根据具体情况使用相对应的抗生素或抗生素组合。随之出现的问题就是细菌培养和药敏结果出来以后,怎么分析经验性抗生素使用的合理性?推荐必须将临床反应和药物敏感试验结合起来分析。具体来说就是如果药敏试验抗生素为敏感,临床效果好,则保持不变;如果药敏试验为耐药,但是临床效果好,则仍保持不变;如果药敏试验为敏感,但临床效果不好,则更换其他敏感抗生素,并找原因,是否是清创不彻底或足部血液循环不好;如果药敏试验为耐药,临床效果也不好,则更换抗生素。至于抗生素需要使用多长的时间,本次指南给出了自1999年第1版指南发布以来的最详细的推荐。如果是轻度感染,1~2周足够。如果经过1~2周治疗,感染有改善,但是范围和程度仍然很重,或者合并有严重的下肢动脉病变时,抗生素就要用到3~4周。如果充分治疗4周后仍然不好,就要进行重新评估,疗程可能会进一步延长。需要强调的是,如果感染相对局限而缺血很严重时,应该先进行血运重建。需要注意的是,当创面感染被有效地控制但未完全愈合,这样的情况在DFI治疗的后期是很常见的,应该停用抗生素。指南指出,抗生素没有促进创面愈合的作用,一旦能够确认创面已经不存在感染时(临床表现消失,炎性指标正常),就可以停用抗生素。此时,不一定是创面培养结果为阴性。
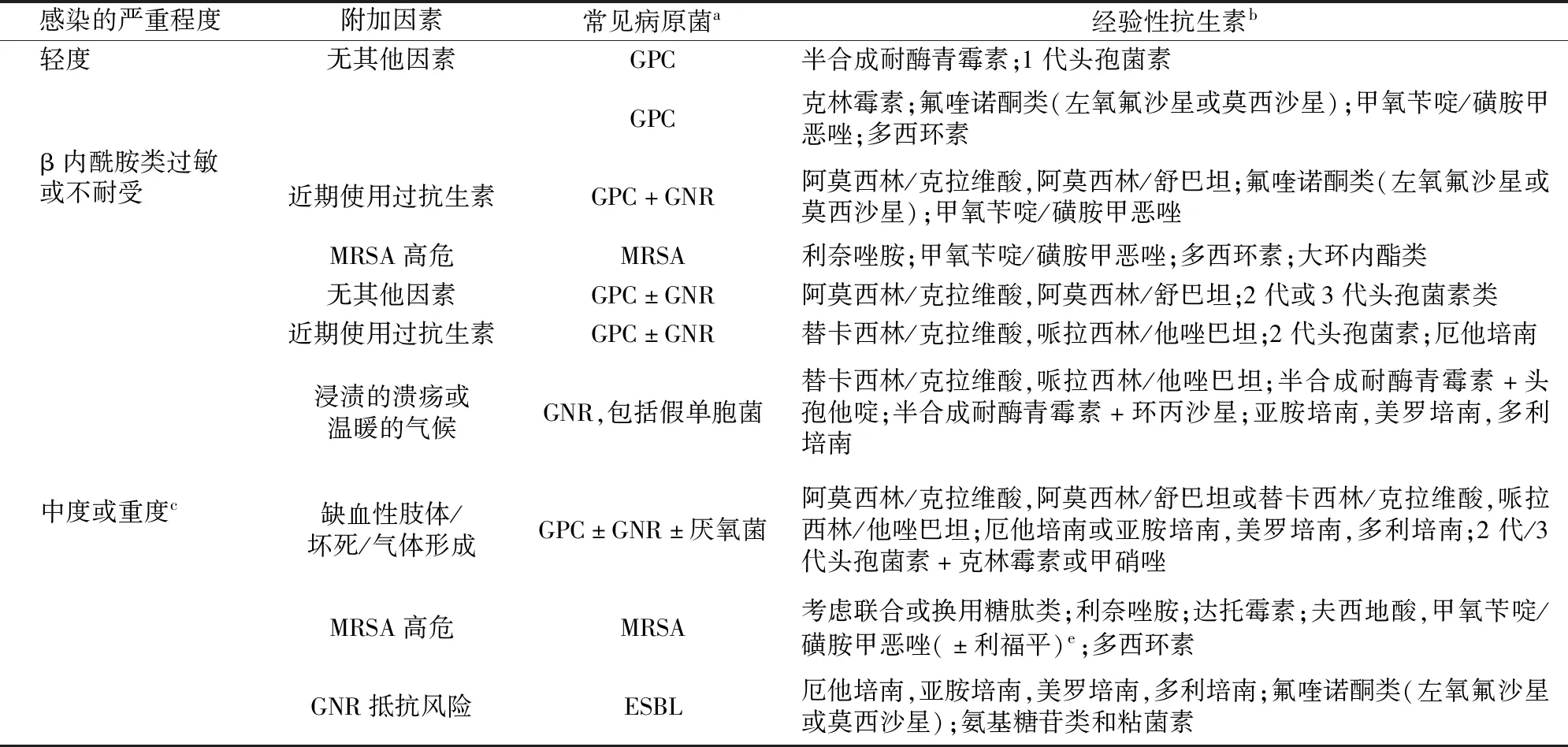
表2 DFI的经验性抗生素选择d
第7个问题:DFI是否仅仅是抗生素治疗就可以?
回答是否定的。抗生素的使用必须建立在有效清创的基础上。而且可能是多次的清创,有时候还需要做截趾甚至截肢。有3种情况必须外科紧急处理:严重感染合并有广泛坏疽、坏死,深部脓肿或腔室筋膜综合征的中度感染,严重下肢缺血的DFI。除此以外,均为择期进行清创或手术。指南对于DFO的治疗进行了非常细致的推荐。前足非缺血的DFO,尤其是软组织较好时,可以考虑单纯使用抗生素治疗而不截趾。对于DFO合并软组织感染,则需要抗生素治疗联合外科治疗。而抗生素使用的时间取决于外科手术的术式。原则上疗程不超过6周。治疗2~4周就要进行临床评估,必要时做骨组织活检来指导治疗。如果感染骨完全切除,同时没有软组织感染,那么抗生素治疗则不会超过1周。如何判断感染骨完全切除?除了经小腿或大腿的经无菌处理的大截肢以外,骨残端的细菌培养结果很有价值,如果培养结果为阳性,提示残存骨有感染,但残存骨不等于坏死骨,不一定必须再次切除。经过骨生物利用度高的抗生素治疗以后,这些骨有希望恢复,但疗程需要6周。对于DFO患者,静脉抗生素治疗好转以后,完全可以转换为口服抗生素,但是一定要考虑到抗生素的骨渗透性。
第8个问题:哪些辅助治疗可以抗感染?首先指南否定了高压氧和局部氧疗的抗感染作用,然后也不推荐使用粒细胞刺激因子抗感染。而对于碘制剂、银离子敷料、蜂蜜、噬菌体和负压治疗都不做常规推荐。主要是因为这些辅助治疗缺乏规范的临床随机对照试验的支持,证据不足或者经济问题不宜广泛推荐。至于抗生素是否可以局部使用,指南明确规定轻度感染是不推荐的,因为循证医学证据没有获益,而中度和重度感染则缺乏相应的证据。所以一般不推荐抗生素的局部使用。
3 小结
本次指南对于DFI的诊断及治疗从临床出发,逐步给予推荐,具有很强的可操作性。感染治疗本身就需要内科治疗与外科治疗有机的结合,抗生素必须在充分的清创和有通畅的下肢血运的情况下才能发挥最佳的杀菌作用。同时请广大从事糖尿病足治疗的同仁注意,糖尿病足的治疗需要多学科的合作,要对患者的全身情况、下肢情况及创面情况进行评估后给予相应的治疗。我国的指南还补充了相应的内容,比如心脏、肾脏问题的处理,同时也提到了心理问题的干预及中医中药的治疗。

