炎性细胞因子在膝骨关节炎中的表达及与高敏C反应蛋白和红细胞沉降率的相关性
刘建华,赵海勇,温芳,赵雁艳,游洋,丁红梅
骨关节炎(osteoarthritis,OA)是常见的慢性关节疾病,累及部位包括膝、髋、踝、手和脊柱等关节,以膝骨关节炎(knee osteoarthritis,KOA)在临床上最常见,其发病率随着人口老龄化、肥胖等因素呈不断上升的趋势,给家庭及社会带来沉重的经济负担[1−2]。该病的特点是关节软骨的逐渐退化,软骨下骨增厚及骨赘形成,最终导致关节活动受限和关节功能丧失。与OA病程进展相关的因素有很多,包括遗传易感性、衰老、肥胖、创伤和其他全身性疾病等。OA的发病机制目前尚未明确。近年来,炎性细胞因子在OA[3−5]、类风湿关节炎[6−7]等疾病发病机制中的作用受到越来越广泛的关注。本研究在以往研究的基础上全面检测了KOA患者外周血及病变局部关节液中炎性细胞因子白细胞介素(IL)−1β、肿瘤坏死因子(TNF)−α、IL−6的水平,并进一步分析其与高敏C反应蛋白(high sensitivity C−reactive protein,hs−CRP)及红细胞沉降率(erythrocyte sedimentation rate,ESR)的相关性,探讨以上血清标志物在OA早期诊断、病情及预后评估中的潜在价值。
1 对象与方法
1.1 研究对象 选取2017年8月—2018年12月在唐山市第二医院关节科就诊的85例KOA患者为研究对象。同期收集该院80例年龄、性别匹配的健康体检者作为健康对照组。所有入选OA患者的临床诊断均符合骨关节炎诊疗指南(2018年版)的诊断标准[8],排除炎症、肿瘤、结缔组织病、创伤、感染及其他自身免疫性疾病。根据临床症状和体征、X线片Kellgren−Lawrence(K−L)分级将KOA患者分为早期(24例)、中期(26例)、晚期(35例)3组[9]。入组KOA患者与健康对照(HC)组性别、年龄、体质量指数(body mass index,BMI)比较,差异无统计学意义,见表1。本研究获得了本院伦理委员会的审查批准,且标本采集获得所有受试者的知情同意。
1.2 主要试剂与仪器 人IL−1β、TNF−α、IL−6检测试剂盒购自上海晶抗生物工程有限公司,采用BioTek Synergy 2酶标仪(美国BioTek公司)进行检测。人血清hs−CRP检测试剂盒购自迈克生物股份有限公司,采用日立7600全自动生化分析仪及其配套试剂进行检测。ESR采用LBY−XC−20全自动动态血沉仪(北京普利生仪器有限公司)及配套一次性血沉管进行检测。
1.3 方法
1.3.1 采集标本 采集85例KOA患者、80例健康对照者的空腹肘正中静脉血标本4 mL,3 000 r/min离心15 min,分离血清后在−80℃分装保存。采集25例上述KOA患者的关节液标本,关节液标本在KOA患者行关节镜检查或关节置换术时获取,采集关节液3~5 mL,3 000 r/min离心15 min,取上清保存于−80℃待用。
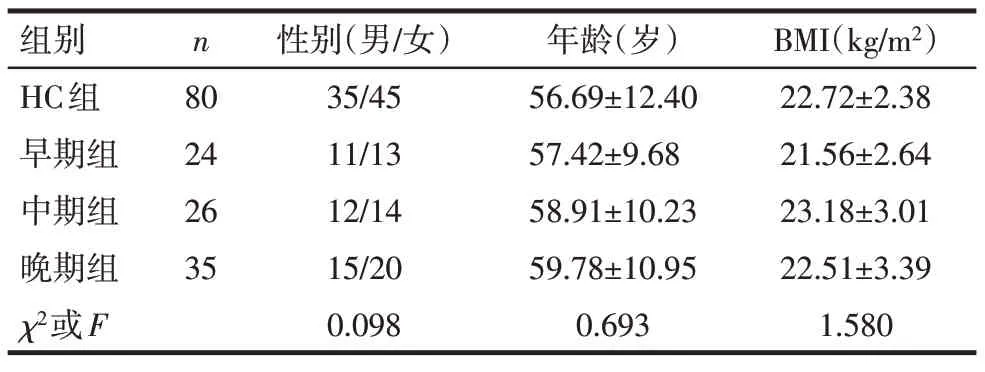
Tab.1 The general information in four groups of KOA patients表1 入组KOA患者与HC组的基本资料
1.3.2 酶联免疫吸附试验(enzyme−linked immunosorbent assay,ELISA)检测IL−1β、TNF−α、IL−6水平 血清和关节液IL−1β、TNF−α、IL−6的含量均采用双抗体夹心法ELISA试剂盒进行检测,严格按照试剂盒说明书进行操作。
1.3.3 胶乳免疫比浊法检测血清hs−CRP水平 血清hs−CRP应用胶乳免疫比浊法进行测定,采用日立7600全自动生化分析仪及其配套试剂进行检测,正常参考值为0~10 mg/L。
1.3.4 全自动动态血沉仪检测ESR水平 将枸橼酸钠抗凝血缓慢颠倒混匀8~10次,将一次性血沉管轻轻垂直插入动态血沉仪测试孔,仪器自动扫描样本,30 min后读取血沉数值。正常参考值为男性0~15 mm/1 h,女性0~20 mm/1 h。
1.4 统计学方法 采用SPSS 17.0软件进行数据统计分析。正态分布的计量资料以均数±标准差(±s)表示,2组样本间均数比较采用独立样本t检验,多组间比较采用单因素方差分析(one−way ANOVA),进一步采用SNK−q检验进行组间多重比较。采用Pearson线性相关进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组IL−1β、TNF−α、IL−6、hs−CRP、ESR水平比较 结果显示,与HC组相比,早、中、晚期KOA组IL−1β、TNF−α、IL−6、hs−CRP和ESR表达水平均升高,且随着KOA患者临床分期的进展,以上血清标志物的表达水平呈上升趋势,见表2。
2.2 KOA患者血清与关节液IL−1β、TNF−α、IL−6水平比较 KOA患者关节液中IL−1β、TNF−α、IL−6表达水平均高于血清,见表3。
Tab.2 Comparison of levels of IL-1β,TNF-α,IL-6,hs-CRP and ESR between four groups表2 各组KOA患者及健康人IL-1β、TNF-α、IL-6、hs-CRP、ESR水平比较 (±s)
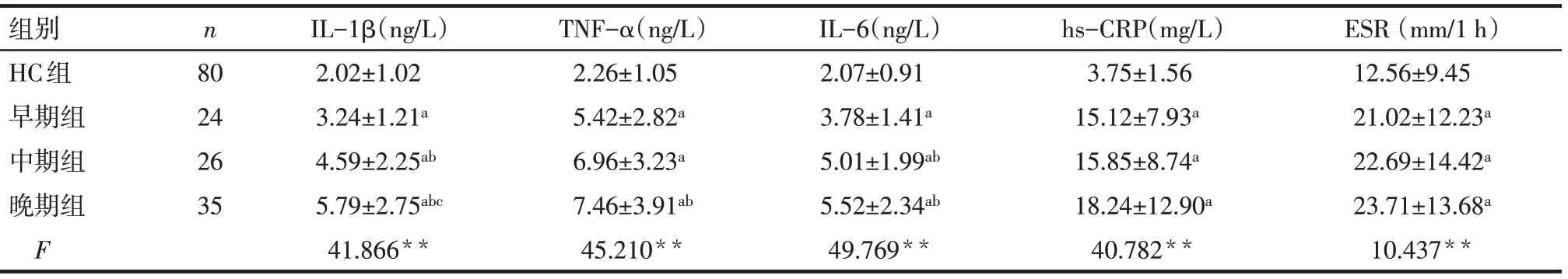
Tab.2 Comparison of levels of IL-1β,TNF-α,IL-6,hs-CRP and ESR between four groups表2 各组KOA患者及健康人IL-1β、TNF-α、IL-6、hs-CRP、ESR水平比较 (±s)
**P<0.01;a与HC组比较,b与早期组比较,c与中期组比较,P<0.05
组别HC组早期组中期组晚期组F n 80 24 26 35 IL−1β(ng/L)2.02±1.02 3.24±1.21a 4.59±2.25ab 5.79±2.75abc 41.866**TNF−α(ng/L)2.26±1.05 5.42±2.82a 6.96±3.23a 7.46±3.91ab 45.210**IL−6(ng/L)2.07±0.91 3.78±1.41a 5.01±1.99ab 5.52±2.34ab 49.769**hs−CRP(mg/L)3.75±1.56 15.12±7.93a 15.85±8.74a 18.24±12.90a 40.782**ESR(mm/1 h)12.56±9.45 21.02±12.23a 22.69±14.42a 23.71±13.68a 10.437**
Tab.3 Comparison of serum and joint fluid levels of IL-1β,TNF-αand IL-6 in KOA patients表3 KOA患者血清与关节液IL-1β、TNF-α、IL-6水平比较 (ng/L,±s)

Tab.3 Comparison of serum and joint fluid levels of IL-1β,TNF-αand IL-6 in KOA patients表3 KOA患者血清与关节液IL-1β、TNF-α、IL-6水平比较 (ng/L,±s)
*P<0.05,**P<0.01
标本类型血清关节液t n 85 25 IL−1β 4.70±2.06 5.88±2.79 2.312*TNF−α 6.73±3.28 9.23±4.14 3.149**IL−6 4.87±1.79 6.11±3.65 2.334*
2.3 KOA患者IL−1β、TNF−α、IL−6与hs−CRP、ESR相关性分析 结果表明,KOA患者血清和关节液中IL−1β、TNF−α、IL−6水平与血清hs−CRP、ESR均呈正相关,见表4。

Tab.4 Correlation between serum levels of IL-1β,TNF-α,IL-6 and serum hs-CRP and ESR in patients with KOA表4 KOA患者血清和关节液IL-1β、TNF-α、IL-6水平与血清hs-CRP、ESR相关性分析 (r)
3 讨论
目前OA的诊断主要依据患者的临床表现和影像学资料,但早期OA患者的临床症状和影像学表现不明显,缺乏敏感性和特异性。因此,寻找更特异、更敏感的血清学标志物对于OA的早期特异度诊断及病情评估具有非常重要的临床意义。近年来研究显示,OA的发生、进展与炎症密切相关。炎性细胞因子在OA发病机制中的作用是目前研究的热点。
3.1 KOA患者体内IL−1β、TNF−α、IL−6的表达 炎性细胞因子在OA发病中最重要的作用是干扰关节组织中的分解代谢和合成代谢过程,该平衡被破坏会导致关节部位起关键生物力学作用的关节软骨进行性退化,最终导致关节功能逐渐丧失和疼痛[10−11]。IL−1β、TNF−α、IL−6主要由滑膜和软骨细胞等生成,其可诱导其他细胞因子、基质金属蛋白酶和前列腺素的产生,抑制蛋白聚糖和Ⅱ型胶原的合成,在OA的软骨基质降解和骨吸收中起着关键作用[12]。此外,IL−1β、TNF−α、IL−6可能通过调节脂肪细胞脂联素和瘦素的释放间接引起OA[12]。本研究结果显示,KOA患者外周血中IL−1β、TNF−α、IL−6的表达水平均高于健康对照组,且随着患者临床分期的发展,IL−1β、TNF−α、IL−6含量逐渐升高。关节液中IL−1β、TNF−α、IL−6的含量高于血清,提示外周血中IL−1β、TNF−α、IL−6可能来自于病变局部关节液。本研究结果与以往的研究结果具有一致性[12−13],均提示炎性细胞因子在OA发病中可能发挥了重要作用。
3.2 KOA患者外周血hs−CRP、ESR的表达 CRP和ESR是系统性炎性疾病最常用的实验室指标,在类风湿关节炎等炎性关节疾病中表达升高。以往OA被认为是非炎性关节疾病,炎性血清标志物如CRP等 并 不 升 高[14−16]。但 近 年 来 研 究 显 示,hs−CRP、ESR在OA患者体内表达升高并且与OA疾病进展、预后等密切相关[17−19]。hs−CRP检测与传统方法相比可检测到低浓度的CRP,进而识别炎症程度轻的OA患者,因而可能更有利于预测OA的发生发展。本研究结果显示,KOA患者外周血hs−CRP、ESR表达水平均高于HC组,进一步表明炎症是OA重要的发病机制,hs−CRP、ESR可能是OA早期诊断及病情评估的潜在血清学标志物。
3.3 IL−1β、TNF−α、IL−6与hs−CRP、ESR的相关性 炎性细胞因子,如IL−6等可诱导肝脏合成CRP增加[20],因此本研究进一步分析了IL−1β、TNF−α、IL−6与hs−CRP、ESR的相关性。结果显示,KOA患者血清和关节液中IL−1β、TNF−α、IL−6的表达与hs−CRP、ESR均呈正相关。结果提示,IL−1β、TNF−α、IL−6与hs−CRP、ESR检测可能有助于KOA的早期发现、早期诊断,提高检测的敏感度和特异度。上述血清标志物与影像学指标,如骨赘形成、关节狭窄度评分、胫骨磨损评分、硬化评分之间的关系还需在今后继续收集资料、扩大样本例数进行深入研究。
综上所述,本研究发现KOA患者血清及关节液中炎性细胞因子IL−1β、TNF−α、IL−6表达水平均升高,且血清和关节液IL−1β、TNF−α、IL−6与血清hs−CRP、ESR均呈正相关,炎性细胞因子与hs−CRP、ESR检测可能成为辅助KOA早期诊断、病情及预后评估的重要血清学标志物,本研究也为深入探讨OA的发病机制及临床寻找治疗靶点奠定了实验基础。

