ActivinA诱导大鼠胰腺导管干细胞分化形成胰岛β细胞
赵一 吴江 康恺 栗烨 李光辉 刘斌 郎贯存 安立龙 效梅

摘要:【目的】研究Activin A体外定向诱导大鼠胰腺导管干细胞分化形成胰岛β细胞的作用,为移植体外新生β细胞治疗宠物犬糖尿病打下基础,同时为胰岛细胞体外再生培养的优化提供科学依据。【方法】采用培养液RPMI-1640+10% FBS+10 ng/mL EGF+1%青霉素—链霉素扩增大鼠胰腺导管干细胞至单层,空白对照组加基础培养液,诱导组在基础培养液中分别添加5、10、15和20 ng/mL Activin A,連续培养28 d。诱导培养期间于倒置显微镜下观察细胞形态变化,诱导结束后通过双硫腙(DTZ)染色、细胞免疫荧光染色、ELISA检测及实时荧光定量PCR等方法对分化形成的类胰岛细胞团功能和性状进行验证。【结果】大鼠胰腺导管干细胞经Activin A诱导分化形成球形细胞,并聚集成团(类胰岛),DTZ染色结果均呈阳性。诱导28 d后,20 ng/mL Activin A诱导组的类胰岛细胞团数量及其Insulin基因表达水平均极显著高于其他3个Activin A诱导组(P<0.01,下同),且类胰岛细胞体积最大,类胰岛细胞的Pdx1基因表达水平最高;无论在低葡萄糖(5 mmol/L)还是高葡萄糖(25 mmol/L)的刺激下,20 ng/mL Activin A诱导组类胰岛细胞的Insulin和C-peptide分泌量均极显著高于其他3个Activin A诱导组。【结论】Activin A能体外诱导大鼠胰腺导管干细胞分化形成胰岛β细胞,且以基础培养液中添加20 ng/mL Activin A的诱导效果最佳。
关键词: 大鼠;Activin A;胰腺导管干细胞;β细胞;胰岛素(Insulin)
中图分类号: S865.12 文献标志码: A 文章编号:2095-1191(2020)01-0209-08
Abstract: 【Objective】In this study, the efficiency of Activin A to induce the differentiation of rat pancreatic ductal stem cells into islet β cells were investigated, which provided the basis for optimizing the in vitro development of β cells to advance the research related to cure of pet dogsdiabetes through transplantation of in vitro produced β cells. 【Method】For in vitro expansion, rat pancreatic ductal stem cells were cultured as a monolayer in RPMI-1640+10% FBS+10 ng/mL EGF+1% penicillin-streptomycin, the control group was cultured with basal medium, while, experimental groups were supplemented with 5, 10, 15 and 20 ng/mL Activin A respectively and stem cells were continuously cultured for 28 d. The morphological changes of cells were observed under inverted microscope. The islet-like cell cluster function and traits were corroborated by diphenylthiocarbazone(DTZ) staining, cell immunofluorescence staining, ELISA test and qPCR. 【Result】The rat pancreatic duct stem cells were induced by Activin A for their differentiate into islet-like cell clusters. DTZ staining results were positive. After 28 d of induction, the number of islet like cells and their Insulin gene expression levels in the 20 ng/mL Activin A induced group were extremely higher than those in the other three Activin A induced groups (P<0.01, the same below), the volume of islet-like cells was the largest, and the expression level of Pdx1 gene in islet-like cells was the highest. Under the stimulation of low glucose (5 mmol/L) or high glucose (25 mmol/L), the Insulin and c-peptide secretion of islet cells in the 20 ng/mL Activin A induced group was extremely higher than that in the other three Activin A induced groups. 【Conclusion】This indicates that Activin A can induce the differentiation of rat pancreatic ductal stem cells into islet β-like cells, and adding 20 ng/ml Activin A into media has the optimal effects.
Key words: rat;Activin A; pancreatic ductal stem cells; β cell; Insulin
Foundation item: Guangdong Natural Science Foundation(10152408801000023)
0 引言
【研究意义】胰腺导管是分化形成β细胞的成体干细胞库(Bonner-Weir et al.,2004;Veiseh and Langer,2015)。由胰腺导管分离出的干细胞具备多向分化潜能,体外定向诱导可分化形成功能性β细胞,再将类胰岛细胞移植到糖尿病动物体内即可有效维持正常的血糖水平(Butler et al.,2003;Ashcroft and Rorsman,2012;Kim et al.,2013)。目前,宠物犬糖尿病的发生越来越普遍,已成为宠物犬最常见的内分泌疾病之一,对宠物业的健康发展造成严重威胁(东彦新和魏艳辉,2018)。因此,体外定向诱导胰腺导管干细胞分化形成β细胞并移植,对治疗宠物犬糖尿病及其兽药开发具有重要意义。【前人研究进展】Activin A是转化生长因子β家族成员之一,能促进胰芽形成,引导胰腺内分泌细胞和外分泌细胞分化,最终形成胰岛(Tateishi et al.,2008;Maehr et al.,2009;Zhang et al.,2009;Moriya et al.,2010)。已有研究表明,将Activin A和β细胞素同时注入链脲佐菌素(STZ)诱导的糖尿病大鼠新生儿体内,可有效降低其高血糖症(Li et al.,2004)。在体外的β细胞再生培养研究中,Activin A作为一种主要的诱导因子被广泛应用。D'Amour等(2005)研究发现,使用Activin A和低血清培养基能将胚胎干细胞诱导分化形成定形内胚层、肠管内胚层、胰腺内胚层和内分泌前体,最终分化形成胰岛细胞,且证实胚胎干细胞诱导分化形成的胰岛细胞与自然状态下的β细胞功能相似,通过释放C-肽而响应葡萄糖刺激。Park等(2007)报道称,Activin A可增强大鼠胰腺导管细胞分化,将分化形成的内分泌细胞移植入STZ诱导的糖尿病大鼠肾囊下,糖尿病大鼠血糖恢复正常,有效缓解其高血糖症。Chen等(2009)在运用小分子物质诱导人类胚胎干细胞向胰岛细胞分化时发现,Activin A诱导干细胞分化形成内分泌胰腺,并刺激胰腺祖细胞关键转录因子Pdx1表达,将诱导形成的胰岛细胞移植入糖尿病模型动物中具有良好的降低血糖功效。Kim等(2013)研究发现Activin A、exendin-4和葡萄糖均能刺激人源胰腺导管细胞分化形成内分泌细胞。Kuo等(2017)研究证实,Activin A与视黄酸联用能成功诱导人源诱导多能干细胞向胰岛细胞分化。Kunio等(2017)通过建立人源诱导多能干细胞分化形成胰岛细胞方案,发现Activin A在前期是作为启动人源诱导多能干细胞分化的活化因子。【本研究切入点】至今,有关Activin A诱导胰腺导管干细胞分化形成胰岛的研究鲜见报道。【拟解决的关键问题】探讨Activin A体外定向诱导大鼠胰腺导管干细胞分化形成胰岛β细胞的作用,比较不同Activin A浓度的诱导效果,并对分化形成的类胰岛功能和性状进行验证,为移植体外新生β细胞治疗糖尿病打下基础,同时为胰岛细胞体外再生培养的优化提供科学依据。
1 材料与方法
1. 1 试验材料
大鼠胰腺导管干细胞系由广东海洋大学滨海农业学院动物繁殖原理与生物技术团队分离培养获得。部分细胞保存在中国典型培养物保藏中心,保存号C201457。RPMI-1640、无糖-DMEM、FBS(Fetal bovine serum)、EGF(Epidermal growth factor)、青霉素—链霉素及Activin A购自Gibco公司;DMSO(Dimethyl sulfoxide)、葡萄糖及双硫腙(DTZ)购自Sigma公司;大鼠胰岛素(Insulin)和C-肽(C-peptide)ELISA试剂盒购自上海酶联生物科技有限公司;Hoechst 33342和BSA(Bovine serum albumin)购自Solabio公司;Triton X-100、多聚甲醛、PBS及Hanks溶液购自生工生物工程(上海)股份有限公司;兔多克隆抗体Pdx1、小鼠单克隆抗体Insulin+Proinsulin、山羊抗兔IgG(H&L)及山羊抗小鼠IgG(H&L)购自Abcam公司;RNA提取试剂盒购自Magen公司;PrimeScriptTM RT反转录试剂盒和TB Green Premix Ex Taq II定量试剂盒购自TaKaRa公司。
1. 2 诱导方法
大鼠胰腺导管干细胞按1×104个/孔接种于12孔板中,采用培养液RPMI-1640+10% FBS+10 ng/mL EGF+1%青霉素—链霉素扩增干细胞至单层,诱导组更换诱导培养液,连续培养28 d,每48 h换液一次。各组细胞培养液组成如表1所示。
1. 3 DTZ染色
参照Bonner-Weir等(2000)的研究方法进行DTZ染色。
1. 4 细胞免疫荧光染色检测
诱导28 d后,通过间接细胞免疫荧光染色检测β细胞标记物Insulin和Pdx1。细胞染色步骤:以PBS冲洗细胞,再用4%多聚甲醛固定5 min;预冷PBS洗涤3次(每次5 min)后用0.2% Triton X-100滲透30 min;预冷PBS洗涤2次(每次5 min),用1% BSA封闭30 min;加入一抗(1% BSA稀释)在室温下湿箱孵育1 h或4 ℃过夜;去除液体并用PBS洗涤3次(每次5 min),加入二抗(1% BSA稀释)在室温下避光孵育1 h;倒弃二抗并用PBS洗涤3次(每次5 min),使用Hoechst 33342进行染色。其中,一抗为兔多克隆抗体Pdx1或小鼠单克隆抗体Insulin+Prainsulin,二抗为山羊抗兔IgG或山羊抗小鼠IgG。倒置荧光显微镜观察染色结果。
1. 5 ELISA检测
诱导28 d后,采用ELISA试剂盒检测葡萄糖刺激类胰岛细胞后的Insulin和C-peptide分泌水平。用PBS洗涤3次,每组处理随机选择6孔,分成低葡萄糖刺激组(5 mmol/L)和高葡萄糖刺激组(25 mmol/L)。37 ℃孵育30 min后收集细胞培养液,2000 r/min离心15 min,收集上清液,分装后-80 ℃保存备用,或直接进行ELISA检测。
1. 6 RNA提取及实时荧光定量PCR检测
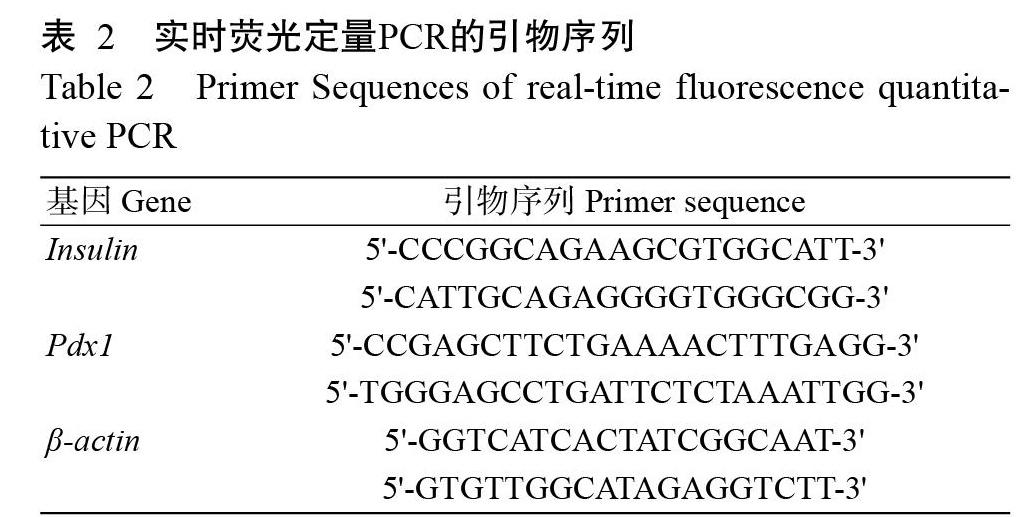
于诱导0和28 d时分别采用RaPure Total RNA Kit提取细胞总RNA,以携带gDNA Eraser的PrimeScriptTM RT试剂盒将总RNA反转录合成cDNA;然后使用TB Green Premix Ex Taq II在Applied Biosystems 7300定量仪上检测β细胞标记基因Insulin和Pdx1的表达情况,以β-actin为内参基因。实时荧光定量PCR的引物如表2所示。
1. 7 细胞形态观察
每隔3 d在倒置显微镜下观察细胞形态变化,并拍照记录。
1. 8 统计分析
试验数据采用SPSS 19.0进行统计整理,分别用单因素方差分析(One-way ANOVA)和 t 检验进行差异显著性分析,再以GraphPad Prism 6.0制图。
2 结果与分析
2. 1 大鼠胰腺导管干细胞分化形成类胰岛
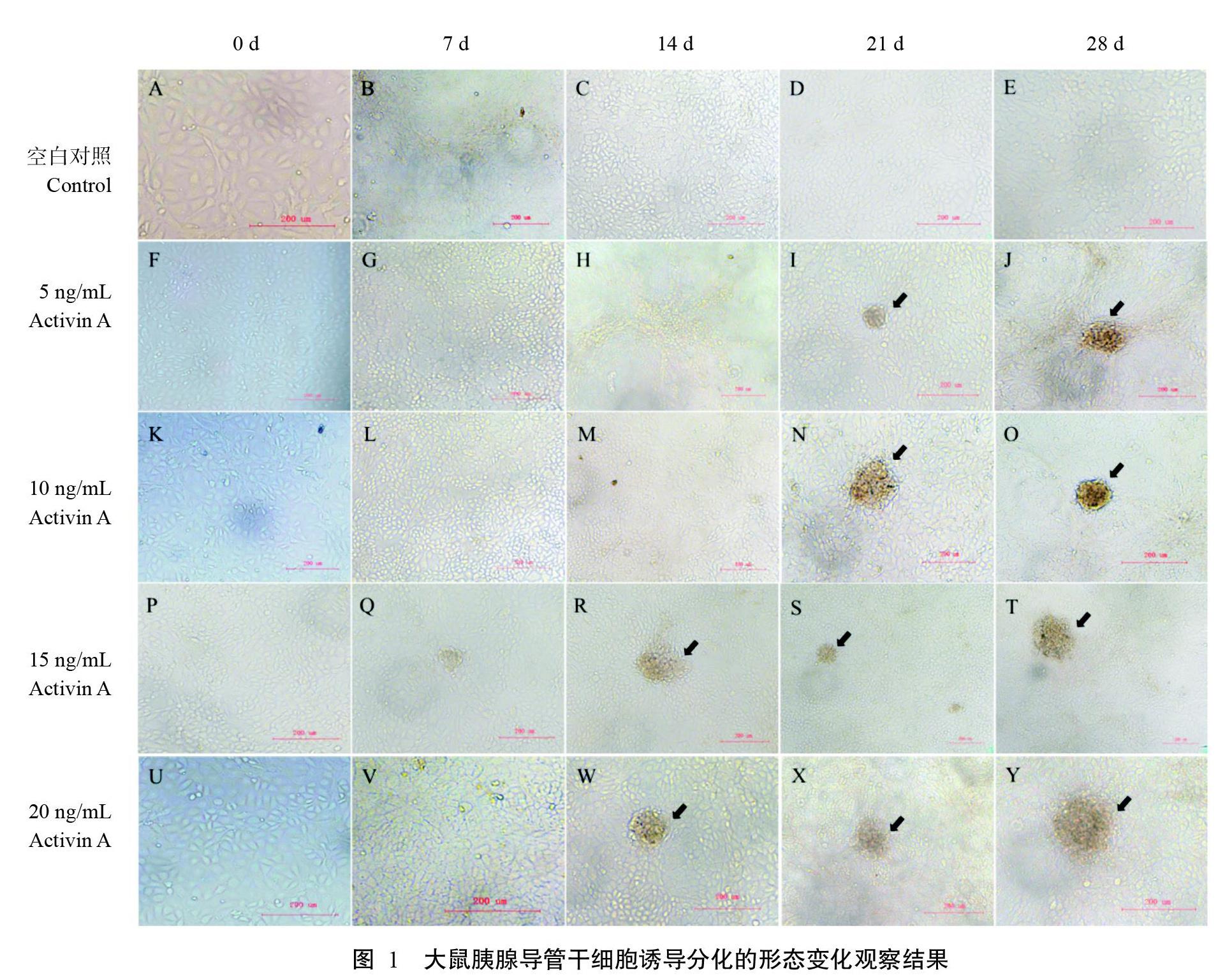
2. 1. 1 大鼠胰腺导管干细胞形态变化情况 大鼠胰腺导管干细胞形态为多边形,呈铺路石样生长,经Activin A诱导其分化细胞形态变化如图1所示。诱导7 d时,各Activin A诱导组胰腺导管干细胞形态无明显变化(图1-B、图1-G、图1-L、图1-Q和图1-V),空白对照组则出现明显的细胞富集现象;诱导14 d时,15和20 ng/mL Activin A诱导组的胰腺导管干细胞分化形成球形细胞,并聚集成团(图1-R和图1-W);诱导21 d时,各Activin A诱导组胰腺导管干细胞均分化形成细胞团(图1-I、图1-N、图1-S和图1-X);诱导28 d时,各Activin A诱导组均维持类胰岛细胞团形态(图1-J、图1-O、图1-T和图1-Y),空白对照组胰腺导管干细胞仍未分化形成细胞团(图1-E)。此外,类胰岛细胞团的形成与Activin A浓度呈明显的剂量依赖性关系。
2. 1. 2 类胰岛细胞团计数结果 如图2所示,20 ng/mL Activin A诱导组的类胰岛细胞团数量极显著高于其他3个Activin A诱导组(P<0.01,下同),空白对照组无类胰岛细胞团。
2. 1. 3 DTZ染色结果 DTZ可与胰岛β细胞中的锌离子结合呈铁红色。由图3可看出,各Activin A诱导组的DTZ染色结果均为阳性,而空白对照组的DTZ染色结果呈阴性。
2. 2 类胰岛细胞共表达Insulin和Pdx1的情况
胰岛β细胞能特异性分泌Insulin;Pdx1在胰岛β细胞的分化形成过程中发挥重要作用,同时在β细胞内表达(Liang et al.,2013)。诱导28 d后采用细胞免疫荧光染色检测类胰岛细胞,结果(图4)显示各Activin A诱导组类胰岛细胞均共表达Insulin和Pdx1,但各组间的Insulin和Pdx1表达情况存在一定差异,具体表现为:20 ng/mL Activin A诱导组的类胰岛细胞体积明显大于其他3个Activin A诱导组,且该诱导组类胰岛细胞中表达Insulin的细胞数多于其他3个Activin A诱导组。空白对照组无表达Insulin的类胰岛细胞团,仅有少量表达Insulin的细胞(图4-A),但有表达Pdx1的类胰岛细胞团(图4-B)。Insulin和Pdx1共表达提示Activi A诱导大鼠胰腺导管干细胞分化形成的类胰岛细胞具备β细胞特性。
2. 3 类胰岛细胞Insulin和Pdx1基因的表达水平
实时荧光定量PCR检测结果(图5)显示,诱导28 d后各Activin A诱导组类胰岛细胞的Insulin基因表达水平较诱导0 d时极显著上调,空白对照组胰腺导管干细胞的Insulin基因表达水平较诱导0 d时显著上调(P<0.05,下同)。20 ng/mL Activin A诱导组类胰岛细胞的Insulin基因表达水平极显著高于其他3个Activin A诱导组及空白对照组,5、10和15 ng/L Activin A诱导组类胰岛细胞的Insulin基因表达水平高于空白对照组,但差异不显著(P>0.05,下同)。诱导28 d后,空白对照组及5、10和20 ng/mL Activin A诱导组细胞的Pdx1基因表达水平较诱导0 d时极显著上调,15 ng/mL Activin A诱导组呈显著上调趋势。与对照组细胞相比,10 ng/mL Activin A诱导组类胰岛细胞的Pdx1基因表达水平显著上调,20 ng/mL Activin A诱导组类胰岛细胞的Pdx1基因表达水平极显著上调,但二者间差异不显著。
2. 4 葡萄糖刺激类胰岛细胞分泌Insulin和C-pepitide的情况
经Activin A诱导28 d后分别以5和25 mmol/L的葡萄糖刺激类胰岛细胞,结果显示,20 ng/mL Activin A诱导组类胰岛细胞的Insulin(图6-A和图6-B)和C-peptide(图6-C和图6-D)的分泌量较对空白照组均极显著提高;5、10和15 ng/mL Activin A誘导组与空白对照组相比,Insulin分泌量无明显变化,C-peptide分泌量虽呈上升趋势,但差异不显著,表明类胰岛细胞具有分泌Insulin和C-peptide的功能,即具备胰岛β细胞特性。无论在低葡萄糖还是高葡萄糖刺激下,20 ng/mL Activin A诱导组类胰岛细胞的Insulin和C-peptide分泌量均极显著高于其他3个Activin A诱导组,即以20 ng/mL Activin A诱导胰腺导管干细胞分化形成的类胰岛细胞含有更多Insulin分泌细胞。
3 讨论
胰腺导管干细胞作为胰岛β细胞祖细胞源,当胰腺受损时能发挥出恢复胰岛功能的作用,因此在糖尿病治疗方面具有巨大的应用潜力。Bonner-Weir等(2000,2004)研究认为,胰腺导管上皮是胰岛和腺泡的祖细胞池,运用含TS、BSA、KGF和尼克酰胺的无血清DMEM/F12诱导液可使其诱导分化形成类胰岛细胞团。效梅等(2008,2009)以含10 mmol/L烟酰胺、10 μg/L EGF和10% FBS的高糖DMEM为诱导液,成功诱导源于人流产胎儿胰腺组织的胰腺干细胞分化形成类胰岛细胞,将类胰岛细胞移植到糖尿病大鼠中能有效降低血糖水平,延长大鼠寿命。Skurikhin等(2014)从STZ处理的糖尿病小鼠胰腺中分离获得胰腺干细胞,经诱导可分化形成分泌Insulin的类胰岛细胞。本课题组也从成年大鼠胰腺导管中成功分离获得胰腺导管干细胞系,且研究证实该细胞系具备多向分化潜能及稳定无限传代的特点,共表达CK19、NeuroD2、Oct4、PCNA和Nanog蛋白,但不表达Insulin(王瑞阳等,2018;叶绍棠等,2018)。目前,体外定向诱导胰腺干细胞分化形成功能性胰岛的方案非常繁琐复杂,因此简化诱导方案对优化体外功能性胰岛细胞的再生培养具有重要意义。
在体外诱导胚胎干细胞向功能性β细胞分化的过程中,添加Activin A后胚胎干细胞定向分化形成定型内胚层,然后进一步分化形成内分泌细胞祖细胞及类胰岛细胞(Maehr et al.,2009;Zhang et al.,2009)。Kim等(2013)以Activin A处理人源胰腺导管细胞30 d后,发现Pdx1基因表達显著上调,同时类胰岛细胞表达β细胞特异性标记基因Insulin。在β细胞的形成过程中,Pdx1基因的激活引导祖细胞向β细胞分化并调节β细胞成熟,在维持β细胞功能和调节Insulin分泌方面也发挥着重要作用(Bemardo et al.,2008;Liang et al.,2013;Romer and Sussel,2015;Walczak et al.,2016)。DTZ是一种金属络合物,能与胰岛β细胞中的Zn2+发生特异性结合,形成红色或棕色络合物,因此通过DTZ染色可快速鉴定胰岛β细胞(Bonner-Weir et al.,2000)。在本研究中,Activin A诱导胰腺导管干细胞分化形成的类胰岛细胞,DTZ染色呈阳性,经葡萄糖刺激后分泌Insulin和C-peptide,且共表达β细胞特异性标记物Insulin和Pdx1。各Activin A诱导组间比较发现,20 ng/mL Activin A诱导组类胰岛细胞的Insulin和C-peptide分泌量、Insulin和Pdx1基因表达量均极显著高于其他3个Activin A诱导组。此外,在葡萄糖刺激下空白对照组的细胞也具有分泌Insulin和C-peptide的功能,可能与高浓度葡萄糖具有诱导胰腺导管干细胞向胰岛细胞分化的作用有关(Hardikar et al.,2003;Kim et al.,2013)。本研究虽然全面验证了Activin A体外定向诱导大鼠胰腺导管干细胞分化形成β细胞的能力,但其具体作用机制仍需进一步探究。
4 结论
Activin A能体外诱导大鼠胰腺导管干细胞分化形成胰岛β细胞,且以基础培养液中添加20 ng/mL Activin A的诱导效果最佳。
参考文献:
东彦新,魏艳辉. 2018. 宠物犬糖尿病研究进展[J]. 现代畜牧科技,(12):1-4. [Dong Y X,Wei Y H. 2018. Research progress of pet dog diabetes mellitus[J]. Modern Animal Husbandry Science & Technology,(12):1-4.]
王瑞阳,李延伟,兰瑞霞,许英梅,效梅,安立龙. 2018. 胰腺导管单克隆上皮样干细胞的蛋白表达特征[J]. 中国细胞生物学学报,40(1):57-61. [Wang R Y,Li Y W,Lan R X,Xu Y M,Xiao M,An L L. 2018. Protein expression of monoclonal epithelial stem cells derived from pancrea-tic duct[J]. Chinese Journal of Cell Biology,40(1):57-61.]
效梅,安立龙,葛欣,窦忠英. 2008. 单克隆人胰腺干细胞分离培养体系的建立[J]. 分子细胞生物学报,41(6):450-456. [Xiao M,An L L,Ge X,Dou Z Y. 2008. Establishment of the isolation and culture system for monoclone human pancreatic stem cell[J]. Journal of Molecular Cell Bio-logy,41(6):450-456.]
效梅,安立龙,杨学义,窦忠英. 2009. 移植源于人单克隆胰腺干细胞的胰岛治疗大鼠糖尿病[J]. 中国兽医学报,29(2):191-195. [Xiao M,An L L,Yang X Y,Dou Z Y. 2009. Transplanting induces pancreatic islets from mono-clone human pancreatic stem cells for treatment diabetes in rats[J]. Chinese Journal of Veterinary Science,29(2):191-195.]
叶绍棠,严玉贤,吴江,翟岩辉,效梅,安立龙. 2018. 胰腺导管单克隆上皮样干细胞的多分化潜能[J]. 中国细胞生物学学报,40(1):41-46. [Ye S T,Yan Y X,Wu J,Zhai Y H,Xiao M,An L L. 2018. Multipotent of monoclonal epi-thelial stem cells derived from pancreatic duct[J]. Chinese Journal of Cell Biology,40(1):41-46.]
Ashcroft F M,Rorsman P. 2012. Diabetes mellitus and the β cell:The last ten years[J]. Cell,148(6):1160-1171.
Bernardo A S,Hay C W,Docherty K. 2008. Pancreatic transcription factors and their role in the birth,life and survival of the pancreatic beta cell[J]. Molecular & Cellular Endocrinology,294(1-2):1-9.
Bonner-Weir S,Taneja M,Weir G C,Tatarkiewicz K,Song K H,Sharma A,O'Neil J J. 2000. In vitro cultivation of human islets from expanded ductal tissue[J]. Proceedings of the National Academy of Sciences of the United States America,97(14):7999-8004.
Bonner-Weir S,Toschi E,Inada A,Reitz P,Fonseca S Y,Aye T,Sharma A. 2004. The pancreatic ductal epithelium serves as a potential pool of progenitor cells[J]. Pediatric Diabetes,5(S2):16-22.
Butler A E,Janson J,Bonner-Weir S,Ritzel R,Rizza R A,Butler P C. 2003. Beta-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes[J]. Diabetes,52(1):102-110.
Chen S,Borowiak M,Fox J L,Maehr R,Osafune K,Davidow L,Lam K,Peng L F,Schreiber S L,Rubin L L,Melton D. 2009. A small molecule that directs differentiation of human ESCs into the pancreatic lineage[J]. Nature Che-mical Biology,5(4):258-265.
D'Amour K A,Agulnick A D,Eliazer S,Kelly O G,Kroon E,Baetge E E. 2005. Efficient differentiation of human embryonic stem cells to definitive endoderm[J]. Nature Biotechnology,23(12):1534-1541.
Hardikar A A,Marcus-Samuels B,Geras-Raaka E,Raaka B M,Gershengorn M C. 2003. Human pancreatic precursor cells secrete FGF2 to stimulate clustering into hormone-expressing islet-like cell aggregates[J]. Proceedings of the National Academy of Sciences of the United States Ame-rica,100(12):7117-7122.
Kim H S,Hong S H,Oh S H,Kim J H,Lee M S,Lee M K. 2013. Activin A,exendin-4,and glucose stimulate diffe-rentiation of human pancreatic ductal cells[J]. The Journal of Endocrinology,217(3):241-252.
Kunio H,Shuhei K,Alexander T,Yuichiro N,Shigeru K,Hidetoshi K,Hiroo I. 2017. Closed-channel culture system for efficient and reproducible differentiation of human pluripotent stem cells into islet cells[J]. Biochemical and Biophysical Research Communications,487(2):344-350.
Kuo Y C,Liu Y C,Rajesh R. 2017. Pancreatic differentiation of induced pluripotent stem cells in activin A-grafted ge-latin-poly(lactide-co-glycolide) nanoparticle scaffolds with induction of LY294002 and retinoic acid[J]. Materials Science and Engineering,77:384-393.
Li L,Yi Z,Seno M,Kojima I. 2004. Activin A and betacellulin:Effect on regeneration of pancreatic β-cells in neonatal streptozotocin-treated rats[J]. Diabetes,53(3):608-615.
Liang Q L,Mo Z,Li X F,Wang X X,Li R M. 2013. Pdx1 protein induces human embryonic stem cells into the pancreatic endocrine lineage[J]. Cell Biology International,37(1):2-10.
Maehr R,Chen S,Snitow M,Ludwig T,Yagasaki L,Goland R,Leibel R L,Melton D A. 2009. Generation of pluripotent stem cells from patients with type 1 diabetes[J]. Proceedings of the National Academy of Sciences of the United States America,106(37):15768-15773.
Moriya N,Komazaki S,Takahashi S,Yokota C,Asashima M. 2010. In vitro pancreas formation from Xenopus ectoderm treated with activin and retinoic acid[J]. Development,Growth & Differentiation,42(6):593-602.
Park M K,Han C,Lee K H,Hong S H,Kim H S,Lee Y J,Jeong I K,Noh J H,Yang T Y,Lee M S,Kim K W,Lee M K. 2007. Effects of activin A on pancreatic ductal cells in streptozotocin-induced diabetic rats[J]. Transplantation,83(7):925-930.
Romer A I,Sussel L. 2015. Pancreatic islet cell development and regeneration[J]. Current Opinion in Endocrinolgoy,Diabetes,and Obesity,22(4):255-264.
Skurikhin E G,Ermakova N N,Khmelevskaya E S,Pershina O V,Krupin V A,Ermolaeva L A,Dygai A M. 2014. Di-fferentiation of pancreatic stem and progenitor β-cells into insulin secreting cells in mice with diabetes mellitus[J]. Bulletin of Experimental Biology and Medicine,156(6):726-730.
Tateishi K,He J,Taranova O,Liang G,D'Alessio A C,Zhang Y. 2008. Generation of insulin-secreting islet-like clusters from human skin fibroblasts[J]. The Journal of Biological Chemistry,283(46):31601-31607.
Veiseh O,Langer R. 2015. Diabetes:A smart insulin patch[J]. Nature,524(7563):39-40.
Walczak M P,Drozd A M,Stoczynska-Fidelus E,Rieske P,Grzela D P. 2016. Directed differentiation of human iPSC into insulin producing cells is improved by induced expression of PDX1 and NKX6.1 factors in IPC progenitors[J]. Journal of Translational Medicine,14(1):341.
Zhang D,Jiang W,Liu M,Sui X,Yin X,Chen S,Shi Y,Deng H. 2009. Highly efficient differentiation of human ES cells and iPS cells into mature pancreatic insulin-produ-cing cells[J]. Cell Research,19(4):429-438.
(責任编辑 兰宗宝)

