响应面法优化玉木耳原生质体制备条件
苏文英 杨和川 谭一罗 周振玲 秦裕营 李晓

摘要:【目的】优化玉木耳原生质体制备条件,获得高质量、高产量的原生质体,为后续玉木耳遗传育种、优良性状筛选和品种改良提供良好的试验材料。【方法】以玉木耳原生质体产量为考察指标,结合单因素试验和响应面优化法,建立原生质体制备回归方程,探究玉木耳原生质体的最佳制备条件。【结果】单因素试验结果表明,玉木耳原生质体制备的适宜条件为:酶解时间3 h、酶解液浓度2.0%、酶解温度35 ℃。响应面试验结果表明,各因素对原生质体制备影响程度的排序为:酶解温度>酶解时间>酶解液浓度,酶解温度与酶解时间的交互作用對原生质体产量有极显著影响(P<0.01),酶解时间与酶解液浓度的交互作用影响显著(P<0.05)。响应面试验优化后,获得玉木耳原生质体的制备条件为:酶解液浓度2.0%、酶解时间3.4 h、酶解温度35 ℃,此条件下玉木耳原生质体的平均产量为17.5×106 CFU/mL,与理论产量(17.77×106 CFU/mL)偏差小。【结论】利用响应面法可确立玉木耳原生质体制备的最佳条件,获得较理想的原生质体产量。
关键词: 玉木耳;原生质体;响应面法;制备条件
中图分类号: S646.6 文献标志码: A 文章编号:2095-1191(2020)01-0169-07
Abstract:【Objective】 The objective of this study was to optimize the preparation conditions of protoplasts of Auricularia cornea, and to obtain high quality and high yield protoplasts, which provided good experimental materials for the subsequent genetic breeding, excellent trait screening and variety improvement of A.cornea. 【Method】The protoplast yield of A.cornea was used as an index, and the regression equation of protoplast preparation was established by combi-ning single factor experiment and response surface optimization method to study the optimal preparation conditions of protoplasts of A.cornea. 【Result】The results of single factor test showed that the suitable enzymatic hydrolysis time of protoplast preparation was 3 h, the enzymatic hydrolysis liquid concentration was 2.0%, and the enzymatic hydrolysis temperature was 35 ℃. The results of response surface methodology showed that the degree of influence of various factors on protoplast preparation was: enzymatic hydrolysis temperature>enzymatic hydrolysis time>enzymatic hydrolysis liquid concentration, and the interaction between enzymatic hydrolysis temperature and enzymatic hydrolysis time had a highly significant effect on protoplast yield(P<0.01), and the interaction betweenenzymatic hydrolysis time and enzymatic hydrolysis liquid concentration had significant influence(P<0.05). The results of the response surface test were as follows: enzymatic hydrolysis liquid concentration 2.0%, enzymatic hydrolysis time 3.4 h, enzymatic hydrolysis temperature 35 ℃. Under these conditions, the average yield of protoplasts of A.cornea. was 17.5×106 CFU/mL, which was lower than the theoretical yield(17.77×106 CFU/mL). 【Conclusion】 The response surface method is used to establish the optimal conditions for the preparationof protoplasts of A. cornea, and the optimal protoplast yield is obtained.
Key words: Auricularia cornea; protoplast; response surface method; preparation conditions
Foundation item: Jilin Natural Science Foundation(20170101053JC); Lianyungang Special Financial Project(QNJJ1808)
0 引言
【研究意义】玉木耳(Auricularia cornea Ehrenb.)隶属于木耳科(Auriculariales)木耳属(Auricularia),是毛木耳的白色变种(李晓和张阔谭,2016),为吉林农业大学食药用菌教育部工程中心选育出的适合吊袋小孔出耳的木耳新品种,其质地脆嫩,美味可口,营养丰富(李玉和李晓,2016),且具有抗肿瘤等功效(曹玉春等,2017),经济价值较高,极具开发潜质。目前关于玉木耳的研究主要集中在栽培、生理活性及成分分析方面(李晓和苏文英,2017;Wang et al.,2018),针对其分子遗传学的研究还鲜有报道。原生质体是生理学、细胞学研究与遗传育种的重要材料(谭伟等,2001;李守勉等,2007)。因此,对玉木耳原生质体制备进行系统研究,可为后续玉木耳遗传育种、优良性状筛选和品种改良提供良好的试验材料。【前人研究进展】关于食用菌原生质体的制备已有广泛研究,许修宏等(2011)通过单因素试验获得黑木耳原生质体制备的最佳条件:黑木耳菌丝液体培养8 d,以0.6 mol/L MgSO4·7H2O作渗透压稳定剂,加入2.0%溶壁酶在31 ℃下酶解4 h。孙露等(2012)对毛木耳原生质体制备条件进行优化,获得最佳制备条件:菌龄5 d,溶壁酶浓度1.5%,酶解温度30 ℃,酶解时间3 h,渗透压稳定剂为0.5 mol/L甘露醇。马跃腾等(2015)采用正交试验对秦巴蛹虫草原生质体制备条件进行优化,在最佳制备条件[以0.6 mol/L NaCl为稳渗剂,用混合酶(1%纤维素酶和0.5%蜗牛酶按1∶1的体积比混合)在(26±1)℃下对菌龄6 d的菌丝酶解3 h]下获得的原生质体产量最高。陆欢等(2018)通过响应面法对花脸香蘑原生质体制备条件进行优化,获得最佳制备条件:以0.6 mol/mL甘露醇作稳渗剂,1%溶菌酶+1%蜗牛酶+1%纤维素酶为复合酶解液,酶解温度30 ℃,60~70 r/min摇床振荡培养,酶解4 h。崔玮洁等(2019)对玉木耳原生质体的制备进行研究,通过单因素试验得出以培养15 d的玉木耳菌丝为原材料,0.6 mol/L甘露醇作稳渗剂,2%溶壁酶作酶解液,27 ℃酶解5 h时,可获得最大量的玉木耳原生质体。【本研究切入点】原生質体制备受菌龄、稳渗剂浓度、酶解液浓度、酶解时间及酶解温度等因素的交互影响,响应面优化法能对多个因素的组合效应进行研究,从而获得最优试验条件(Ragonese et al.,2002)。目前关于玉木耳原生质体制备的报道很少,尚不清楚其原生质体制备影响因子间的相互作用效应。【拟解决的关键问题】在单因素试验的基础上,结合响应面法进一步对玉木耳原生质体制备条件进行优化,以期获得高质量、高产量的原生质体,为后续玉木耳遗传育种、优良性状筛选和品种改良提供良好的试验材料。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌株和试剂 玉木耳菌株(菌种编号CCMJ2567)由吉林农业大学食药用菌教育部工程研究中心提供。溶壁酶购自广东省微生物菌种保藏中心,其余药品均为国产分析纯。
1. 1. 2 主要溶液及培养基 稳渗剂(0.6 mol/L):称取甘露醇10.93 g,用蒸馏水定容至100 mL,121 ℃高压灭菌20 min。酶解液:于10 mL稳渗剂(0.6 mol/L)中加入0.2 g溶壁酶,经0.2 μm细菌过滤膜过滤除菌,现配现用。玉木耳液体MYG培养基:麦芽糖10 g,葡萄糖5 g,酵母浸粉5 g,蒸馏水定容至1000 mL,121 ℃高压灭菌20 min。原生质体固体MYG再生培养基:麦芽糖10 g,葡萄糖5 g,酵母浸粉5 g,琼脂10 g,甘露醇109.3 g,蒸馏水定容至1000 mL,121 ℃高压灭菌20 min。
1. 1. 3 主要仪器设备 净化工作台(SW-CJ-2FD,苏州净化设备有限公司)、生物显微镜(XSP-BM-8C,上海彼爱姆光学仪器制造有限公司)、高速冷冻离心机[5804R,艾本德(德国)]、恒温摇床(HZQ-2,金坛市城东超韵实验仪器厂)、恒温金属浴(HX-20L,上海沪析实业有限公司)和灭菌锅(YM75Z,上海三申医疗器械有限公司)。
1. 2 试验方法
1. 2. 1 原生质体制备 将玉木耳菌丝块接种至液体MYG培养基中,25 ℃静置培养13 d,去除液体培养基,将收集得到的玉木耳菌丝用无菌蒸馏水清洗2次,0.6 mol/L稳渗剂洗涤2次,再用已灭菌的滤纸吸取多余水分。称取处理后的菌丝200~300 mg置于1.5 mL离心管中,加入3倍菌丝体积的酶解液,于30 ℃恒温金属浴中酶解3 h,得到玉木耳原生质体粗提液。在超净工作台中,将原生质体粗提液用已灭菌的脱脂棉过滤,滤液在室温、3000 r/min下离心5 min,去除上清液,再用0.6 mol/L稳渗剂洗涤2次,得到纯化的原生质体,将其立即悬浮于0.6 mol/L稳渗剂中,显微镜下用血球计数板计数,即为原生质体产量。
1. 2. 2 玉木耳原生质体再生 将新鲜制备的原生质体悬液用0.6 mol/L稳渗剂稀释至1×104 CFU/mL,取100 μL涂布于固体MYG再生培养基上;同时用灭菌蒸馏水将原生质体悬液稀释至同等浓度,取100 μL涂布于固体MYG再生培养基上作为对照,将试验组与对照组同时置于25 ℃恒温培养箱培养10 d后计算原生质体再生率(韩业君等,2004)。再生率(%)=(再生菌落数-对照组菌落数)/原生质体总数×100。
1. 2. 3 单因素试验设计 分别考察酶解时间(1、2、3、4和5 h)、酶解液浓度(0.5%、1.0%、1.5%、2.0%和2.5%)和酶解温度(20、25、30、35和40 ℃)3个因素对玉木耳原生质体制备的影响,每个试验3次重复。
1. 2. 4 响应面试验设计 在单因素试验基础上,依据Box-Behnken Design设计原理,选取酶解时间(A)、酶解液浓度(B)和酶解温度(C)为考察因素,以原生质体产量(Y)为响应值,进行3因素3水平的响应面试验设计,以确定玉木耳原生质体的最佳制备条件。因素及水平见表1。
1. 3 统计分析
采用Excel 2016对试验数据进行统计分析,利用SPSS 17.0进行显著性差异分析,Design-Expert 8.0.6对响应面试验设计方案及结果进行分析。
2 结果与分析
2. 1 单因素试验结果
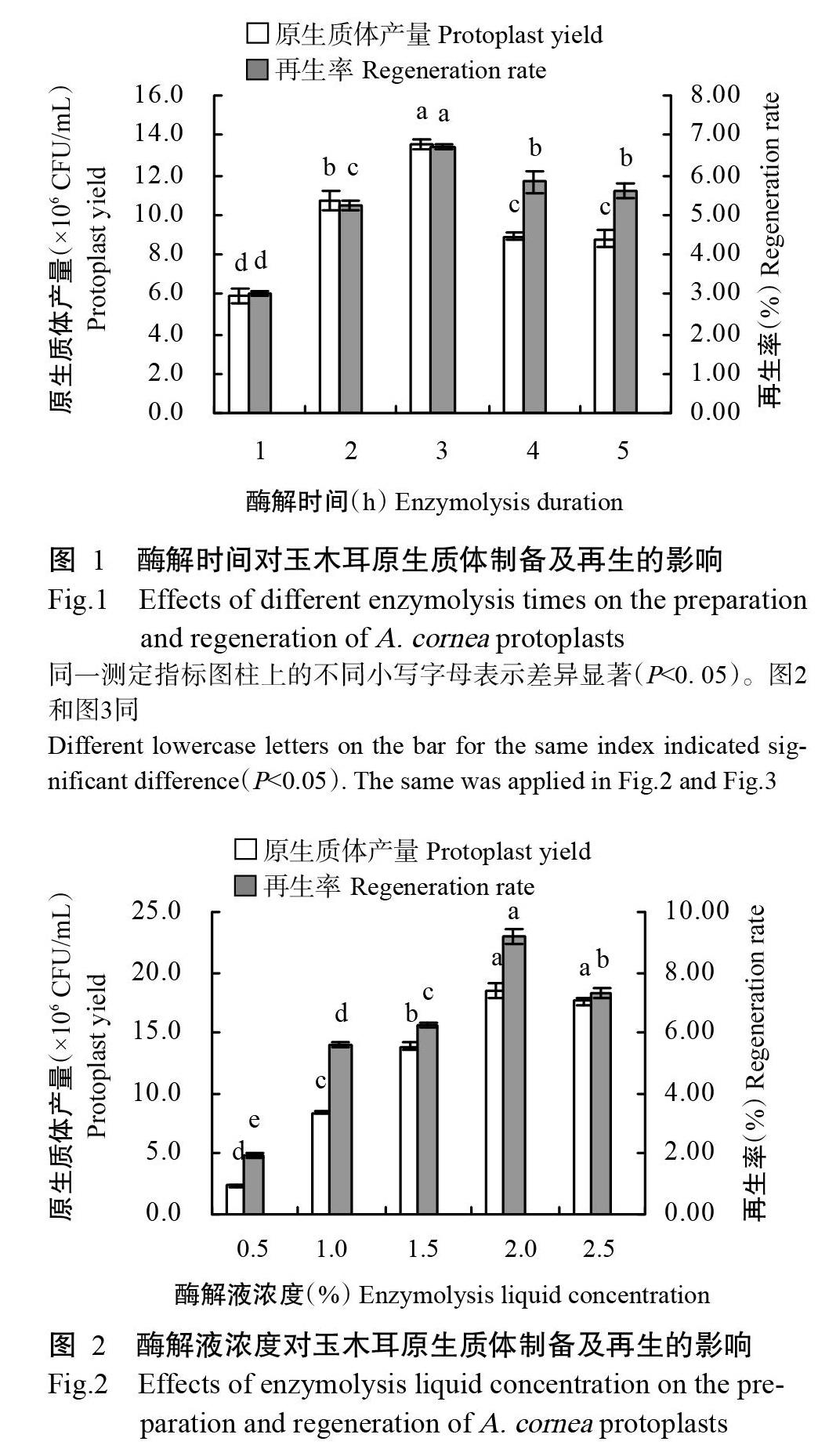
2. 1. 1 酶解时间对玉木耳原生质体制备的影响
不同食用菌的细胞壁厚薄不同,所以酶解时间也不相同。由图1可知,在酶解温度30 ℃、酶解液浓度2.0%的条件下,随着酶解时间的延长,玉木耳原生质体产量和再生率不断增加,当酶解时间为3 h时,原生质体产量和再生率最高,分别为13.5×106 CFU/mL和6.71%,均显著高于其他酶解时间的原生质体产量和再生率(P<0.05,下同);但酶解时间超过3 h后,原生质体产量和再生率反而不断降低。因此,选择2~4 h为适宜酶解时间。
2. 1. 2 不同酶解液浓度对玉木耳原生质体制备的影响 由图2可知,在酶解温度30 ℃、酶解时间3 h的条件下,随着酶解液浓度的增加,玉木耳原生质体产量和再生率不断显著增加,当酶解液浓度增至2.0%时,原生质体产量和再生率均达最高值,分别为18.5×106 CFU/mL和9.17%;酶解液浓度大于2.0%后,原生质体产量和再生率有所下降,但酶解液浓度2.5%与2.0%的原生质体产量间无显著差异(P>0.05)。因此,选择1.5%~2.5%为适宜酶解液浓度。
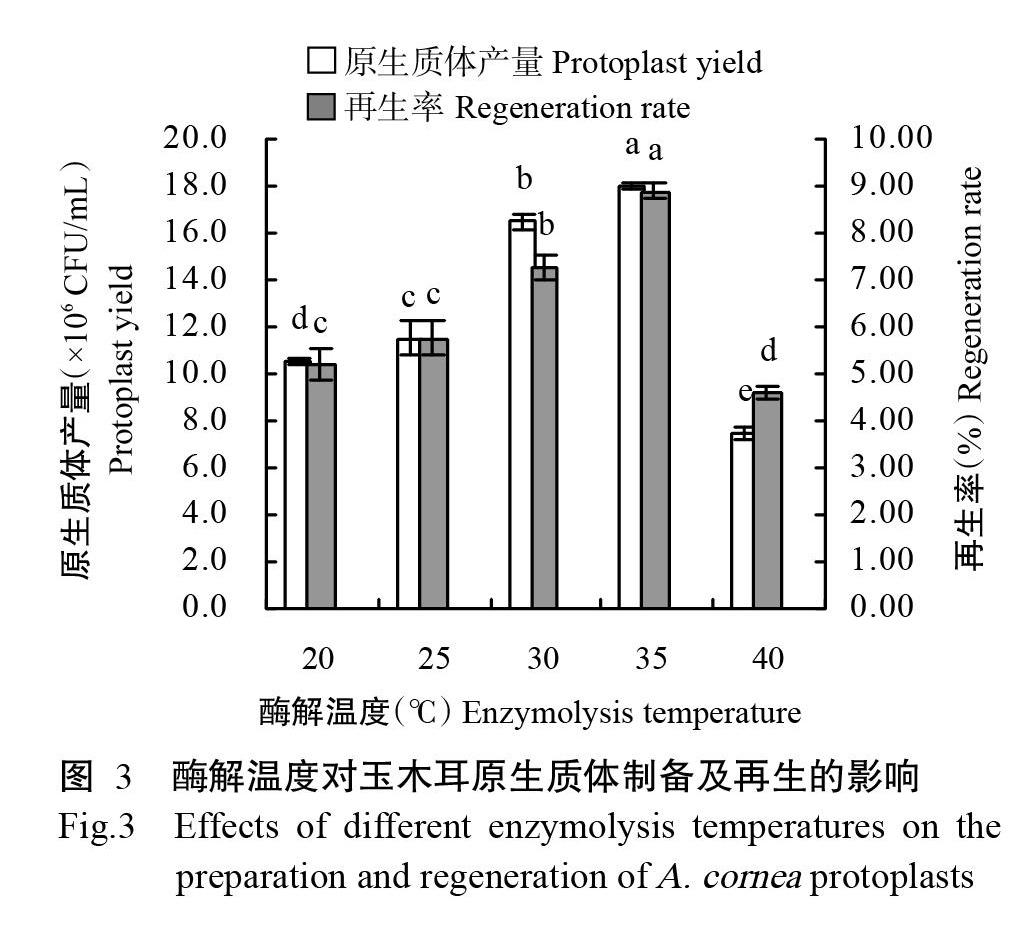
2. 1. 3 不同酶解温度对玉木耳原生质体制备的影响 由图3可知,在酶解液浓度2.0%、酶解时间3 h的条件下,随着酶解温度的升高,玉木耳原生质体产量和再生率也随之升高,当酶解温度达35 ℃时,原生质体产量和再生率最高,分别为18.0×106 CFU/mL和8.90%;但酶解温度高于35 ℃时,原生质体产量和再生率反而快速降低。因此,选择25~35 ℃为适宜酶解温度。
2. 2 玉木耳原生质体制备条件优化结果
2. 2. 1 Box-Behnken设计试验结果 根据单因素试验结果,采用Design-Expert 8.0.6设计试验方案,共设计17个试验组,试验结果见表2。对Box-Behnken试验结果进行回归方差分析(表3),得到回归方程:Y=-211.85375+63.56500A+85.25250B+2.79725C-2.00000AB-0.52500AC+0.055000BC-7.45875A2-19.88500B2-0.013850C2。由表3可知,該模型P<0.01,具有极高的显著性,失拟项P=0.2872>0.05,R2adj=0.9853,说明试验无失拟因素存在。因此,该回归方程拟合度较好,可信度较高,可用于预测玉木耳原生质体制备的最佳条件。同时,一次项C、交互项AC及二次项A2和B2为极显著(P<0.01,下同),说明酶解温度对原生质体产量有极显著影响,酶解时间与酶解温度对原生质体产量有极显著交互影响;一次项A、B和交互项AB为显著,说明酶解时间和酶解液浓度,以及二者的交互作用对原生质体产量均有显著影响。
2. 2. 2 响应面交互作用分析结果 由图4可知,酶解时间(A)与酶解液浓度(B)的交互作用影响显著,酶解时间对原生质体产量的影响大于酶解液浓度,表现为二者交互作用的曲面较陡,在二者交互作用的等高线中,沿A轴移动的等高线比沿B轴的等高线更密;酶解时间(A)与酶解温度(C)的交互作用影响极显著,酶解温度对原生质体产量的影响较酶解时间大,表现为二者交互作用的曲面最陡,酶解温度的等高线比酶解时间的等高线更密;而酶解液浓度(B)与酶解温度(C)的交互作用较弱,酶解液温度对原生质体产量的影响较酶解液浓度大,表现为酶解温度与酶解液浓度交互作用的曲面较平缓,酶解温度的等高线较酶解液浓度的等高线密。因此根据曲面陡峭程度及等高线密集程度,可以判断出各因素对原生质体制备影响程度的排序:酶解温度>酶解时间>酶解液浓度,两因素间交互作用对原生质体产量的影响程度排序为:AC>AB>BC。这与表3的回归模型方差分析结果一致。
2. 2. 3 验证试验结果 响应面试验优化后玉木耳原生质体的制备条件为:酶解液浓度2.02%、酶解时间3.4 h、酶解温度35 ℃,预测产量为17.77×106 CFU/mL。考虑试验的可行性,将制备条件调整为:酶解液浓度2.0%、酶解时间3.4 h、酶解温度35 ℃,在此条件下进行3次重复试验,得到玉木耳原生质体的平均产量为17.5×106 CFU/mL,与预测结果偏差小,试验结果可靠,说明响应面法对于玉木耳原生质体条件进行优化具有可行性。
3 讨论
本研究结合单因素试验和响应面法对玉木耳原生质体制备的关键因素(酶解液浓度、酶解时间和酶解温度)进行优化,结果表明,酶解温度对玉木耳原生质体产量影响最大。适宜的酶解温度有助于溶壁酶发挥最佳的裂解作用,温度过低会降低酶促反应速率,高温则会降低溶壁酶活性和损伤已游离的原生质体(张丽霞和郭成金,2008),致使原生质体产量和再生率降低。本研究采用响应面法获得各影响因子对原生质体产量的回归方程,再通过回归方程计算出各参数,所获得的最佳酶解温度综合考虑了各因素间的交互作用,结果发现玉木耳原生质体制备的最佳酶解温度为35 ℃,高于崔玮洁等(2019)通过单因素试验筛选获得的酶解温度27 ℃,可能与其单因素试验设定的酶解时间(5 h)较长有关。酶解时间对玉木耳原生质体产量的影响次于酶解温度,优化后的酶解时间为3.4 h。王昱等(2013)研究认为,酶解时间过长,较早释放出的原生质体无细胞壁保护而破裂,其活性下降难于再生;酶解时间过短,菌丝体酶解不充分,原生质体未被充分释放,也会导致原生质体产量较低。本研究结果表明,酶解液浓度对原生质体产量也有显著影响,在一定范围内,酶解液浓度越高,原生质体产量越高,但浓度超过2.0%后,原生质体产量下降,与崔玮洁等(2019)的研究结果一致。这可能是由于高浓度酶液会对原生质体的膜造成影响,使原生质体脱壁太彻底,导致原生质体产量和再生率降低(孙剑秋和周东坡,2002)。
本研究获得的玉木耳原生质体最佳制备条件为:酶解液浓度2.0%、酶解时间3.4 h、酶解温度35 ℃,在此条件下获得的玉木耳原生质体产量为17.5×106 CFU/mL。本研究结果与崔玮洁等(2019)通过单因素试验得出的结果存在一定差异,一方面可能是因为崔玮洁等(2019)只对单因素结果进行分析,没有进一步研究各因素间的相互作用;另一方面可能是由于试验中供试菌株菌龄的不同所致。菌龄也是影响原生质体制备的重要因素。有研究表明,鲜菌丝的细胞壁更易被酶解液降解,且产量活力高,老化的菌丝体细胞壁较厚、次生物质多,酶解相对不易,导致原生质体产量下降(张文学等,2003)。本研究前期对玉木耳菌丝培养时,发现培养15 d的玉木耳菌丝菌皮较厚,不利于后期破碎酶解,在此基础上本研究选取菌龄13 d的玉木耳菌丝为试验材料。
此外,在研究过程中发现玉木耳原生质体再生率基本低于10.0%,可能与其菌丝生长速度较慢等自身遗传特性有关。孙露等(2012)认为,食用菌原生质体再生率与其生长速度呈正相关,生长速度慢的原生质体再生率相对也低。稳渗剂种类及再生培养基的成分也是影响原生质体再生率的重要因素(韩增华等,2008;李楠和许修宏,2009;卢月霞等,2015;刘宏宇等,2018),但具体原因有待进一步研究。
4 结论
本研究在单因素试验基础上通过响应面法对玉木耳原生质体的制备条件进行优化,建立了原生质体产量的回归模型,确定玉木耳原生质体制备的最佳条件为:酶解液浓度2.0%、酶解时间3.4 h、酶解温度35 ℃,即可获得较理想的原生质体产量,为进一步开展玉木耳原生质体融合育种及遗传研究提供技术支持。
参考文献:
曹玉春,包海鹰,李晓,图力古尔,李玉. 2017. 玉木耳提取物对H22荷瘤小鼠体内抗肿瘤作用研究[J]. 菌物學报,36(9):1289-1298. [Cao Y C,Bao H Y,Li X,Bau T,Li Y. 2017. Anti-tumor activities of Auricularia cornea fruiting body extract in H22 bearing mice[J]. Mycosystema,36(9):1289-1298.]
崔玮洁,赵一橦,宋冰,代月婷,孙磊,付永平,李玉. 2019. 玉木耳原生质体制备条件的优化及再生菌株的变异检测[J]. 分子植物育种,17(18):6006-6012. [Cui W J,Zhao Y T,Song B,Dai Y T,Sun L,Fu Y P,Li Y. 2019. Optimization of protoplast preparation of Auricularia cornea(Yumuer) and variation detection of regenerated strain[J]. Molecular Plant Breeding,17(18):6006-6012.]
韩业君,曹晖,陈明杰,潘迎捷. 2004. 草菇原生质体制备与再生及诱变效应研究[J]. 食用菌学报,11(2):1-6. [Han Y J,Cao H,Chen M J,Pan Y J. 2004. A study on the protoplast preparation,regeneration of Volvariella volvacea and the mutagenetic effect[J]. Acta Edulis Fungi,11(2):1-6.]
韩增华,张丕奇,戴肖东,孔祥辉,马庆芳,张介驰. 2008. 黑木耳原生质体制备, 再生及单核体荧光鉴定[J]. 食用菌学报,15(3):13-17. [Han Z H,Zhang P Q,Dai X D,Kong X H,Ma Q F,Zhang J C. 2008. Preparation,regeneration and identification of monokaryotic protoplasts of Auricularia auricula[J]. Acta Edulis Fungi,15(3):13-17.]
李楠,许修宏. 2009. 黑木耳原生质体制备及再生的研究[J]. 东北农业大学学报,40(7):34-37. [Li N,Xu X H. 2009. Protoplast preparation and regeneration of Auricularia auricula 29[J]. Journal of Northeast Agricultural University,40(7):34-37.]
李守勉,李明,邢蕾,王俊玲,张殿生. 2007. 食用菌原生质体技术应用的研究[J]. 安徽农业科学,35(25):7770-7771. [Li S M,Li M,Xing L,Wang J L,Zhang D S. 2007. Application of protoplast technology of edible mushroom[J]. Journal of Anhui Agricultural Sciences,35(25):7770-7771.]
李晓,苏文英. 2017. 玉木耳大棚挂袋出耳管理技术[J]. 食药用菌,25(6):385-387. [Li X,Su W Y. 2017. Shed han-ging bag management technology of Auricularia cornea[J]. Edible and Medicinal Mushrooms,25(6):385-387.]
李晓,张阔谭. 2016. 木耳属白色变异菌株的研究进展[J]. 食药用菌,24(4):230-233. [Li X,Zhang K T. 2016. A review of the advances of the research on a white variant strain in Genus Auricularia[J]. Edible and Medicinal Mushrooms,24(4):230-233.]
李玉,李晓. 2016. 图说玉木耳优质高产栽培[M]. 北京:中国农业出社. [Li Y,Li X. 2016. Good quality and high yield cultivation of Auricularia cornea Ehrenb[M]. Beijing:China Agriculture Press.]
刘宏宇,郭鹏程,姚方杰. 2018. 榆耳菌丝原生质体制备及再生的研究[J]. 东北农业科学,43(2):60-64. [Liu H Y,Guo P C,Yao F J. 2018. Optimization of preparation and regeneration conditions of Gloeostereum incarnatum mycelium protoplast[J]. Journal of Northeast Agricultural Sciences,43(2):60-64.]
陆欢,王春晖,姜性坚,徐宁. 2018. 花脸香蘑原生质体的制备及再生条件[J]. 菌物学报,37(6):737-745. [Lu H,Wang C H,Jiang X J,Xu N. 2018. Protoplast preparation and regeneration of Lepista sordida[J]. Mycosystema,37(6):737-745.]
卢月霞,郑素月,柳焕章. 2015. 鸡腿菇原生质体制备与再生研究[J]. 江苏农业科学,43(7):260-261. [Lu Y X,Zheng S Y,Liu H Z. 2015. Study on protoplast preparation and regeneration of Coprinus comatus[J]. Jiangsu Agricultural Sciences,43(7):260-261.]
马跃腾,杜双田,丁建,纪晓朋,鲍蕊,李珍. 2015. 秦巴蛹虫草原生质体的制备及再生条件研究[J]. 西北农林科技大学学报(自然科学版),43(9):196-202. [Ma Y T,Du S T,Ding J,Ji X P,Bao R,Li Z. 2015. Study on isolation and regeneration of Qinba Cordyceps militeris protoplasts[J]. Journal of Northwest A & F University(Natural Scien-ce Edition),43(9):196-202.]
孫剑秋,周东坡. 2002. 微生物原生质体技术[J]. 生物学通报,37(7):9-11. [Sun J Q,Zhou D P. 2002. Microbial protoplast technology[J]. Bulletin of Biology,37(7):9-11.]
孙露,姚方杰,方明. 2012. 毛木耳原生质体制备与再生条件的研究[J]. 中国食用菌,31(3):35-37. [Sun L,Yao F J,Fang M. 2012. Study on the protoplast preparation conditions of Auricularia polytricha[J]. Edible Fungi of China,31(3):35-37.]
谭伟,郑林用,彭卫红,肖在勤. 2001. 原生质体融合技术在食用菌育种上的应用研究进展[J]. 西南农业学报,14(S1):120-123. [Tan W,Zheng L Y,Peng W H,Xiao Z Q. 2001. Advances in research on application of protoplast fusion technique in mushroom breeding[J]. Southwest China Journal of Agricultural Sciences,14(S1):120-123.]
王昱,王义,王康宇,叶鹏飞,孙春玉,张美萍. 2013. 灵芝原生质体的制备与再生研究[J]. 北方园艺,(16):184-188. [Wang Y,Wang Y,Wang K Y,Ye P F,Sun C Y,Zhang M P. 2013. Study on preparation and regeneration of the protoplasts from Ganoderma lucidum[J]. Northern Horticulture,(16):184-188.]
许修宏,孟琦,刘华晶,李亮. 2011. 黑木耳菌丝原生质体的制备﹑再生及单核鉴定研究[J]. 东北农业大学学报,42(8):96-100. [Xu X H,Meng Q,Liu H J,Li L. 2011. Study on protoplast isoulation and regeneration and monokaryotization of Auricularia auricula[J]. Journal of Northeast Agricultural University,42(8):96-100.]
张丽霞,郭成金. 2008. 猪苓原生质体制备与再生条件的研究[J]. 中国食用菌,27(5):35-37. [Zhang L X,Guo C J. 2008. Study on protoplast preparation and regeneration of Grifola umbellata (Pers.) fries[J]. Edible Fungi of China,27(5):35-37.]
张文学,刘春莉,蒋宏. 2003. 利用原生质体融合和诱变育种技术选育高酶活菌株[J]. 四川大学学报(工程科学版),35(6):66-70. [Zhang W X,Liu C L,Jiang H. 2003. Screening of higher enzyme activity strain with protoplast fusion and mutagenisis[J]. Journal of Sichuan University(Engineering Science Edition),35(6):66-70.]
Ragonese R,Macka M,Hughes J,Petocz P. 2002. The use of the Box-Behnken experimental design in the optimisation and robustness testing of a capillary electrophoresis method for the analysis of ethambutol hydrochloride in a pharmaceutical formulation[J]. Journal of Pharmaceutical and Biomedical Analysis,27(6):995-1007.
Wang X X,Lan Y F,Zhu Y F,Li S S,Liu M,Song X L,Zhao H J,Liu W R,Zhang J J,Wang S S,Jia L. 2018. Hepatoprotective effects of Auricularia cornea var. Li. polysaccharides against the alcoholic liver diseases through different metabolic pathways[J]. Scientific Reports,8(1):7574. doi:10.1038/s41598-018-25830-w.
(责任编辑 罗 丽)

