黄瓜花叶病毒贵州辣椒分离物外壳蛋白基因序列分析
付尚松 王莉爽 杨学辉 蒋选利


摘要:【目的】分析贵州辣椒主产区黄瓜花叶病毒(Cucumber mosaic virus,CMV)分离物的分子变异情况,为抗病毒辣椒品种选育及辣椒病毒病的防控提供科学依据。【方法】以来自贵州省8个县(榕江、大方、石阡、安龙、绥阳、德江、关岭和惠水)的16个辣椒CMV分离物为材料,采用逆转录—聚合酶链反应(RT-PCR)扩增辣椒CMV分离物的CP基因序列,利用DNAMAN和BioEdit对CMV分离物的CP基因序列进行比对分析,用MAGE 7.0的鄰接法(Neighbor-joining,NJ)构建系统发育进化树,分析贵州辣椒CMV分离物的遗传多样性。【结果】将16个贵州辣椒CMV分离物的CP基因核苷酸序列及编码蛋白氨基酸序列与CMV亚组代表株系进行一致性比对,结果表明,贵州辣椒CMV分离物与CMV亚组分离物的CP基因核苷酸序列一致性为89.7%~100.0%、CP蛋白氨基酸序列一致性为96.8%~100.0%。系统进化分析结果表明,CMV-DF、CMV-RJ、CMV-SQ、CMV-SY、CMV-DJ与CMV I代表株系聚为一个亚支,但更趋近于CMV亚组IB株系,CMV-HS、CMV-GL、CMV-AL与CMV亚组Ⅱ株系聚为另一个亚支,说明侵染贵州辣椒的CMV株系有两大组群,其中大方、榕江、绥阳、石阡和德江CMV分离物归属于CMV亚组IB株系,惠水、关岭和安龙CMV分离物归属于CMV亚组Ⅱ株系。【结论】不同地域的贵州辣椒CMV株系发生了变异。
关键词: 黄瓜花叶病毒;辣椒;CP基因;贵州
中图分类号: S436.421.1 文献标志码: A 文章编号:2095-1191(2020)01-0108-07
Abstract: 【Objective】The molecular variation of Cucumber mosaic virus(CMV) pepper isolates in the main produ-cing areas of pepper in Guizhou was analyzed to provide theoretical basis for the breeding of antiviral pepper varieties and preventive measures of CMV infection. 【Method】Taking 16 pepper CMV isolates from 8 counties (Rongjiang, Dafang, Shiqian, Anlong, Suiyang, Dejiang, Guanling and Huishui) of Guizhou Province as materials, reverse transcription-polymerase chain reaction (RT-PCR) amplification, cloning, sequencing and other methods were used to obtain the full length CP gene of CMV isolates from pepper. The DNAMAN and BioEdit were used to analyze and compare the CP gene sequence of CMV isolates. The adjacency algorithm of MAGE 7.0(Neighbor-joining, NJ) constructed a phylogene-tic tree and analyzed the genetic diversity of Guizhou pepper CMV isolates. 【Result】The CP nucleotide sequences and the amino acid sequences encoding the protein of 16 CMV isolates from Guizhou pepper were compared with the representative strains of CMV subgroup. The results showed that the nucleotides of CMV isolate and CMV subgroup isolate sequence identity was 89.7%-100.0%, amino acid identity was 96.8%-100.0%. Phylogenetic analysis showed that the CMV-DF, CMV-RJ, CMV-SQ, CMV-SY, CMV-DJ and CMV I representative lines were clustered into one subbranch, but closer to the CMV subgroup IB line; CMV- HS, CMV-GL, CMV-AL and CMV subgroup Ⅱ strains were clustered into another subbranch. These results showed that there were two major groups of CMV strains infected with pepper in Guizhou, Dafang, Rongjiang, Suiyang, Shiqian and Dejiang CMV isolates belonged to CMV subgroup IB strain, Huishui, Guanling and Anlong CMV isolates belonged to CMV subgroup Ⅱ strain. 【conclusion】Variation happens on CMV Guizhou pepper isolates in different geographical origins.
Key words: Cucumber mosaic virus; pepper; CP gene; Guizhou
Foundation item: Guizhou Agricultural key Project(Qiankehezhicheng〔2016〕2567)
0 引言
【研究意义】黄瓜花叶病毒(Cucumber mosaic virus,CMV)是雀麦花叶病毒科(Bromoviridae)黄瓜花叶病毒属(Cucumovirus)的代表成员(丁超,2017)。贵州是辣椒种植大省,目前CMV已成为危害贵州辣椒的主要病毒种类之一,对贵州辣椒的产量和品质造成严重影响。CMV基因组序列的重排重组会影响CMV的株系分化,并影响CMV的传播蔓延,因此,明确CMV辣椒分离物的亚组归属有利于揭示病毒的基因组分子变异、基因结构与功能及系统进化关系,对研究CMV的分子变异、致病机理及贵州辣椒黄瓜花叶病毒病防控具有重要意义。【前人研究进展】采用抗原直接包被酶联免疫吸附测定(ELISA)(吴畏等,2014)、反转录—环介导等温扩增(RT-LAMP)(汤亚飞等,2016)、逆转录—聚合酶链反应(RT-PCR)(刘湘宁,2016)和高通量测序(冯耿等,2017)等均能检测鉴定出病毒病的种类。周彤等(2012)采用RT-LAMP快速检测到水稻黑条矮缩病毒(RBSDV);王芳等(2015)利用siRNA高通量测序技术检测发现安徽东至、宣城和亳州烟草上存在马铃薯Y病毒(PVY)、黄瓜花叶病毒(CMV)、烟草花叶病毒(TMV)、烟草脉带花叶病毒(TVMBV)、芸薹黄化病毒(BrYV)、芜菁黄化病毒(TuYV)、甜菜西方黄化病毒(BWYV)及一种与Mint virus 1部分同源的新病毒;裴凡(2016)采用RT-PCR对广东省多个地区125份辣椒样品进行检测,共检测到18种病毒;陈灵芝等(2017)采用双抗体夹心酶联免疫吸附法检测出甘肃省农业科学院蔬菜研究所辣椒含有烟草花叶病毒(TMV)、马铃薯V病毒(PVV)和马铃薯S病毒(PVS);王少立(2018)采用RT-PCR检测山东地区542份疑似病毒的辣椒样品,共检测到甜菜西方黄化病毒(BWYV)、南瓜蚜传黄化病毒(CABYV)、辣椒脉黄化病毒(PeVYV)、辣椒潜隐病毒1(PCV-1)和辣椒潜隐病毒2(PCV-2)等5种病毒。其中,RT-PCR是一种应用广泛的研究基因组序列多样性的技术手段,该技术操作简单、灵敏性强、检测耗时短。黎微等(2008)应用RT-PCR、Msp I和EcoR I双酶切及克隆测序等分子生物学手段对云南主要地区辣椒CMV分離物进行亚组鉴定,发现侵染云南辣椒的CMV主要为亚组Ⅰ。陈玉珍等(2016)采用RT-PCR检测湖南永州辣椒CMV并进行序列分析,结果表明CMV-N7 CP及2b基因的核酸序列属于CMV亚组IB。周东等(2017)利用RT-PCR克隆了新疆辣椒LJ-10 CMV的RNA1、RNA2和RNA3全基因组片段,其序列分析及系统进化树分析结果表明,该分离物属于CMV亚组IB。【本研究切入点】前期对贵州CMV的报道主要是采用ELISA进行病毒种类检测(王莉爽等,2015b),而采用RT-PCR能扩增出目的片段克隆测序,可用于分析比较贵州辣椒分离物与其他地区分离物的差异、进化及变异规律。目前,有关侵染贵州辣椒的CMV株系研究未见报道。【拟解决的关键问题】运用RT-PCR扩增贵州不同辣椒主产区不同辣椒品种上CMV分离物的CP基因序列并进行测序分析,利用DNAMAN、BioEdit和MEGA 7.0分析贵州辣椒CMV分离物的遗传多样性,为抗病毒辣椒品种选育及辣椒病毒病的防控提供科学依据。
1 材料与方法
1. 1 试验材料
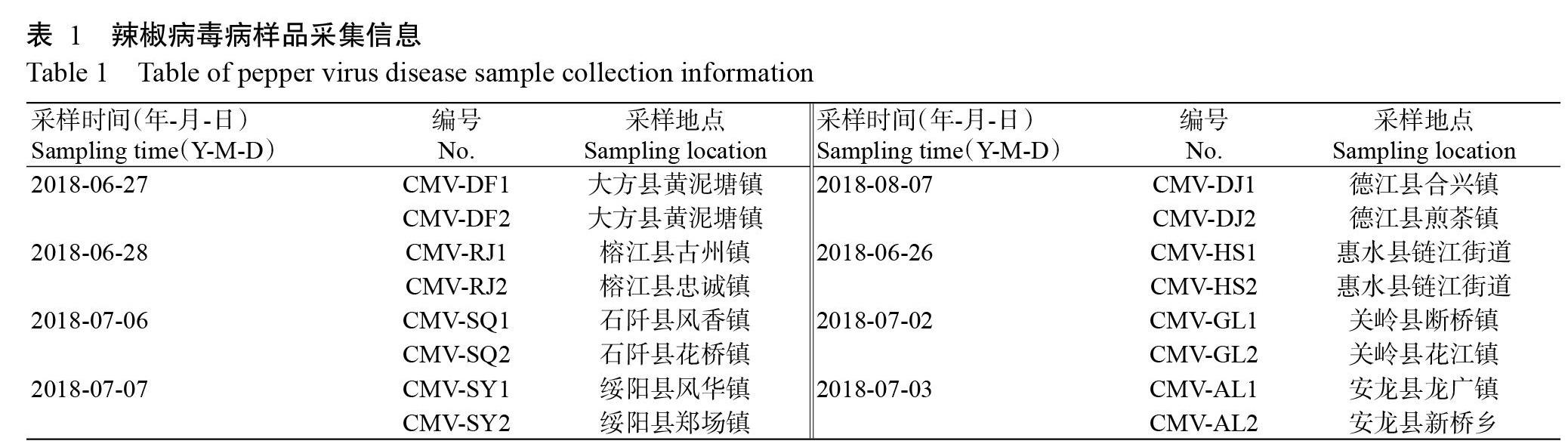
供试16个辣椒病毒病样品来自贵州省榕江、大方、石阡、安龙、绥阳、德江、关岭和惠水8个县表现花叶、斑驳的辣椒叶片,置于-20 ℃冰箱保存备用。样品信息见表1。
1. 2 叶片总RNA提取
采用RNAprep Pure Plant Kit(DP432)植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取辣椒叶片总RNA,具体步骤参照试剂盒说明进行操作。
1. 3 cDNA合成、PCR扩增及测序
以提取的辣椒叶片总RNA为模板,使用GoScriptTM Reverse Transcription System(Promega,A5001)反转录合成cDNA,具体方法参考试剂盒说明书。用2×Easy Taq[?] PCR SuperMix(Transgen biotech,AS111)进行基因扩增。特异性引物:CMV-F:5'-TCTCATGGATGCTTCTCCGCG-3'和CMV-R:5'-CCGTAAGCTGGATGGACAACC-3'。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,56 ℃ 40 s,72 ℃ 1 min,共进行32个循环;72 ℃延伸5 min,4 ℃保存。RT-PCR产物经1%琼脂糖凝胶电泳检测,切胶回收目的片段。目的片段与pEASY-T5 Zero Cloning Kit (Transgen biotech,CT501)进行连接,然后转化大肠杆菌DH5α感受态细胞,经蓝白斑筛选,PCR鉴定阳性菌落。阳性克隆送至重庆擎科兴业生物技术有限公司测序。
1. 4 CP基因序列分析
利用DNAMAN和BioEdit对CMV各亚组代表株系ⅠA(Fny D10538)、ⅠB(Am JQ362394)、Ⅱ(lily DQ885291)和贵州不同地区CMV分离物的CP基因核苷酸序列和CP蛋白氨基酸序列进行比对,分析其保守和非保守结构。运用MEGA 7.0的邻接法(Neighbor-joining,NJ)构建基于CP基因核苷酸序列的系统发育进化树,以同属的花生矮化病毒(Peanut stunt virus,PSV)ER株系为外群。
为更好地分析其进化历程和亲缘关系,选取已报道的标准CMV-Fny美国株系及亚洲的中国、日本、韩国和印度等地区的CMV株系进行序列比对分析。GenBank登录号分别为:(1)CMV IA株系:M AF268599、Fny D10538、Y D12499和Legume D16405;(2)CMV IB株系:As X77855、XJ2 DQ070746、DanShen AY600- 989、Am JQ362394、HLJ DQ459481和CH JX993913;(3)CMVⅡ株系:Indian AM396983、lily DQ885291和PaFM AB109908。PSV-ER外群序列登录号U15730。
2 结果与分析
2. 1 CMV样品鉴定结果
采集花叶、黄化等症状辣椒病毒病样品(图1),提取的RNA反转录合成cDNA模板,用CMV的特异性引物进行PCR扩增,得到大小为900 bp的片段,与预期结果一致(图2)。将目标片段连接到T载体后测序,BLAST序列比对结果显示,该片段包含长657 bp的完整CMV CP基因序列,编码218个氨基酸。
2. 2 CMV分离物的CP基因核苷酸序列及编码蛋白氨基酸序列分析结果
将贵州8个县16个辣椒CMV分离物的CP基因核苷酸序列及编码蛋白氨基酸序列与CMV各亚组代表株系IA(Fny D10538)、IB(Am JQ362394)、Ⅱ(lily DQ885291)和外群PSV-ER进行一致性比对分析,结果(表2和表3)表明,贵州不同地区的CMV分离物与CMV亚组分离物的CP基因核苷酸序列一致性为89.7%~100.0%,CP蛋白氨基酸一致性为96.8%~100.0%。其中,CMV-DF、CMV-RJ、CMV-SQ、CMV-SY和CMV-DJ等10个分离物与CMV-Am、CMV-Fny和CMV-lily的CP基因核苷酸序列一致性分别为98.9%~99.2%、98.3%和89.7%,其蛋白氨基酸序列与CMV-Am和CMV-Fny的一致性均为100.0%,与CMV-lily的一致性为96.8%;CMV-HS、CMV-GL和CMV-AL等6个分离物与CMV-Am、CMV-Fny和CMV-lily的CP基因核苷酸序列一致性分别为89.2%、88.9%和98.0%,其蛋白氨基酸序列与CMV-Am和CMV-Fny的一致性均为96.8%,与CMV-lily的一致性为100.0%。
2. 3 CMV分离物的CP蛋白氨基酸序列比较
对贵州辣椒CMV分离物与CMV各亚组代表株系的CP蛋白氨基酸序列进行比较,结果(图3)表明,貴州16个CMV分离物与CMV亚组代表株系在CP蛋白氨基酸序列有23个位点(第5、7、10、12、20、21、24、25、27、31、34、36、48、130、144、147、171、172、193、196、212、214和217)发生变化,其中,第1~40位氨基酸间有12个位点不同;惠水、关岭和安龙的6个CMV分离物CP蛋白氨基酸序列的变化位点与CMV-lily株系相同,属于CMVⅡ株系;大方、榕江、石阡、绥阳和德江10个CMV分离物CP蛋白氨基酸序列的变化位点与CMV-Am和CMV-Fny株系相同,属于CMVⅠ株系。从这些分离物的来源看,不同地区CMV分离物的CP蛋白氨基酸序列存在一定的差异性。
2. 4 CMV分离物的系统发育进化树分析结果
根据已报道CMV亚组各株系的CP基因核苷酸序列和贵州不同地区辣椒CMV分离物的CP基因核苷酸序列,利用MEGA 7.0构建系统发育进化树,结果(图4)显示,所有CMV分离物聚为两大分支,其中源自大方、榕江、石阡、绥阳和德江5个县的CMV-DF1、CMV-DF2、CMV-RJ1、CMV-RJ2、CMV-SQ1、CMV-SQ2、CMV-SY1、CMV-SY2、CMV-DJ1、CMV-DJ2等10个辣椒CMV分离物与CMVⅠ代表株系聚为一个大支,又与CMV IB株系的DanShen AY600989、Am JQ362394、As X77855、XJ2 DQ070746、HLJ DQ459481和CH JX993913等株系聚在一起,表明这10个辣椒CMV分离物与CMV IB株系的亲缘关系更近;源自惠水、关岭和安龙的6个辣椒CMV分离物CMV-HS1、CMV-HS2、CMV-GL1、CMV-GL2、CMV-AL1和CMV-AL2与CMV Ⅱ聚为另一个大支,表明这些CMV分离物与CMV Ⅱ株系的亲缘关系较近。因此,在16个贵州辣椒CMV分离物中,有10个分离物属于CMV亚组IB株系,6个分离物属于CMV亚组Ⅱ株系。
3 讨论
CMV是危害贵州辣椒、烟草等作物的主要病毒之一,常与其他病毒复合侵染,在寄主上产生多种症状。CMV I主要引起坏死、蕨叶和矮化等症状,CMV Ⅱ引起斑驳和花叶等症状,但仅观察寄主症状并不能准确地将CMV株系归属进行区分。因此,本研究采集斑驳、花叶和黄化等症状的辣椒,采用RT-PCR进行CMV分离物亚组鉴定,结果表明,大方、榕江、绥阳、石阡和德江等地辣椒CMV分离物与CMV IB聚为一支,属于CMV亚组IB株系;惠水、关岭和安龙等地辣椒CMV分离物与CMV Ⅱ聚为另一支,属于CMV 亚组Ⅱ株系。席德慧等(2006)研究发现,侵染甜菜的分离物CMV-XJ1和CMV-XJ2属于亚组IB株系,二者存在株系分化趋势;侵染贵州烟草的CMV株系属于亚组IB株系(王莉爽等,2015a);湖南永州辣椒的CMV分离物属于亚组IB株系(陈玉珍等,2016);侵染山东葫芦科蔬菜南瓜、丝瓜等的CMV分离物属于亚组IB株系(孙晓辉等,2016);新疆辣椒LJ-10 CMV分离物属于亚组IB株系(周东等,2017);侵染番茄的9个山西CMV分离物与XJ2(四川)、Danshen(河北)等聚为一簇,属于CMV亚组IB株系(张璇等,2018)。综上所述,烟草、番茄、辣椒、南瓜和丝瓜等作物上CMV亚组IB株系的发生流行较普遍,与贵州大部分地区辣椒CMV株系归属一致。
本研究发现贵州辣椒CMV分离物还存在亚组Ⅱ株系,与其他地区报道侵染辣椒的株系不同,但与侵染西葫芦的Poland分离株中CMVⅡ较流行(Hasiów-Jaroszews et al.,2017)相符。贵州辣椒CMV分离物归属CMV亚组IB株系和CMV亚组Ⅱ株系,可能是由于CMV的发生、进化和变异与不同寄主、地理位置、生长环境等因素有关。相关研究表明,不同生境和寄主可能导致CMV保守氨基酸残基变化而引起结构和功能改变,不同CMV亚组分离物氨基酸序列可能与其致病性强弱有关(覃瑞和程旺元,2004)。本研究仅对16个贵州辣椒CMV分离物的CP基因进行比较分析,发现CMV分离物的CP基因核苷酸序列及其编码蛋白氨基酸序列存在一定的差异,其中,氨基酸序列存在23个非保守的氨基酸,是区分CMV亚组I和亚组Ⅱ的关键,但更多来源CMV分离物氨基酸差异所致的症状变化有待进一步探究。
4 结论
目前侵染贵州不同辣椒主产区的CMV株系有两大组群,分别为CMV亚组IB株系和CMV亚组Ⅱ株系,表明在不同地域的辣椒CMV株系发生了变异。
参考文献:
陈灵芝,张茹,魏兵强,王兰兰. 2017. 辣椒病毒病病原种类检测初报[J].甘肃农业科技,(11):17-19.[Chen L Z,Zhang R,Wei B Q,Wang L L. 2017. A preliminary report on detection of pathogenic species of virus disease in pepper[J]. Gansu Agricultural Science and Technology,(11):17-19.]
陈玉珍,谭新球,朱春晖,孙书娥,刘勇,张德咏. 2016. 我国部分地区常见农作物上黄瓜花叶病毒分离物核酸多样性分析[J]. 植物保护学报,43(3):427-433. [Chen Y Z,Tan X Q, Zhu C H,Sun S E, Liu Y,Zhang D Y. 2016. Sequence diversity analysis of Cucumber mosaic virus isolates from common crops in China[J]. Journal of Plant Protection,43(3):427-433.]
丁超. 2017. 辣椒烟草花叶病毒的分子鉴定及检测技术研究[D]. 贵阳:贵州师范大学. [Ding C. 2017. Molecular identification and the detection methods of Tobacco mosaic virus isolated from pepper[D]. Guiyang:Guizhou Normal University.]
冯耿,辛敏,曹孟籍,王莉爽,李莉,王锡锋. 2017. 深度测序发现贵阳发生的辣椒病毒病由多种病毒复合侵染所致[J].植物病理学报,47(5):591-597. [Feng G,Xin M,Cao M J,Wang L S,Li L,Wang X F. 2017. Identification of m ultiple viruses infecting hot pepper in Guiyang by deep sequencing[J]. Acta Phytopathologica Sinica,47(5):591-597.]
黎微,孔宝华,陈海如,白伟. 2008. 云南主要地区辣椒分离的黄瓜花叶病毒的亚组鉴定[J]. 云南农业大学学报,23(2):167-172. [Li W,Kong B H,Chen H R,Bai W. 2008. The identification of Cucumber mosaic virus subgroups of capsicum in the main producing areas of Yunnan[J]. Journal of Yunnan Agricultural University,23(2):167-172.]
刘湘宁. 2016. 湖南辣椒病毒病毒原鉴定与进化分析[D]. 长沙:湖南农业大学. [Liu X N. 2016. Identification and evolution analysis of pepper virosis in Hunan[D]. Changsha:Hunan Agricultural University.]
裴凡. 2016. 侵染广东辣椒的病毒种类鉴定及病毒病药剂防控效果评价[D]. 广州:华南农业大学. [Pei F. 2016. Identification of viruses infecting pepper in Guangdong and evaluation of control effect of plant virus pesticides[D]. Guangzhou:South China Agricultural University.]
覃瑞,程旺元. 2004. 黃瓜花叶病毒研究进展[J]. 中南民族大学学报(自然科学版),23(2):33-38. [Qin R,Cheng W Y. 2004. Research progresses on Cucumber mosaic virus[J]. Journal of South-Central University for Nationalities (Natural Sciences),23(2):33-38.]
孙晓辉,王树森,高利利,乔宁,刘永光,赵静,竺晓平. 2016. 山东葫芦科蔬菜上病毒病种类检测及黄瓜花叶病毒分离物的亚组鉴定[J]. 华北农学报,31(2):211-217. [Sun X H,Wang S S,Gao L L,Qiao N,Liu Y G,Zhao J,Zhu X P. 2016. Detection of viruses infecting cucurbit vegetables in Shandong and identification of subgroup of the Cucumber mosaic virus isolates[J]. Acta Agriculturae Boreali-Sinica, 31(2):211-217.]
汤亚飞,何自福,佘小漫,蓝国兵. 2016. 辣椒黄脉病毒RT-LAMP快速检测方法的建立[J]. 植物保护,42(6):100-104. [Tang Y F,He Z F,She X M,Lan G B. 2016. Deve-lopment of RT-LAMP for rapid detection of Pepper vein yellows virus[J]. Plant Protection, 42(6):100-104.]
王芳,周本国,许大凤,高正良. 2015. 利用siRNA高通量测序技术检测烟草病毒[J]. 植物病理学报,45(1):97-100.[Wang F,Zhou B G, Xu D F,Gao Z L. 2015. Detection for RNA viruses in tobacco by High-throughput sequen-cing of siRNA[J]. Acta Phytopathologica Sinica,45(1):97-100.]
王莉爽,陈文,谭清群,吴石平,袁洁. 2015a. 侵染烟草的黄瓜花叶病毒株系分化研究[J]. 现代农业科技,(17):141-142. [Wang L S,Chen W,Tan Q Q,Wu S P,Yuan J. 2015a. Search on the strains of Cucumber mosaic virus infected with tobacco[J]. Modern Agricultural Science and Technology,(17):141-142.]
王莉爽,陈小均,陈文,谭清群,杨学辉. 2015b. 贵州蔬菜病毒病主要病毒种类检测[J]. 广东农业科学,42(20):63-67.[Wang L S,Chen X J,Chen W,Tan Q Q,Yang X H. 2015b. Detection of main viral species of vegetable virus deseases in Guizhou[J]. Guangdong Agricultural Science,42(20):63-67.]
王少立. 2018. 山东省辣椒病毒病病原的检测鉴定及BWYV和CABYV的序列分析[D]. 泰安:山东农业大学. [Wang S L. 2018. Detection and identification of the pathogen of pepper virus disease in Shandong Province and sequences analysis of BWYV and CABYV[D]. Taian:Shandong Agricultural University.]
吴畏, 孙淼, 孙现超, 周常勇,青玲. 2014. 重庆地区马铃薯上黄瓜花叶病毒的检测及亚组鉴定[J]. 西南大学学报(自然科学版),36(7):29-32. [Wu W,Sun M,Sun X C,Zhou C Y,Qing L. 2014. Detection and subgrouping of Cucumber mosaic virus(CMV) infecting potato plants in Chongqing[J]. Journal of Southwest University(Natural Science Edition),36(7):29-32.]
席德慧,林宏辉,向本春. 2006. 黄瓜花叶病毒2个分离物的亚组鉴定及株系分化研究[J]. 植物病理学报,36(3):232-237. [Xi D H,Lin H H,Xiang B C. 2006. Subgrouping identification and strain differentiation of two Cucumber mosaic virus isolates[J]. Acta Phytopathologica Sinica,36(3):232-237.]
张璇,赵慧琪,王德富,郭尚,刘勇,牛颜冰. 2018. 黄瓜花叶病毒(CMV)2个山西分离物CP序列测定及亚组分类分析[J]. 植物病理学报,48(1):35-45. [Zhang X,Zhao H Q,Wang D F,Guo S,Liu Y,Niu Y B. 2018. Sequence and subgroup analysis of two new isolates of Cucumber mosaic virus(CMV) in Shanxi[J]. Acta Phytopathologica Sinica, 48(1):35-45.]
周东,刘贞,刘丽,许鹏程,郑银英. 2017. 新疆辣椒CMV基因组序列分析与CP基因多克隆抗体制备[J]. 生物技术通报,33(8):88-94. [Zhou D,Liu Z,Liu L,Xu P C,Zheng Y Y. 2017. Genome sequencing of CMV isolated from pepper in Xinjiang and polyclonal antibody preparation of CP gene[J]. Biotechno logy Bulletin,33(8): 88-94.]
周彤,杜琳琳,范永堅,周益军. 2012. 水稻黑条矮缩病毒RT-LAMP快速检测方法的建立[J]. 中国农业科学, 45(7):1285-1292.[Zhou T,Du L L,Fan Y J,Zhou Y J. 2012. Development of a RT-LAMP assay for rapid detection of Rice black-streaked dwarf virus[J]. Scientia Agricultura Sinica,45(7):1285-1292.]
Hasiów-Jaroszews B,Chrzanowski M,Budzyńska D,Rymelska N R,Borodynko-Filas N. 2017. Genetic diversity, distant phylogenetic relationships and the occurrence of recombination events among Cucumber mosaic virus isolates from zucchini in Poland[J]. Archives of Virology,162:1751-1756.]
(责任编辑 麻小燕)

