TLR10基因多态性与慢性乙型肝炎病毒感染的相关性研究
汤永志 王晨 陈华忠 朱敏 王奎锋 朱坚胜
慢性乙型肝炎病毒(hepatitis B virus,HBV)感染是我国慢性肝脏疾病患者发生肝硬化、肝癌的主要病因之一[1]。目前认为HBV诱导机体免疫应答是肝脏损伤和炎症的主要机制。Toll样受体2(toll like receptor 2,TLR2)与慢性HBV感染的关系密切,TLR2介导的信号通路能抑制HBV复制,也可成为HBV发生免疫逃避的作用靶点[2]。TLR10是一类无特异性配体的寡受体。相关研究表明,TLR10作为抑制性受体与TLR2形成异源二聚体,对TLR2下游白细胞介素1(IL-1)分泌进行调节[3]。TLR10基因多态性是否参与慢性HBV感染过程中的免疫应答,目前尚无相关文献报道。本研究对TLR10启动子区RS10004195(-113T/A)以及外显子区RS11096957、RS4129009与HBV感染的关系作一探讨,现将结果报道如下。
1 对象和方法
1.1 对象 选取本院2012年9月至2015年12月收治的428例HBV感染患者为感染组,根据2010年《慢性乙型肝炎防治指南》的诊断标准进行常规乙型肝炎标志物检测,并除外其他类型病毒感染、自身免疫性疾病、药物、饮酒等引起的肝功能异常。选取同期在本院进行体检的210例健康者为对照组。感染组男280例,女148例;年龄(41.8±11.8)岁;肝脏炎症程度(依据 2000年中华医学会传染病与寄生虫病学会和肝病学会修订的《病毒性肝炎防治方案》):轻度172例,中度138例,重度24例,肝硬化94例;HBV DNA<103IU/ml 60例,103~106IU/ml 134 例,>106IU/ml 234 例;HBeAg(+)278例,HBeAg(-)150 例;有家族史 224 例,无家族史204例。对照组男134例,女76例;年龄(42.0±10.1)岁。两组对象均为汉族人群,性别、年龄比较差异均无统计学意义(均P>0.05)。本研究经医院医学伦理委员会审查通过,所有对象知情同意。
1.2 主要试剂和设备 全血基因组DNA提取试剂盒(1408G26,上海捷瑞生物工程有限公司),聚合酶链反应(PCR)引物:RS10004195(F:141008Q43/R:141008Q44);RS11096957(F:141008Q45/R:141008Q46)上海捷瑞生物工程有限公司)。核酸定量分析仪(1702525,美国Biorad公司),小型高速离心机(5418,德国 Eppendorf公司),DNA测序仪(3730XL,美国 ABI公司)。
1.3 PCR及测序 采集患者晨间空腹外周血2~3ml,乙二胺四乙酸二钠(EDTA-Na)抗凝后-80℃保存,以备DNA提取。(1)DNA抽提:按照全血基因组DNA抽提试剂盒说明书的步骤进行,核酸定量分析仪检测DNA浓度及A260/A280比值,比值为1.7~2.0的样本作为PCR扩增模板。(2)PCR 扩增:RS10004195 上游引物 5′-CCTGGGTGACAAAGTGAGACCCTACCT-3′;下游引物5′-CTTAAACCCCATCCGCCCTCTT-3′;RS11096957 上游引物 5′-CTTAAACCCCATCCGCCCTCTT-3′;下游引物 5′-GTAGCCTGCCCATCTTAAACAC-3′。扩增体系:10×缓冲液2.5μl,DNA模板0.5μl,MgCl21.0μl(25mmol/L),dNTP 0.5μl,TaqDNA 聚合酶 0.25μl,引物各 0.5μl,总体积为25μl,剩余体积用双蒸水补足。PCR条件:RS10004195位点(95℃预变性 2min,94℃变性 45s,58℃退火90s,72℃延伸2min,共循环 35次);RS11096957位点(95℃预变性 2min,94℃变性 45s,56℃退火 90s,72℃延伸2min,共循环35次),扩增产物加入溴化乙锭染色的1.5%琼脂糖凝胶中电泳,凝胶成像分析PCR产物特异性。(3)直接测序:将PCR扩增产物送上海桑尼生物科技有限公司,利用直接测序法进行基因序列分析。
1.4 统计学处理 应用SPSS 17.0统计软件。对两组人群RS10004195、RS11096957位点进行Hardy-Weinberg平衡检验,以验证其群体代表性。计量资料用表示,组间比较采用两独立样本t检验。两组对象基因型及基因频率[等位基因频率=(2×纯合子数+杂合子数)(/2×受检人群)]用率表示,组间比较采用χ2检验,同时计算OR值及其95%CI。各位点基因型两组间的关系比较采用logistic回归分析,倍增P值经Bonferroni校正(n=3)。P<0.05为差异有统计学意义。
2 结果
2.1 两组对象RS10004195与RS11096957基因型及等位基因分布特征比较 两组对象RS10004195、RS11096957位点均符合 Hardy-Weinberg平衡(χ2=2.11、0.34和0.03、0.93,均P>0.05),提示本研究人群具备群体代表性。在RS10004195位点,感染组基因型(AA+AT)变异频率为76.64%,明显高于对照组的63.81%,差异有统计学意义(P<0.05);等位基因A频率为53.50%,高于对照组的39.05%,差异有统计学意义(P<0.05)。在RS11096957位点,感染组基因型(CA+AA)的变异频率为75.70%,与对照组的69.52%比较差异无统计学意义(P>0.05);感染组等位基因A频率为50.93%,高于对照组的43.33%,差异有统计学意义(P<0.05),见表1~2。
2.2 HBV感染患者临床特征与RS10004195基因变异的关系 在HBV感染患者中,HBeAg阳性患者RS10004195位点基因型(AA+AT)变异频率较HBeAg阴性患者增高,差异有统计学意义(P<0.05);而在肝脏炎症程度、HBV DNA水平、家族史等方面,差异均无统计学意义(均P>0.05),见表3。
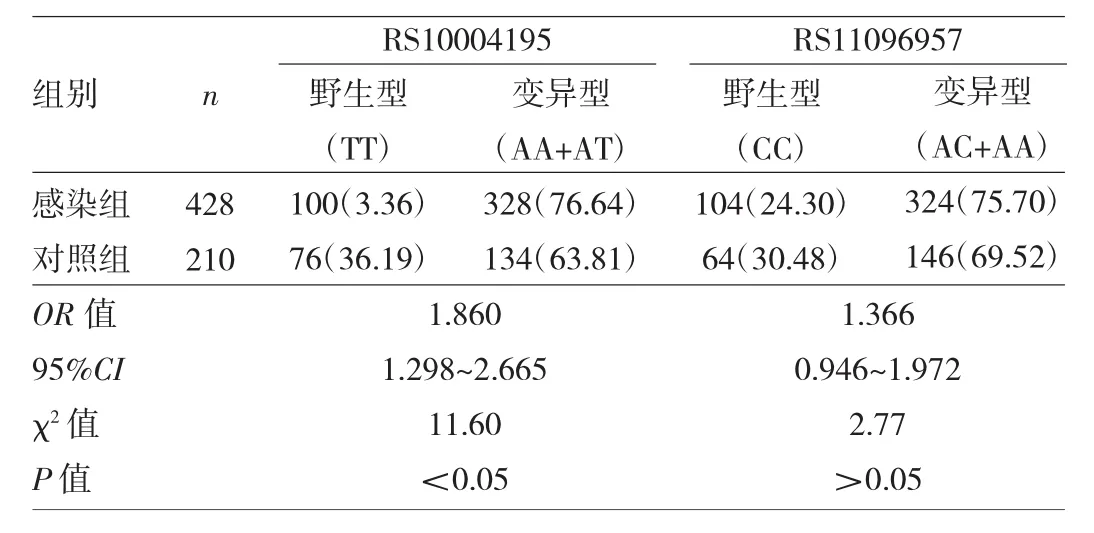
表1 两组对象RS10004195与RS11096957基因型分布特征比较[例(%)]
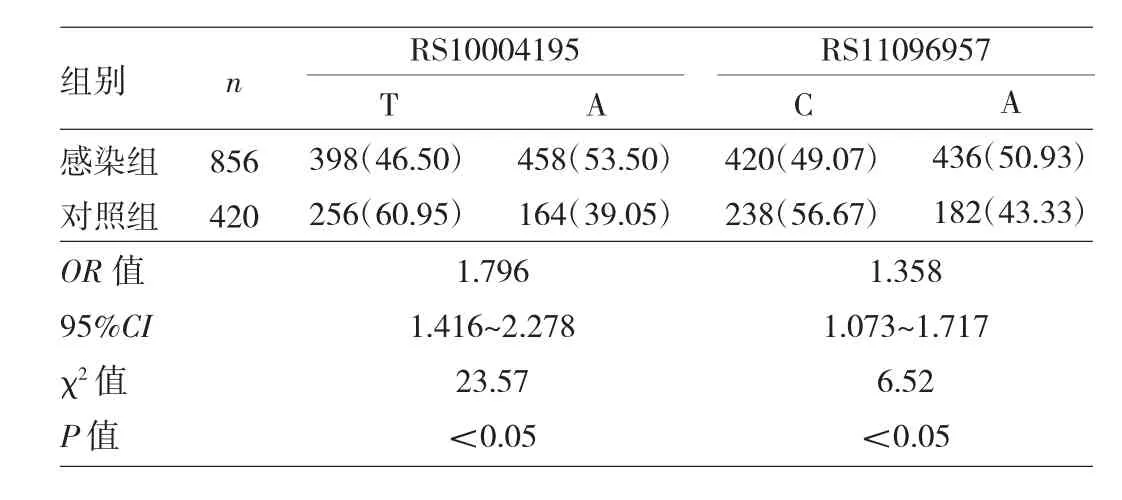
表2 两组对象RS10004195与RS11096957等位基因分布特征比较[例(%)]
2.3 两组对象TLR10基因多态性的logistic回归分析 校正年龄、性别等混杂因素后进行logistic回归分析,结果显示RS10004195在共显性模型、显性模型和隐性模型中的OR值及95%CI分别为2.862(1.572~5.211)、1.712(1.142~2.566)、2.487(1.541~4.014),差异均有统计学意义(均P<0.05);提示T向A突变时,HBV感染风险增高。RS11096957在共显性模型、显性模型和隐性模型中的OR值及 95%CI分别为1.028(0.651~1.623)、0.905(0.595~1.378)、1.254(0.787~2.000),差异均无统计学意义(均P>0.05);提示其与HBV感染无关。RS4129009在共显性模型、显性模型和隐性模型中的OR值分别为0.639(0.424~0.963)、0.540(0.375~0.780)、1.016(0.559~1.847),其中显性模型差异有统计学意义(P<0.05),共显性模型、隐性模型差异均无统计学意义(均P>0.05);提示存在A向G突变,HBV感染的风险降低。
3 讨论
TLR10基因单核苷酸多态性与人类多种疾病(如前列腺炎[4]、幽门螺杆菌相关性胃炎[5-6]、肥胖[7]和2型糖尿病[8]、结肠癌[9]、结核[10]、骨关节炎[11]、膀胱癌[12]、刚果出血热[13]、支气管哮喘[14]、鼻咽癌[15]、呼吸道合胞病毒感染[16]、IgA肾病[17]等)存在关联。尽管尚未发现特异性配体,且TLR10参与人体疾病的确切机制也尚未明确,但近年来有关TLR10参与机体免疫应答调节的研究结果提示其在人体免疫调节中起重要作用。TLR10在人体B细胞和浆样树突状细胞中表达,通过MyD88信号通路介导下游炎性因子分泌[18],人调节T细胞可表达TLR10,且受FOXP3、NF-AT复合体的调控[19]。在人单核细胞系THP-1中,TLR10也有表达,缺氧或活性氧均能增强TLR10表达[20]。现有研究认为TLR10是一种功能性受体,人TLR10转基因小鼠经TLR2配体pam3CSK4(Pam3Cys)刺激后,血清中IL-6、IL-8水平较野生基因型小鼠明显降低,TLR10交联后的外周血单个核细胞IL-1受体拮抗剂(IL-1Ra)mRNA和蛋白高水平表达;在HEK293细胞实验中,阻断TLR10后,配体刺激下的TLR2细胞通路下游炎性因子分泌增多,提示TLR10是TLR家族中唯一通过产生IL-1Ra参与TLR2信号通路应答的抑制性受体,并发挥抗炎的特性[3]。在TLR10干预下,U397细胞中 TLR2/1配体(PAM3CSK4)、TLR2/6配体(MALP-2)、TLR3配体(pI:C)和 TLR4配体(LPS)介导的下游炎性因子IL-6、干扰素β表达均明显下降,提示TLR10广泛抑制了上述TLR介导的免疫应答,进一步研究显示 TLR10通过抑制信号通路中 IκB、MAPK、MyD88和TRIF蛋白的表达,影响下游炎性因子分泌[21]。综上所述,TLR10作为一种功能性受体在多种免疫细胞中表达,通过与其他TLR协同,在机体免疫应答中发挥负性调节作用。
HBsAg通过阻断JNK-MAPK通路选择性抑制巨噬细胞TLR2下游IL-12分泌而逃避免疫攻击[22]。在HBV感染过程中,HBeAg阳性患者的肝细胞、库否细胞和单个核细胞TLR2表达低于HBeAg阴性患者,慢加急性肝衰竭患者T细胞TLR2表达明显增加,通过促进Th17细胞分化和外周血单个核细胞应答参与疾病进展[23-24]。在体外小鼠模型中,预激活的TLR2增强T细胞的应答,加速了HBV清除,间接印证了TLR2在HBV感染中发挥病毒抑制或清除的作用[25]。以上结果提示TLR2与HBV感染关系密切,在HBV感染的免疫应答中发挥重要作用。

表3 HBV感染患者临床特征与RS10004195基因变异的关系[例(%)]
TLR10作为一种抑制性功能受体,参与TLR2信号通路介导的免疫调节。笔者前期报道了RS4129009位点HBV DNA>106IU/ml或HBeAg阳性的患者中基因型变异频率较高(P<0.05)[26]。本文初步探讨了慢性HBV感染与TLR10基因多态性的关系,结果提示启动子区RS10004195出现变异基因A时与HBV易感性强相关,校正性别、年龄等混杂因素后logistic回归分析显示,纯合突变个体HBV易感风险增高,且在HBeAg阳性患者突变的比例较高,提示慢性HBV感染与TLR10单核苷酸多态性位点有一定关联。TLR10参与了TLR2信号通路应答,并发挥抑制性效应,在固有免疫应答中发挥重要作用。综上,TLR10基因多态性与HBV感染存在关联,但TLR10是否作为抑制性受体参与HBV感染过程中机体免疫细胞介导的免疫应答、帮助HBV逃避TLR2通路介导的免疫应答尚需进一步研究证实。

