紫娟茶自然杂交后代的ISSR分析
邹 瑞,张 玥,杨自云,蓝增全,吴 田*
(1.西南林业大学国家林业和草原局西南风景园林工程技术研究中心/园林园艺学院,昆明 650224;2.西南林业大学西南绿色发展研究院,昆明 650224)
紫娟茶(Camellia sinensis var.Kitamura)属于普洱茶变种,是云南大叶种茶中较为独特的品种[1],因其紫茎、紫叶和紫芽的特点,其中半木质化茎呈紫红色,木质化的茎呈褐绿色;叶形长椭圆形,色绿,微紫;芽叶紫色,茸毛多。紫娟具有抗寒、抗旱和抗病虫能力强的特点[2]。2005 年紫娟茶获国家林业局植物新品种保护权,品种权号为20050031[3]。
虽然紫娟茶已有一定的种植规模[4],但是在种质资源保存及扩繁方面比较单一地使用扦插法,大部分的种子得不到有效利用。在以茶树茎段[5-6]、茎尖[7-8]等为外植体的组织培养过程中,由于茎段等含有大量的酚类物质,而伤口会激活其中的多酚氧化酶,将多酚类物质氧化为褐色的醌类物质,进而扩散到整个培养基,造成细胞褐变死亡[9],并且由于茶树内生菌含量较为丰富[10-11]原因,污染率通常也很高,导致培养失败。在本课题组前期的茶树组织培养实验中,茶树种子作为外植体可大幅度降低褐化率及污染率。
ISSR 技术广泛应用于茶树的种质资源鉴定和遗传多样性分析,例如:吴田等研究云南峨毛茶的遗传相似系数介于0.45~0.64 之间,表明了同一地区的云南峨毛茶会产生遗传分化[12]、滇中茶的遗传相似系数变化范围为0.58~0.80[13]、云南昭通小叶种茶的遗传相似系数在0.55~0.76 之间[14]等;在茶树的遗传多样性分析的研究中,吴清韩等[15]表明了凤凰单丛茶树的遗传相似系数在0.59~0.97 之间、朱晨等[16]表明了福建省的53 份茶树资源的遗传相似系数在0.66~0.99 之间。茶树属于异花授粉植物,实生后代会发生一定程度的变异,王玉等[17]对黄山种茶树实生子后代进行抗寒评价,选育出几个抗寒性较强的材料。但是在紫娟茶上尚未见报道,对紫娟茶分子方面的研究大多集中于花青素的方面[18-19]。本试验拟采用紫娟茶种子自然杂交后的种子作为外植体进行消毒,萌发无菌试管苗,用ISSR 分子标记及花青素含量测量对随机挑选的实生苗与紫娟母株进行遗传及特有特征的差异分析,为后续利用组织培养技术对紫娟茶种质资源的保存、利用提供技术支持和理论依据。
1 材料和方法
1.1 试验材料
紫娟种子于2017 年12 月采自西南林业大学树木园(从云南省农业科学院茶叶研究所引种),随机选择果壳呈绿色、微现裂缝和无病虫害的茶果50颗,带回实验室,3 d 后待果壳脆硬、呈棕褐色时开裂释放种子,每个茶果选择饱满的茶籽1 颗用于无菌萌发。从无菌萌发的试管苗中随机选择15 份作为后续 ISSR 检测的材料,编号为 SS1~SS15(SS 为“实生”汉语拼音首字母缩写)。ZJ(为“紫娟”汉语拼音首字母缩写)是紫娟茶原种,从云南省农业科学院茶叶研究所引种。
1.2 紫娟茶种子无菌萌发
剥除紫娟茶种子的外种皮及内种皮,于4% 的次氯酸钠(NaClO)溶液消毒5 min,无菌水洗涤4次,75%的酒精消毒45 s,无菌水洗涤4 次,滤干水分,置于无糖 MS 培养基(pH 值为 5.7~5.75)上萌发,萌发条件:(25±2)℃,光照时间为 12 h/d。30 d 时统计污染率和萌发率,污染率=污染种子数/接种种子总数*100%。
1.3 紫娟茶花青素含量测量
将无菌试管苗的顶芽剪下用于扩繁,植株的其余部分移栽至田间。3 个月后,用液氮研磨茶树的顶芽,用酸性乙醇提取,定容到50 mL,2 000~2 500 rpm/min离心5 min。吸取4 mL 上清液于刻度试管中,加入6 mL 酸性乙醇,显色30 min。以酸性乙醇为空白对照,测OD525。根据吸光值来计算花青素的含量,计算公式:花青素含量(mg/g)=[(A 液-A 照液)*101.83]/[吸取供液量(mL)* 样品质量(g)][20]。
1.4 基因组DNA提取
用TIANGEN DNA secure Plant Kit 试剂盒提取16 份紫娟茶的DNA,用1.0%琼脂糖凝胶电泳检测样本DNA 并成像观察其电泳条带,用超微量分光光度计检测DNA 浓度,同时,测量OD260/OD230、OD260/OD280。
1.5 ISSR引物的筛选及PCR扩增
从100 个通用的ISSR 引物中随机选出 28 个引物(见表1)进行PCR 扩增,参照张玥等[21]的方法。
1.6 数据统计分析
对电泳图中的条带情况进行观察、统计,相同迁移位置下,无带的标记为0,相应位置有带的标记为1。根据读带情况计算紫娟茶种质的多态性:多态性=(总带数-共有带数)/总带数×100%。
1.7 遗传相似系数
根据0、1 读带结果计算其总扩增带数和总特异带数,并将0、1 矩阵图输入计算机。试验数据采用Popgene l.23 计算样品的观测等位基因数(Na),有效等位基因数(Ne),基因多样性指数(H)和Shannon 信息指数(I);采用 NTsys 2.1 软件分析,相似性系数(GS)采用Dice 系数及对16 份紫娟茶进行聚类分析,构建聚类分析树状图[22]。
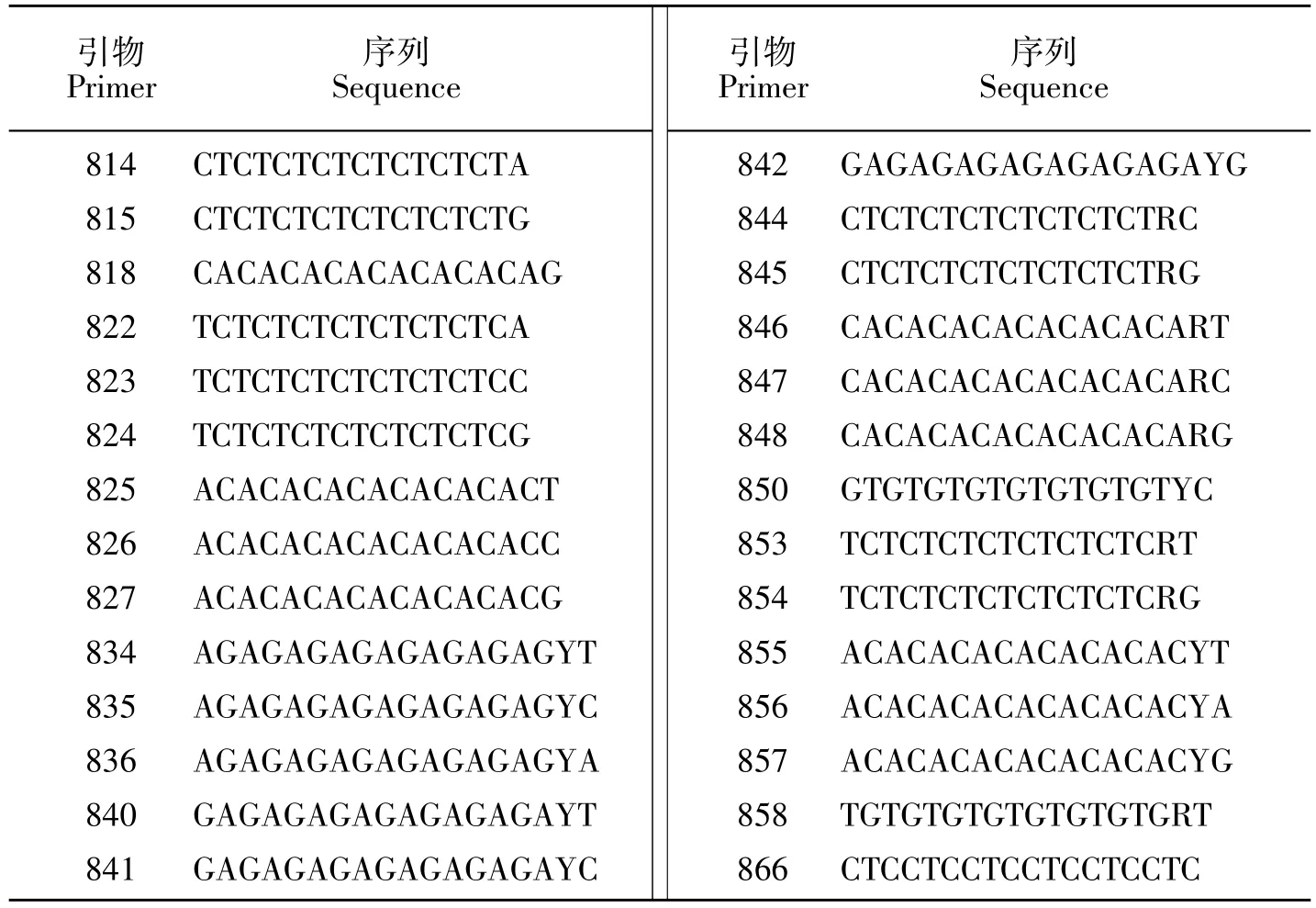
表1 引物序列Table 1 Primer sequence
2 结果与分析
2.1 紫娟茶种子的无菌萌发
50 颗紫娟茶种子经消毒处理,置于MS 无糖培养基上萌发,30 d 时污染率为0,萌发率为82%,即得到紫娟无菌试管苗41 棵。从中随机选择15 棵作为后续ISSR 的材料。

图1 SS1-SS15 号紫娟茶无菌试管苗Figure 1 The sterile seedlings of SS1-SS15 of Zijuan tea
2.2 紫娟茶花青素含量测量
移栽后紫娟茶的实生苗幼嫩部分颜色差异明显(见图2)。通过对紫娟茶自然杂交后代的花青素测量发现,距离原种较近的株系,颜色较接近紫红色,花青素含量也较高于其他株系,反之距离较远原种的株系,颜色越接近绿色,花青素含量较低(见图3)。

图2 紫娟茶实生苗移栽后顶芽的颜色变化Figure 2 Color changes of terminal buds of seedlings of Zijuan tea after transplantation
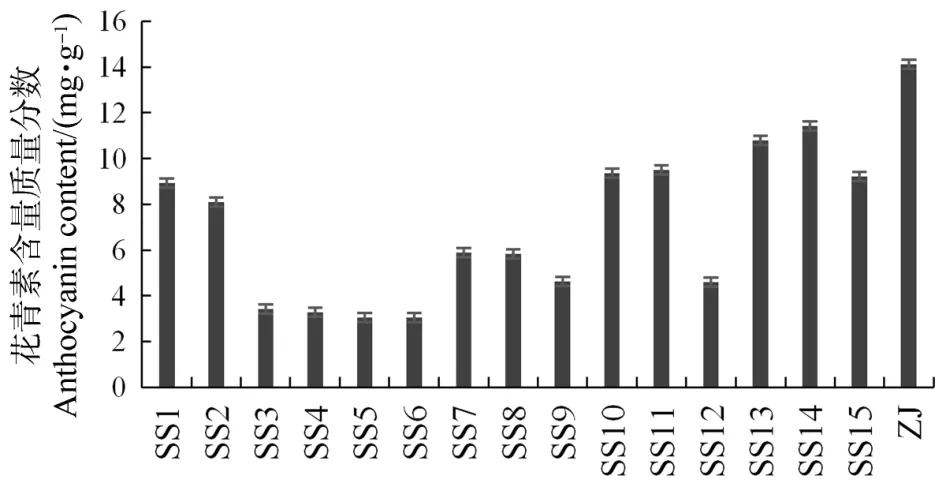
图3 紫娟茶花青素含量质量分数对比图Figure 3 Contrast chart of anthocyanin content in Zijuan tea
2.3 ISSR引物的筛选
对随机选择的28 条ISSR 引物进行筛选,观察电泳条带的形态和带数,可筛选出11 条能扩增出清晰条带的引物、且这些条带具有重复性好和多态性高的优点,分别为 826、827、835、836、840、841、842、844、848、855 和 856。
2.4 紫娟茶的ISSR多态性分析
将筛选出的11 个引物,分别对16 份DNA 进行ISSR-PCR 扩增,发现条带大部分集中在250 bp 以上。引物840 扩增出9 条DNA,其中多态性条带7条,多态率为77.8%;引物841 共扩增出9 条DNA,其中多态性条带为6 条,多态率为 66.7%(见图4);引物856 共扩增出10 条DNA,其中多态性条带为8 条,多态率为80%。筛选出的11 个ISSR 引物共扩增出92 条DNA,其中多态性条带72 条,最高的是引物855,最低的是引物835,平均多态性为78.3%(见表2)。
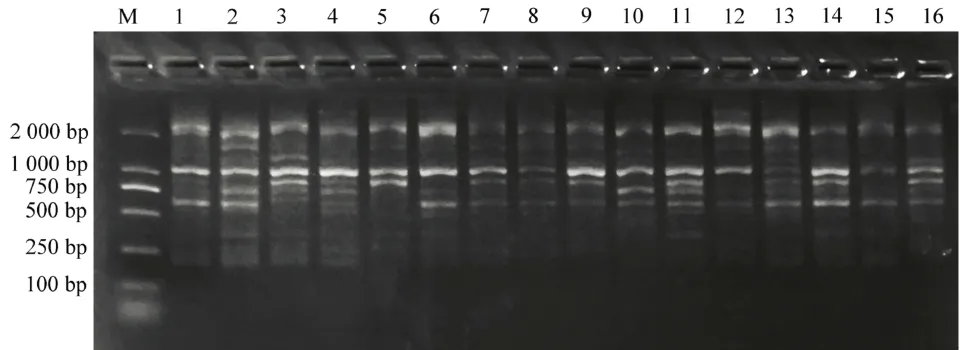
图4 引物840 对紫娟茶DNA 进行扩增情况Figure 4 Primer 840 amplifies the DNA of Zijuan tea
2.5 紫娟茶聚类分析
16 份紫娟茶的 GS 值变化范围为 0.53~0.79,平均为 0.66,其中,SS14 和紫娟原种之间的 GS 值(0.79)最大、遗传相似程度最高;而SS12 与紫娟原种之间的GS 值(0.63)最小、遗传相似程度最低。通过聚类分析表明,在0.66 水平上16 份紫娟茶可分为3 组(见图5),遗传距离较远的一组包括 SS3、SS4、SS5 和 SS6,SS9 和SS12 遗传距离较为居中,可以聚为一组,其他包括紫娟原种在内的归为一组。遗传相似水平最高是SS14 与紫娟原种,遗传相似水平在0.79 处划分。

表2 紫娟茶的ISSR 多态性分析Table 2 ISSR polymorphism analysis of Zijuan tea
3 讨论与结论
本研究运用ISSR 分子标记方法,对紫娟茶16 份种质资源进行分析,共筛选出11 个具有多态性的引物,扩增出DNA 条带92 条,多态性条带72 条,多态百分比为78.3%,遗传相似系数分布在0.53~0.79,平均为0.66,观测等位基因数(Na)为1.76,有效等位基因数(Ne)为1.55,基因多样性指数(H)为0.31,Shannon 信息指数(I)为0.45。通过聚类分析表明,在0.66 水平上16 份紫娟茶样分为3 组,遗传距离较远的群体包括 SS3、SS4、SS5 和 SS6,SS9 和 SS12遗传距离较为居中,可聚为一组,其他包括紫娟原种在内的归为一组。遗传相似水平最高是SS14 与紫娟原种,遗传相似水平在0.79 处划分。对比相似系数的聚类分析,距离紫娟原种较近的株系花青素含量相对较高。范凯通过ISSR 方法对“黄山种”自然杂交后代的基因多样性(H)为0.27,得出了“黄山种”自然杂交后代具有丰富的遗传变异[23]。在本实验中研究发现紫娟茶的H 为0.31,高于“黄山种”,暗示了紫娟茶的自然杂交后代遗传变异较丰富。

图5 紫娟茶遗传关系聚类Figure 5 Genetic relationship cluster of Zijuan tea
茶树的种间杂交存在杂交不亲和,杂种易夭亡不能结实或结实率低,幼胚易停止发育或中途死亡,杂种不萌发及幼苗中途夭亡等现象[24]。通过组培手段是解决这些问题的主要方法。在本试验中通过外植体消毒,萌发无菌苗的试验中50 颗种子成活了41 棵无菌苗,成活率为82%,为幼胚组培提供了有效的途径。
紫娟茶有自己独特的品质特征,特别是其高花青素含量,在降低三高方面疗效显著[25],更有报道表明在治疗癌症方面有作用[26]。本研究对紫娟茶原种及后代的花青素进行测量,发现紫娟茶自然杂交后代花青素含量与原种存在一定差异,可能是因为紫娟茶自然杂交后代移栽时间较短,只有3 个月,处于幼苗期,而田间的紫娟茶原种种植时间是2 年龄[27]。按照邵宛芳等[28]对云南茶树资源保存的理论,可以构建紫娟茶的核心种质群,并种植在相对独立的空间,有利于保证紫娟茶的优良性状,利于种质资源的管理和保存。后续在利用紫娟茶其他实生苗时,建议先用ISSR 引物855 进行一次筛选,然后根据需要选择合适的株系。

