黄梁木遗传转化受体系统对筛选物敏感性研究
黄 浩,韦 莹,翟勇进,白隆华*,陈晓阳
(1.广西壮族自治区药用植物园,南宁 530023,2.华南农业大学林学与风景园林学院,广州 510462)
黄梁木(Neolamarckia cadamba)为茜草科团花属速生型乔木,10 年左右成材,衰退期晚,是华南地区特有的速生乡土树种。虽然黄梁木有工业用材、药用、园林景观和饲用等多种用途,但因不耐零度低温[1-2]和易遭虫害[2-4],使得其人工栽培区域仅局限于广东、广西和海南等气温较高的地区[1]。选育抗寒、抗虫性强的植株类型,以提高黄梁木产量,是发展黄梁木用材林亟待解决的问题。
由于转基因技术具目的性强、周期短的特点,可打破种间杂交不亲和的界限[5-6],因此,利用该技术对生长周期较长的林木进行遗传改良具有较强的优势。在农杆菌介导的遗传转化中,建立高效的再生体系和筛选体系是遗传转化的基础。不同物种、不同外植体对于筛选物和抑菌剂的敏感性有较大差别,在遗传转化之前,找出适宜的筛选物、抑菌剂的类型和浓度是遗传转化能否顺利进行的关键。因此,利用筛选物和抑菌剂对外植体进行敏感性试验非常必要。目前,有关利用农杆菌介导的黄梁木遗传转化研究仍无报道。因此,本研究在已建立的黄梁木再生体系基础上[7-8],选取在植物遗传转化中被广泛作为筛选物的卡那霉素和潮霉素,以及抑菌剂头孢霉素,在对筛选物较敏感的诱导不定芽分化和生根阶段,进行敏感性试验,为后续黄梁木遗传转化研究特别是为提高黄梁木耐寒、抗虫的转基因研究奠定基础。
1 材料和方法
1.1 试验材料、农杆菌株和试剂
饱满成熟的黄梁木种子,来源于广西药用植物园本草纲目园区内一株20 a 树龄的健康植株。
在超净台上将种子灭菌,转移到无激素的MS固体培养基上培养,25 d 后,切取无菌植株的子叶和胚轴作为不定芽分化诱导材料;生根诱导材料则将无菌植株茎的下部分切除,先转接到增殖培养基上培养20 d,再进行生根诱导试验。
卡那霉素(kanamycin,简写 Km)、潮霉素(hygromycin,简写 Hm)、头孢霉素(cefotaxime,简写Cef),以及所使用的 DCR 培养基、MS 培养基、蔗糖、琼脂和激素等均购于北京鼎国昌盛生物技术有限责任公司,含植物表达载体pBI121-GUS 的农杆菌LBA4404 为本实验室保存。
1.2 培养基
按前期再生体系优化得到的培养基。分化培养基DCR+TDZ2.0 mg/L+NAA0.05 mg/L;增殖培养基MS+6-BA1.0 mg/L+IBA0.05 mg/L;生根培养基:1/2MS+IBA0.1 mg/L+NAA0.05 mg/L。
所有培养基均添加蔗糖30.0 g/L,琼脂5.6g/L,pH 值均调至5.8~6.0,高温高压灭菌后,冷却到55 ℃左右,按不同试验目的加入相应的筛选物,摇匀、分装,凝固1 d 后待用。
1.3 筛选物对外植体分化和生根影响的浓度梯度设置方法
参考其他木本植物对筛选物敏感情况和预试验,同一种筛选物在不定芽分化和生根诱导这两个试验阶段,设置的浓度梯度相同,即卡那霉素的浓度梯度为 0、4、6、8、10、15、20 和 50 mg/L;潮霉素的浓度梯度为 0、2、4、6、8、10 和 12 mg/L,而头孢霉素的梯度设置为 0、25、50、100、150、200、300 和 400 mg/L。每个浓度均设置3 次重复。
1.4 筛选物头孢霉素对农杆菌抑制效果的处理方法
为了便于校正和检验抑菌试验可能存在的误差,共设计农杆菌直接浸染外植体和OD600 光密度值测定法进行农杆菌抑制试验。前者直接观察菌斑的生长状况,统计农杆菌出现的时间(d),后者通过测量培养液的OD600 光密度值,作为判断菌株的生长情况。头孢霉素浓度梯度设置为0、25、50、100、150、200、300 和 400 mg/L。每个浓度均设置 3 次重复。
1.4.1 直接浸染外植体法
①在含有卡那霉素、利福平的YEB 液体培养基中,培养农杆菌LBA4404 至OD600 值为0.8;
②将在分化培养基培养30 d 的愈伤组织,切长、宽和高均约为0.3 mm 小块,用步骤1 培养好的YEB 菌液浸染5 min;将愈伤组织表面菌液吸干,转入含头孢霉素浓度梯度的分化培养基中培养。
1.4.2 OD600 测定法
①取已灭菌的8 个100 mL 锥形瓶中,每个锥形瓶装20 mL YEB 培养液;按上述头孢霉素浓度梯度将头孢霉素分别准确添加到8 个锥形瓶中;
②将OD600值为0.8 的农杆菌LBA4404 各吸取10 μL,分别加入 8 个锥形瓶中;置于 28 ℃,180 rpm的摇床上恒温培养;培养后24 和48 h,测定8 个锥形瓶中YEB 培养液的OD600值。
1.5 测定指标
外植体的分化率、平均长芽个数、白化率、生根率、死亡率和农杆菌斑生长情况。
分化率=诱导出不定芽的外植体个数/外植体总个数×100%;平均长芽个数=不定芽总个数/外植体总个数×100%;白化率=白化的外植体个数/外植体总个数×100%;生根率=诱导出根的外植体个数/外植体总个数×100%;死亡率=外植体死亡个数/外植体总个数×100%。
1.6 数据分析
数据分析和作图采用SPSS Ver19.0、Excel 2016进行。试验采用3 次重复,结果为3 次试验数据的平均值±标准差,并通过Duncan's multiple range test方法进行分析显著性差异(P<0.05)。
2 结果与分析
2.1 筛选物对不定芽分化的影响
2.1.1 筛选物卡那霉素对不定芽分化的影响
在试验的浓度范围内,筛选物卡那霉素(Km)对黄梁木不定芽分化有显著的抑制作用(表1)。Km浓度增大对分化率影响非常明显,当Km 浓度由0增大到4 mg/L 的时候,分化率由100%下降到95.00%,平均长芽个数由1.44 个下降为1.25 个;当Km 浓度为8 mg/L,分化率已下降为52.6%,平均芽个数仅为1.0 个,近一半外植体白化;当Km 浓度15 mg/L 时,分化率已下降为2.50%,平均芽个数仅为0.25 个,白化率高达97.5%。当Km 浓度为20 mg/L时,已完全抑制不定芽分化,愈伤组织的体积较小;当Km 浓度大于50 mg/L 时,愈伤组织形成已严重受抑制,外植体几乎不膨大(图1)。由此可见,在黄梁木遗传转化中,如采用卡那霉素作为筛选物,不定芽分化的筛选浓度可选择20 mg/L。
2.1.2 筛选物潮霉素对不定芽分化的影响
从表2可看出,潮霉素对不定芽分化的抑制作用较强,不定芽的分化率随着潮霉素浓度的增大而减少。当潮霉素浓度为2 mg/L 时,不定芽分化率即降低到75.00%,与对照组(CK)比较,分化率减少了1/4,同时,芽的伸长也略受抑制;当潮霉素浓度为4 mg/L 时,不定芽分化率约为对照组的1/4,仅为28.57%;当潮霉素浓度为8 mg/L时,不定芽分化率仅为14.29%,而死亡率达60%,有70%的外植体褐化,芽伸长、叶伸展均严重受抑制;当潮霉素为8 mg/L 时,愈伤呈淡绿色,体积很小,当浓度大于10 mg/L 后,基本无愈伤组织生成,外植体不分化出芽(图2),45 d 后,所有外植体均褐化死亡。

表1 卡那霉素对不定芽分化的影响Table 1 Effect of different concentrations Km on adventitious bud induction

图1 外植体在不同Km 浓度下诱导分化的情况(30 d)Figure 1 Induced differentiation of explants at different Km concentrations (30 d)

表2 不同浓度潮霉素对不定芽分化的影响Table 2 Effect of different concentrations Hm on adventitious bud induction

图2 外植体在不同Hm 浓度下诱导分化的情况(30 d)Figure 2 Induced differentiation of explants at different Hm concentrations (30 d)
2.1.3 筛选物头孢霉素对不定芽分化的影响
从表3 可看出,头孢霉素对黄梁木不定芽的分化影响不大。在试验浓度范围内,所有外植体均无白化或褐化,依然呈疏松膨大状态,当头孢霉素浓度不超过200 mg/L 时,分化率均为100%,平均长芽个数差异不大;当头孢霉素浓度为400 mg/L 时,不定芽分化率依然为高达91.12%,平均长芽个数为1.30 个,外植体生长情况仍较好。
2.2 筛选物对黄梁木无菌苗生根的影响
由图3 可见,随着卡那霉素(Km)和潮霉素(Hm)浓度的增大,生根率和根长均迅速降低。
当卡那霉素浓度从4.0 mg/L 增大到8.0 mg/L时,生根率从100%迅速降低为65.62%,根长也由2.6 cm 降低为1.2 cm;当卡那霉素浓度等于或大于10 mg/L 时,无菌苗无法诱导出不定根;另外,当卡那霉素浓度为50 mg/L 时,嫩叶和芽出现了白化,芽的生长也受到抑制。
当潮霉素浓度从0 到6 mg/L 间变化时,无菌苗的生根率较高,均不低于85.00%的生根率;随着浓度增大到8 mg/L,生根率迅速降低至35.00%;而根长则对潮霉素浓度的增大变得较敏感,当潮霉素浓度为2 mg/L 时,根长就降低为2.1 cm,比没有添加潮霉素的对照组减少了1.4 cm,当潮霉素浓度为8 mg/L 时,根长迅速降至0.3 cm;当浓度为10 mg/L以上时,无菌苗已无法诱导出不定根。另外,当潮霉素浓度大于6 mg/L 后,对芽、茎的伸长和叶片正常伸展均有较明显的抑制作用。
头孢霉素对无菌苗生根诱导的影响见图4。随着头孢霉素浓度的增大,生根率和根长缓慢下降。当头孢霉素浓度在0 至150 mg/L 的范围内,生根率均为100%,根长均为3.5 cm,并不受头孢霉素的影响;当浓度为200 mg/L 时,生根率为98.6%,根长为3.2 cm,仅比对照组的生根率和根长分别减少1.4%、0.3 cm;当浓度为400 mg/L 时,生根率和根长也只降低至95.52%和2.1 cm,无菌苗的茎、叶颜色仍呈绿色,无白化或褐化现象出现。表明头孢霉素对无菌苗诱导生根的影响较小。
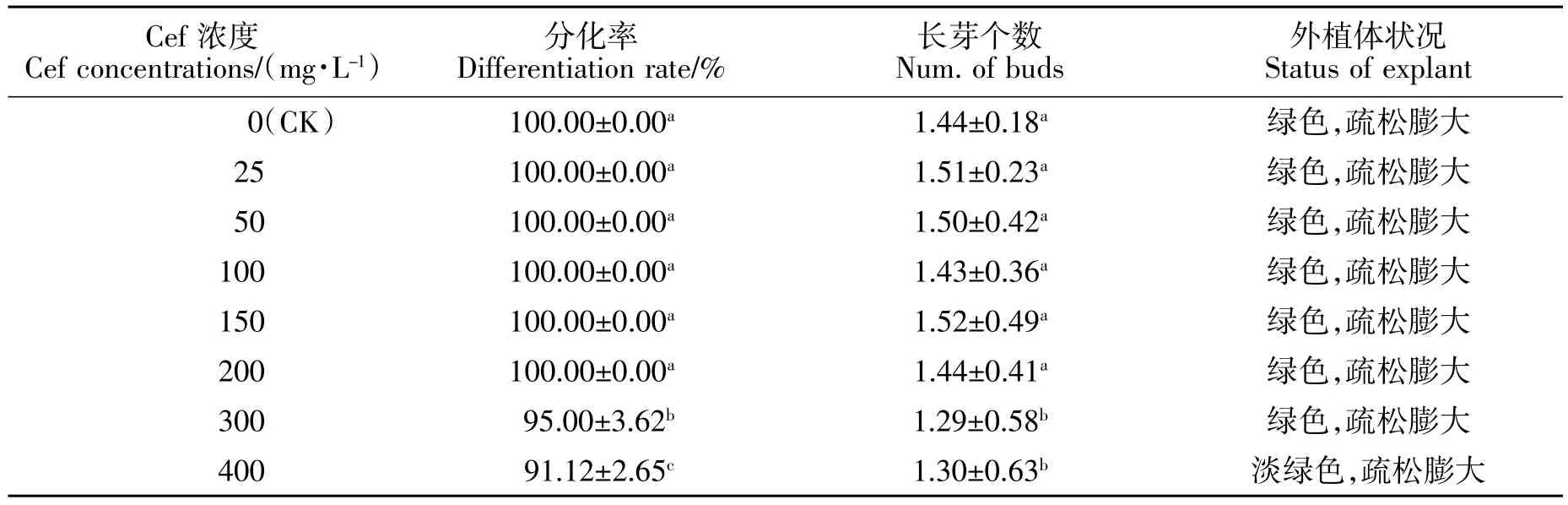
表3 头孢霉素对不定芽分化的影响Table 3 Effect of different concentrations Cef on adventitious bud induction

图3 卡那霉素和潮霉素对无菌苗诱导生根的影响(20 d)Figure 3 Effects of different concentrations Km and Hm on aseptic seedling rooting (20 d)

图4 头孢霉素对无菌苗生根诱导的影响(20 d)Figure 4 Effects of different concentrations Cef on aseptic seedling rooting (20 d)
2.3 头孢霉素对农杆菌抑制的效果
2.3.1 直接浸染外植体法
采用直接浸染外植体法的抑制结果见表4。在没有添加头孢霉素的培养基中,在接种次日,愈伤周围即出现菌斑,感染率达100%,随着头孢霉素浓度的增大,菌斑出现时间延长,感染率也逐渐下降,当浓度为50 mg/L 时,7 d 后才开始出现菌斑,感染率仅为10%。当头孢霉素浓度为100 mg/L 或更高时,已没有菌斑出现,表明农杆菌生长已完全被抑制。
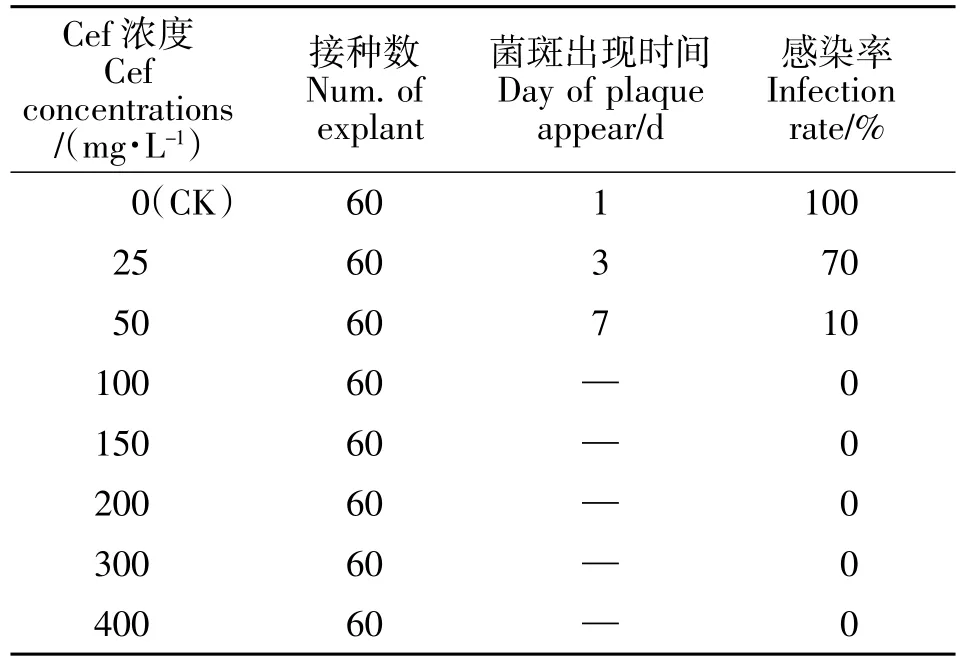
表4 不同头孢霉素浓度抑菌效果Table 4 The inhibitive effects of different concentrations Cef on agrobacterium
2.3.2 OD600光密度值测定法
采用OD600光密度值测定法检测抑菌效果见图5。随着头孢霉素浓度的增大,抑制效果越强,当YEB 液体培养基中没有添加头孢霉素时,培养12 h和 48 h 后,OD600值分别为 2.787 和 2.801,当头孢霉素浓度为25 mg/L 时,培养12 h 和48 h 时的OD600值分别为0.327、1.789,随着头孢霉素浓度的逐渐增加,2 个培养时间的OD600值均逐渐降低,当浓度为100 mg/L 或更大时,各处理的菌液OD600值均接近0,表明头孢霉素浓度等于或大于100 mg/L 时,已完全抑制农杆菌的生长(图5)。
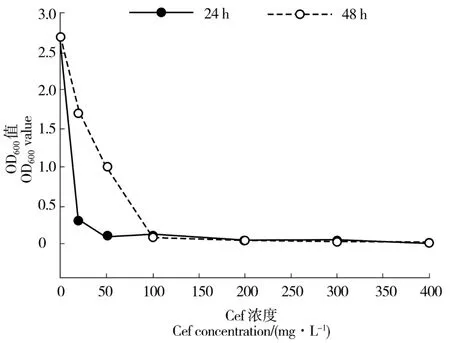
图5 头孢霉素对农杆菌抑制效果Figure 5 The inhibitive effects of different concentrations Cef on agrobacterium
通过上述两种抑菌试验方法可看出,头孢霉素对农杆菌LBA4404 有较好的抑制作用,当浓度为100 mg/L 即可抑制农杆菌株的生长。
3 讨论与结论
3.1 讨论
通过农杆菌介导进行植物遗传转化,一般需建立高效再生体系和转化体系。在转化体系的建立中,要明确外植体对筛选物的敏感性,即筛选物在一定的浓度下可抑制非转化细胞的生长、发育和分化,而转化细胞因携带相应的抗性基因能正常生长、分裂和分化;同时,也要求该筛选物对外植体没有严重的毒性[9]。不同物种、同一物种不同类型的相同外植体,以及同一物种的不同外植体,对筛选物的敏感性均不尽相同。例如,在紫雨桦离体叶片愈伤对不同筛选物的敏感试验中,头孢霉素和头孢曲松钠的筛选压范围为200~400 mg/L、特美汀的则为400~800 mg/L[10];在金发草愈伤的生长分化中,卡那霉素的筛选压为15 mg/L,但氨苄青霉素的浓度高达1 000 mg/L 时,对其愈伤的诱导分化仍影响不大[11];在刺槐形成层诱导愈伤分化的筛选物试验中,卡那霉素的筛选压浓度范围为100~125 mg/L,在无菌苗诱导生根的筛选浓度则为75 mg/L[12]。本试验使用的3 种筛选物,所得结果与上述3 种植物的结果不尽相同。因此,在遗传转化中,筛选物类型和浓度的选择,需据植物不同植物、不同外植体和表达载体上携带的标记基因等因子经筛选而定。
卡那霉素能够与非转基因植物细胞内线粒体和叶绿体结合,而毒害植物绿色器官使其缺绿,导致白化或黄化死亡[12];而潮霉素通过竞争细胞叶绿体和线粒体中的核糖体与延长因子EF-2 的结合位点,从而抑制肽链的延长,破坏细胞的翻译功能,使细胞中蛋白质合成受阻,使敏感组织褐化死亡。而转基因阳性植株会编码使对应抗生素失活的酶,从而产生抗性[13]。本试验中,无论是不定芽分化还是生根诱导,外植体表现出对潮霉素更敏感,这与楸树[14]、金发草[11]和黄连木[15]在遗传转化的抗生素试验结果相近;表明潮霉素较卡那霉素对黄梁木外植体的毒性更强,细胞发育和生长受到更强的抑制。另外,采用卡那霉素作为筛选物,生根过程的筛选压(10 mg/L)比不定芽分化过程的筛选压(20 mg/L)低,表现出植体在生根过程对卡那霉素更敏感,结果与刺槐遗传转化中筛选物试验的结果相同[12]。
抑菌抗生素是农杆菌的有效抑制剂,在抑菌筛选物筛选中,不仅需要筛选物在适宜浓度下可抑制农杆菌的生长,而且在该浓度下,外植体的正常生长不受影响或影响较小[9,16]。黄梁木外植体在不定芽分化和生根过程对头孢霉素的敏感性较低,当浓度高达400 mg/L 时,影响仍较小;但农杆菌LBA4404较敏感,在头孢霉素浓度为100 mg/L 时,即可抑制农杆菌的生长,较适合作为黄梁木遗传转化的抑菌剂。
3.2 结论
卡那霉素、潮霉素作为黄梁木遗传转化的筛选物,对黄梁木不定芽分化和生根有明显的抑制作用,且随着抗生素浓度的增大而增强。用卡那霉素和潮霉素作为黄梁木遗传转化不定芽分化、生根诱导过程的筛选物,卡那霉素的敏感浓度分别为20和10 mg/L,而潮霉素的敏感浓度均为10 mg/L;结合外植体在诱导不定芽分化、生根筛选试验中对头孢霉素敏感性,以及农杆菌对头孢霉素敏感性试验,可使用浓度为200 mg/L 的头孢霉素抑制农杆菌生长或脱菌。该结果为黄梁木采用生物技术手段特别是利用农杆菌介导的遗传转化进行抗性育种奠定基础。

