缺氧条件下受禾谷镰刀菌污染的玉米蛋白粉品质变化规律和呕吐毒素(DON)的积累规律研究
闫珊珊,刘光芒,王建萍,林 燕,白世平,张克英,吴彩梅
(四川农业大学动物营养研究所/四川省、农业农村部动物抗病营养与饲料重点实验室,成都 611130)
玉米蛋白粉是玉米的副产物,作为家禽蛋白饲料,2014 年以来,每年消费量维持在220 万t。玉米在生长、加工、储运过程中,品质易受霉菌毒素影响,其中呕吐毒素(Deoxynivalenol,DON)污染严重。DON 是禾谷镰刀菌(Fusarium graminearum)的次生代谢产物,DON 及其衍生物15 乙酰基脱氧雪腐镰孢菌烯醇(15-acetyldeoxynivaleno,15AC-DON)、3乙酰基脱氧雪腐镰孢菌烯醇(3-acetyldeoxynivaleno,3AC-DON)、脱氧雪腐镰孢菌烯醇-3-葡萄糖苷(Deoxynivalenol-3-glucoside,DON-3-G)可致动物呕吐、腹泻、生产性能降低[1-2]。禾谷镰刀菌生长过程中会消耗玉米蛋白粉营养素,降低其品质,因霉变和霉菌毒素污染导致每年约有25%的玉米及其副产物不能用于畜禽养殖,因此,在饲料资源短缺的前提下,开展本研究为防控玉米蛋白粉在缺氧存储条件下DON 污染及霉变玉米蛋白粉的利用提供理论依据。DON 产生菌主要为禾谷镰刀菌,研究发现菌株的来源、培养基种类、水分、温度、培养时间以及通氧量是影响禾谷镰刀菌产DON 的主要因素。武爱波[3]从小麦中分离出4 株中国代表性和7 株欧洲代表性产DON 的禾谷镰刀菌株,通过HPLC 定量分析表明欧洲菌株DON 产量高于中国菌株。陆鸣等[4]研究发现,禾谷镰刀菌接种至小麦培养基,温度25 ℃,培养时间30 d 时DON 产生量最大,最大值为536 μg/g;B.Birzel 等[5]研究发现,禾谷镰刀菌接种至小麦培养基,水分20%,温度20 ℃,培养时间12 w时DON 产生量最大,最大值为810 μg/kg;姜云晶等[6]研究发现,禾谷镰刀菌接种至玉米培养基,水分30%,温度25 ℃,培养时间25 d 时DON 产生量最大,最大值为 56.65 mk/kg;M.L.Ramirez 等[7]研究发现,禾谷镰刀菌接种至小麦培养基,水分活度0.98 aw,温度25 ℃,培养时间42 d 时DON 产生量最大,最大值为135 462 ng/g。有学者研究豆粕霉变对其品质的影响,发现随着霉变程度加深,粗脂肪、粗纤维和淀粉含量有所下降,粗蛋白质含量无显著变化[8-10]。玉米蛋白粉受霉菌污染后的品质变化规律、DON 的毒素积累规律尚不明确,玉米蛋白粉品质变化的关键影响因素初始水分和霉菌的量对其品质变化和毒素积累规律的影响尚不清楚。玉米蛋白粉存储过程中缺氧条件为主要存储条件,因此,本研究主要考察缺氧存储条件下,初始水分和禾谷镰刀菌接种量对玉米蛋白粉品质和DON、15AC-DOC 变化的影响,明确玉米蛋白粉品质变化规律和DON、15AC-DOC的积累规律。
1 材料和方法
1.1 试验材料
1.1.1 材料
DON 产毒菌株:禾谷镰刀菌(Fusarium graminearum)14-62-1,由四川农业大学植物病理学教研室提供;玉米蛋白粉:购自漯河天嘉生化有限公司。
1.1.2 试剂
DON 标准对照品、15AC-DON 标准对照品(上海源叶公司),甲醇、乙腈(色谱纯,美国Sigma 公司),试验用水为纯水系统(美国Milipore 公司)制备的18.2 MΩ·cm 超纯水。浓硫酸、硫酸铜、无水硫酸钠、硼酸、乙醚、氢氧化钠、高氯酸、氢氧化钾、盐酸和无水乙醇等均为分析纯(成都科龙公司)。
1.1.3 仪器
液相色谱-串联质谱仪(Agilent 1200-6430 Triple Quad,美国 Agilent 公司),高效液相色谱仪(HPLC-e2695,美国Waters 公司),超高效液相色谱仪(UPLC H-Class,美国 Waters 公司),恒温恒湿培养箱(3913,美国Thermo 公司),氨基酸自动分析仪(日立L8900型,日本日立公司),半自动凯氏定氮仪(K-360 型,瑞士BUCHI 公司),全自动纤维测定仪(A2000220,美国Ankom 公司),紫外分光光度计(UV-300 型,美国Thermo 公司)。
1.2 试验方法
1.2.1 试验设计
采用二因子3×4 水平设计,GB 13078-2017[11]规定饲料中霉菌总数限量标准为4×104个/g,因此接种量设计水平围绕霉菌限量标准分别设置为1×103、1×104和 1×105个/g,NY/T 685-2003[12]规定玉米蛋白粉储藏期间水分含量为≤12%,因有报道[13-14]玉米蛋白粉在储存期间水分含量可达到12%、15%、18%、20%和30%,因此本试验水分设计水平分别为13%、16%、20%和22%,由此研究玉米蛋白粉在存储期间相对低水分含量(13%、16%)和高水分含量(20%、22%)时,接种不同量的禾谷镰刀菌后,玉米蛋白粉的品质变化和DON 的积累规律。具体方案见表1。
1.2.2 样品处理
将确定为产毒菌的禾谷镰刀菌14-62-1 接种于PDA 平板复壮培养5~7 d,将菌丝接种于绿豆汤液体培养基(绿豆20 g,蒸馏水中煮沸10 min,纱布过滤,加蒸馏水定容至1 L)中,产生分生孢子后,将分生孢子的浓度调制成1×106个/mL 的孢子悬液,并逐级稀释成浓度为 1×105、1×104个/mL 的孢子悬液,待用。将原始水分为5.97%的玉米蛋白粉采用强度10 kGy 的60Co-γ 射线辐照灭菌,加水制成水分含量分别为13%、16%、20%、22%的样品,加水方法参照蔡静平等[15]研究,根据已测定的玉米蛋白粉样品原始水分含量,计算所需加水量。理论加水量=M(C1-C0)/(100-C1)。其中,M:样品的重量(g),C0:样品的原始水分(%),C1:样品所需要的水分(%)。通过无菌自封袋分装模拟玉米蛋白粉的缺氧存储条件,每袋40 g,密封,混匀。
各样品分别接种 1×104、1×105和 1×106个/mL浓度悬液各4 mL(此体积已纳入水分含量计算),使样品的霉菌数分别为 1×103~1×105个/g,每个处理组设置样品20 袋。
1.2.3 指标测定方法
将不同处理组样品放置于温度为(25±2)℃,湿度为75%±5%的恒温恒湿培养箱中培养,培养期间每天定时混匀样品,分别在培养的第 0、5、10、15、20、30 和60 天的每天上午9:00 采样,采样在厌氧培养箱中进行,从20 袋样品中各取5 g 混匀,立即进行霉菌总数测定,其余样品放置于-80 ℃保存,用于营养素、品质评价指标及DON 含量测定,其中DON和15AC-DON 采用HPLC-MS/MS 确证,确证方法采用液质联用法[16],指标测定方法见表2。

表1 试验设计表Table 1 Experiment design table
表2 指标及测定方法Table 2 Indexes and determination methods
1.3 统计分析
采用SAS 9.4 软件中PROC MIXED 程序进行数据分析,模型为:Yijkl=μ+αi+βj+γk+(αβγ)ijk+tl+εijkl。式中:Yijkl为因变量,μ 为变量的总体平均值,αi为接种量水平(i=1×103,1×104,1×105个/g),βj为水分水平(j=13%,16%,20%,22%),γk为培养时间(k=0,5,10,15,20,30,60 d),(αβγ)ijk为影响因素之间的交互作用,tl为玉米蛋白粉中各样品指标的重复测量,εijkl为随机误差。方差分析显著者,用Turkey 法进行多重比较,P<0.05 作为显著性水平检验标准,结果用平均值表示。
2 结果与分析
2.1 接种禾谷镰刀菌后玉米蛋白粉品质变化规律
2.1.1 粗蛋白质含量的变化规律
玉米蛋白粉各处理组培养期间粗蛋白质、氨基酸含量变化见表3~表5。培养期间禾谷镰刀菌接种量、初始水分是粗蛋白质含量变化的主要影响因素,对氨基酸含量变化无影响,二者对粗蛋白质含量变化互作效应显著(P<0.05),对氨基酸含量变化互作效应不显著(P>0.05)。13%和16%水分含量组粗蛋白质无显著变化(P>0.05),20%和22%水分含量组粗蛋白质随着培养时间的延长呈线性增加(P<0.01)。必需氨基酸中Leu、Ile 和Trp 含量分别平均为10.71%、2.21%和 0.30%。Phe、Lys、Met、Arg、His、Val 和 Thr含量随着培养时间的延长均呈二次曲线变化(P<0.01)。非必需氨基酸中Cys、Pro 和Asp 含量分别平均为0.70%、5.62%和 3.86%。Ala、Gly、Glu、Ser 和 Tyr 含量随着培养时间的延长均呈二次曲线变化(P<0.01)。
2.1.2 粗脂肪、淀粉、粗纤维含量的变化规律
玉米蛋白粉各处理组培养期间粗脂肪、淀粉、粗纤维含量变化见表6。培养期间初始水分是粗脂肪、淀粉、粗纤维含量变化的主要影响因素,禾谷镰刀菌接种量对其无显著影响(P>0.05),二者互作效应不显著(P>0.05)。不同水分含量组粗脂肪、淀粉、粗纤维含量随着培养时间的延长呈线性降低(P<0.01)。
2.1.3 其他品质评价指标变化规律
玉米蛋白粉各处理组培养期间蛋白质溶解度、酸价、能量和霉菌总数变化见表7 和表8。培养期间初始水分和禾谷镰刀菌接种量是霉菌总数变化的主要影响因素,但禾谷镰刀菌接种量对蛋白质溶解度、酸价、能量变化无显著影响(P>0.05),二者对霉菌总数变化存在互作效应,对蛋白质溶解度、酸价、能量变化互作效应不显著(P>0.05)。不同水分含量组酸价随着培养时间的延长呈线性上升(P<0.01),蛋白质溶解度、能量随着培养时间的延长呈线性降低(P<0.01)。禾谷镰刀菌接种量 1×103~1×105个/g 的 13%和16%水分含量组霉菌总数无显著变化(P>0.05),20%和22%水分含量组霉菌总数随着培养时间的延长呈二次曲线变化(P<0.01)。
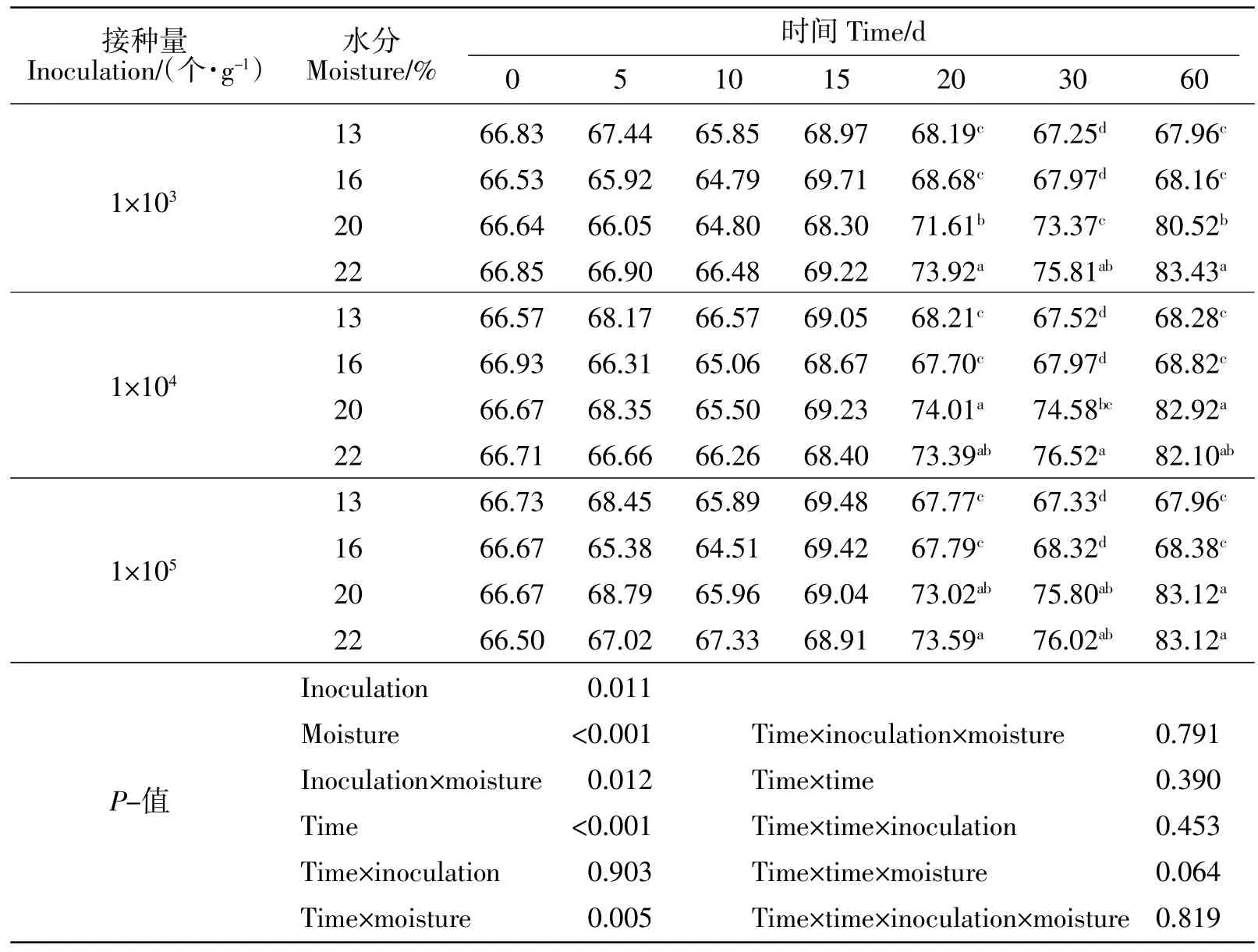
表3 禾谷镰刀菌接种量和水分对玉米蛋白粉中粗蛋白质变化的影响Table 3 Effect of inoculation and moisture of Fusarium graminearum on CP in CGM(% DM)

表4 禾谷镰刀菌接种量和水分对玉米蛋白粉中必需氨基酸变化的影响Table 4 Effect of inoculation and moisture of Fusarium graminearum on essential amino acid in CGM (DM)
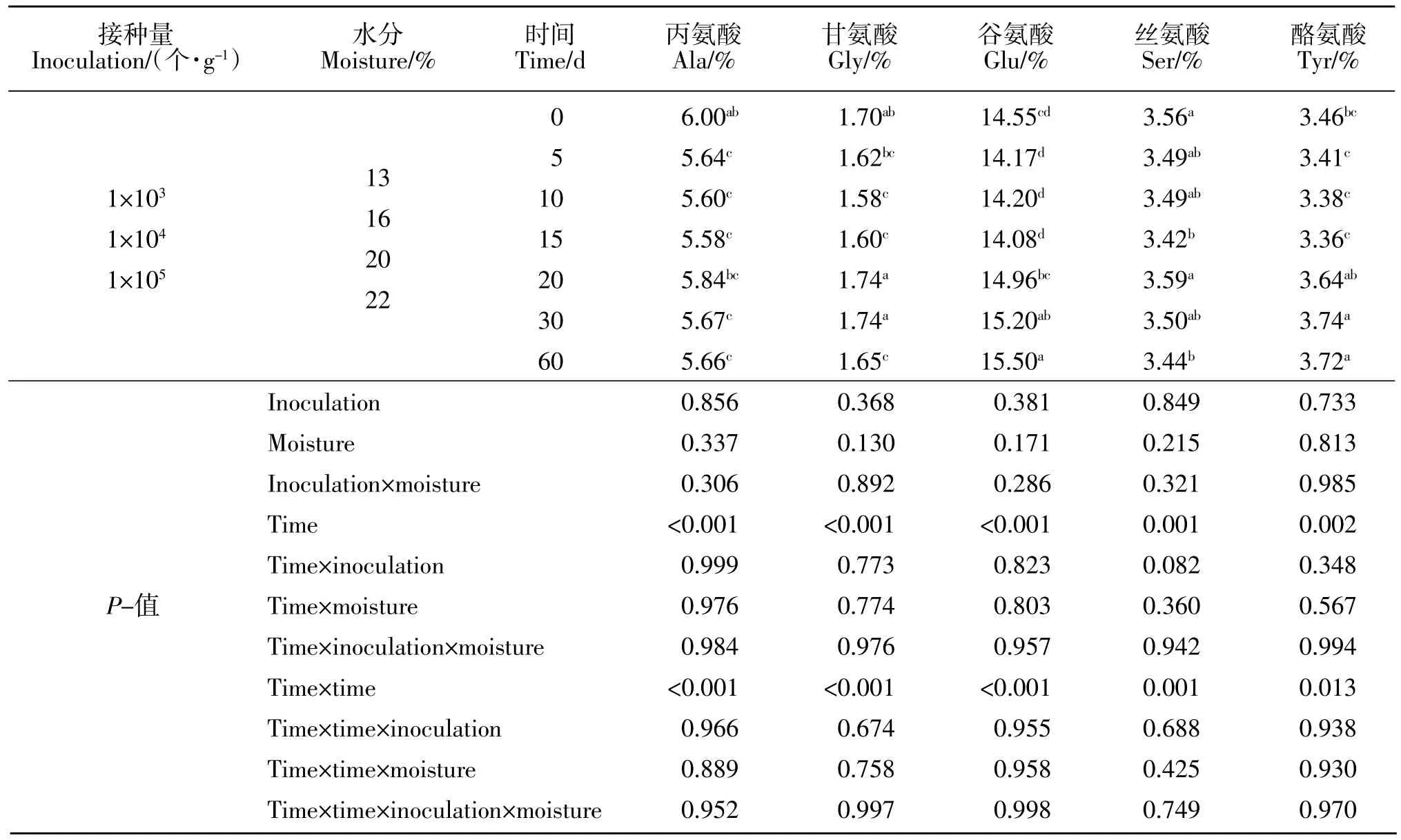
表5 禾谷镰刀菌接种量和水分对玉米蛋白粉中非必需氨基酸变化的影响Table 5 Effect of inoculation and moisture of Fusarium graminearum on non-essential amino acid in CGM (DM)

表6 禾谷镰刀菌接种量和水分对玉米蛋白粉中粗脂肪、淀粉、粗纤维变化的影响Table 6 Effect of inoculation and moisture of Fusarium graminearum on EE、Starch、CF in CGM (DM)
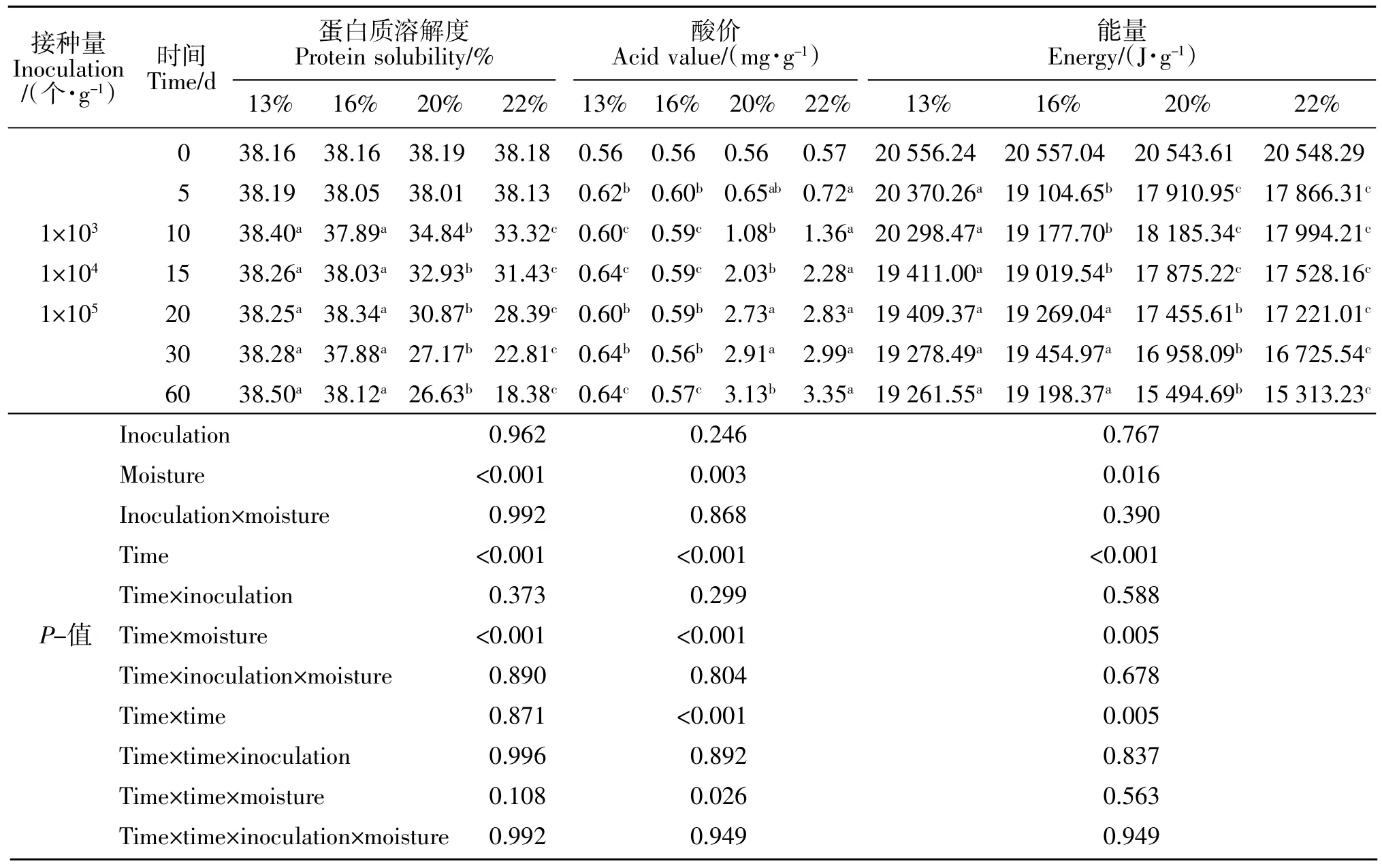
表7 禾谷镰刀菌接种量和水分对玉米蛋白粉中品质评价指标变化的影响Table 7 Effect of inoculation and moisture of Fusarium graminearum on quality evaluation index in CGM (DM)

表8 禾谷镰刀菌接种量和水分对玉米蛋白粉中霉菌总数变化的影响Table 8 Effect of inoculation and moisture of Fusarium graminearum on total mold in CGM(cfu·g-1 FM)
2.2 DON和15AC-DON积累规律
缺氧存储条件下,玉米蛋白粉随着培养时间的延长 DON 和15AC-DON 有检出,UPLC 测定图谱如图1a,DON 标准品保留时间为4.685 min,样品保留时间为4.694 min,样品保留时间与标准对照品相比,误差为0.02%,在允许偏差±2.5%范围内。HPLC测定图谱如图1b,15AC-DON 标准品保留时间为8.048 min,样品保留时间为8.007 min。样品保留时间与标准对照品相比,误差为0.5%,在允许偏差±2.5%范围内。HPLC-MS/MS 确证图谱如图2 所示,DON 和15AC-DON 标准品保留时间分别为2.345 和2.335 min,样品保留时间分别为2.456 和2.456 min,样品保留时间与标准对照品相比,误差均为0.5%,在允许偏差±0.5%范围内。测定结果如表9 所示。结果表明,玉米蛋白粉中 DON 在试验第 5、15、30、60 d 有检出,15AC-DON 在试验第 5、30、60 d 有检出。随着培养时间的延长,玉米蛋白粉接种禾谷镰刀菌后未见红色分泌物并且DON 和15AC-DON 未出现积累规律。
2.3 玉米蛋白粉霉变程度与品质变化之间的关系

图1 玉米蛋白粉中DON 和15AC-DON 的色谱图Figure 1 Chromatogram of deoxynivalenol in CGM cultivate
霉变程度与玉米蛋白粉品质变化之间有何联系?是否为霉变程度越严重,其品质越差?为了证实该问题,将玉米蛋白粉霉变前期(0~20 d),霉变中期(20~30 d),霉变后期(30~60 d)3 个时期的霉菌总数与品质评价指标进行相关性分析,结果表明,霉变前期玉米蛋白粉中霉菌总数与粗蛋白质(r=0.674,P<0.001),酸价(r=0.834,P<0.001)呈正相关,与氨基酸(r=-0.820,P<0.001),粗脂肪(r=-0.520,P<0.001),淀粉(r=-515,P<0.001),粗纤维(r=-0.511,P<0.001),蛋白质溶解度(r=-525,P<0.001)呈负相关;霉变中期玉米蛋白粉中霉菌总数与粗蛋白质(r=0.911,P<0.001),酸价(r=0.867,P<0.001)呈正相关,与氨基酸(r=-0.820,P<0.001),粗脂肪(r=-0.611,P<0.001),淀粉(r=-621,P<0.001),粗纤维(r=-0.634,P<0.001),蛋白质溶解度(r=-949,P<0.001)呈负相关;霉变后期玉米蛋白粉中霉菌总数与粗蛋白质(r=0.945,P<0.001),酸价(r=0.969,P<0.001)呈正相关,与氨基酸(r=-0.911,P<0.001),粗脂肪(r=-0.522,P<0.001),淀粉(r=-535,P<0.001),粗纤维(r=-0.517,P<0.001),蛋白质溶解度(r=-916,P<0.001)呈负相关。因此,玉米蛋白粉接种禾谷镰刀菌后,霉变程度与品质变化呈负相关。

图2 玉米蛋白粉中DON 和15AC-DON 的质谱图Figure 2 MRM chromatogram of deoxynivalenol in CGM cultivate
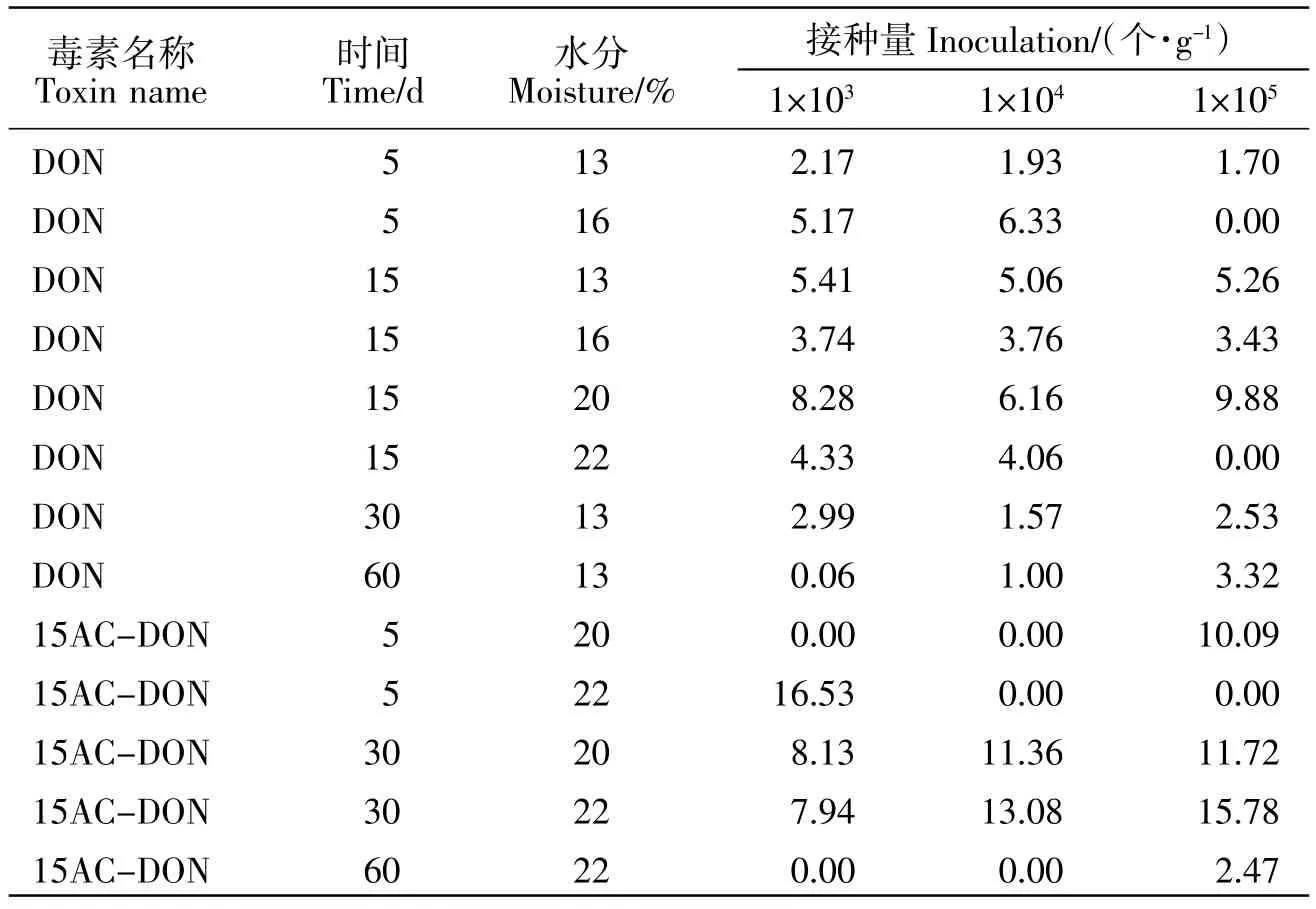
表9 玉米蛋白粉中DON 和15AC-DON 测定结果Table 9 Determination results of DON and 15AC-DON in CGM (mg·kg-1 DM)
3 讨论
3.1 初始水分和禾谷镰刀菌接种量对玉米蛋白粉品质变化规律的影响
禾谷镰刀菌在生长过程中需要C 源(碳水化合物)和N 源等营养物质的供给为自身生长提供能量[27]。玉米蛋白粉营养素中淀粉(15%)、粗脂肪(7%)和粗纤维(2%)可为禾谷镰刀菌提供C 源,粗蛋白(65%)、氨基酸(65%)可为禾谷镰刀菌提供N 源。本研究发现,缺氧存储条件下,13%、16%、20%和22%初始水分含量组为禾谷镰刀菌提供N 源的粗蛋白质、氨基酸和非蛋白氮绝对消耗率分别为2%、1.4%和0.6%,24%、19%和5%;而为禾谷镰刀菌提供C 源的淀粉、粗纤维和粗脂肪绝对消耗率分别为16%、8%和18%,85%、52%和41%;说明玉米蛋白粉中粗蛋白质、氨基酸和非蛋白氮为禾谷镰刀菌生长提供N 源,淀粉、粗纤维和粗脂肪为其提供C 源。禾谷镰刀菌在13%~22%的初始水分下,对C、N 源的利用规律一致,蛋白氮为其提供主要N 源,其次为非蛋白氮,淀粉为其提供主要C 源,其次为粗纤维、最后为粗脂肪,有所不同的是,禾谷镰刀菌在20%和22%的初始水分条件下,对C、N 源的绝对消耗率比在13%和16%的初始水分条件下高。C.Reed 等[28]将玉米分别放置于温度25 ℃,水分15%、16.5%和18%的缺氧条件下储藏,并接种典型霉菌以模拟玉米在培养箱中存放6~8 个月后可能出现的霉菌接种量,研究发现,玉米中初始水分含量越高,霉变越易发生,玉米中脂肪、淀粉含量降低越快,与本研究结果一致。陈喜斌等[9]研究了豆粕自然霉变对其营养价值的影响,王之盛等[10]研究了储藏对配合饲料蛋白质营养价值的影响,结果表明,高水分含量组,粗蛋白质含量无显著变化与本研究结果不一致,原因可能是试验所用霉菌种类不同,本试验所用霉菌为禾谷镰刀菌,其为需氧菌,在有氧条件下更易生长,禾谷镰刀菌生长代谢时,可将玉米蛋白粉中的蛋白质、碳水化合物等主要营养物质分解成小分子物质供其生长繁殖,同时又可不断地分泌出代谢产物,并也可能利用无机氮源合成微生物菌体蛋白从而使粗蛋白含量升高[29]。本试验发现蛋白氮即氨基酸的绝对消化率,13%和16%的初始水分组为1.4%,20%和22%的初始水分组为19%,为禾谷镰刀菌提供了N 源。而氨基酸中Phe、Met、Lys、Arg、His、Val、Ala、Gly 和 Ser 含量总体呈下降趋势,陈喜斌等[9]和王之盛等[10]研究发现,必需氨基酸中Met、Lys,非必需氨基酸中Ala 含量下降程度最大,与本研究结果一致,说明以上氨基酸作为蛋白氮为禾谷镰刀菌提供了N 源。Glu 和Tyr 含量总体呈上升趋势,说明禾谷镰刀菌生长时不消耗以上两种氨基酸,同时产生的微生物菌体蛋白中可能包含此两种氨基酸。而 Leu、Ile、Thr、Cys、Trp 和 Pro 的含量,在整个培养过程中无变化,说明禾谷镰刀菌生长时未利用以上氨基酸,也未产生相应代谢物。
3.2 缺氧条件下DON和15AC-DON的积累规律
本试验在接种产DON 毒素的禾谷镰刀菌后,未发现明显的毒素积累规律,仅部分试验组检出DON和15AC-DON。有文献[30]报道,禾谷镰刀菌在产DON时会伴随红色分泌物的产生,而缺氧存储条件下,玉米蛋白粉培养60 d 期间未见红色分泌物。分析原因可能有3 种,第一个可能原因为禾谷镰刀菌是需氧菌,而本试验是模拟玉米蛋白粉缺氧存储条件,初始氧气很快耗尽导致菌种无法在适宜条件下生长或生长速度减慢,60 d 的培养期还没有达到分泌红色分泌物的期限,从而影响禾谷镰刀菌的产毒。E.Alvarez等[31]将湿态玉米酒精糟分别放置于温度16 ℃的缺氧条件下存储60 d 和有氧条件下存储20 d,发现,在缺氧条件下,玉米酒精糟储存10 d 后表面变质但并未检测出霉菌毒素,但在有氧存储过程中检测出了DON,说明禾谷镰刀菌在有氧条件下易产毒。第二个可能原因为本试验为了排除干扰因素在试验前进行了物理灭菌,没有霉菌与禾谷镰刀菌竞争性生长,有文献[32]报道,霉菌间的竞争性生长促进毒素的产生,A.Velluti 等[33]研究,在温度为 15、25 ℃,水分活度为0.98、0.95 和0.93 aw 条件下,接种产伏马毒素的拟轮生镰孢菌,层出镰孢菌和产DON 的禾谷镰刀菌,研究菌株之间相互作用对真菌毒素形成的影响,结果发现,三者之间相互作用对禾谷镰刀菌产玉米赤霉烯酮毒素没有显著影响,但在水分活度为0.98 aw 时,拟轮生镰孢菌,层出镰孢菌可显著促进禾谷镰刀菌产DON。而玉米蛋白粉实际存储时是多菌共同存在的,其他霉菌如黄色镰刀菌、串珠镰刀菌、雪腐镰刀菌也可产生DON 或者15AC-DON。第三个原因可能为禾谷镰刀菌在极端变化的条件下如温度骤降或骤增或者其他外部条件刺激,会增加产毒量。R.R.M.Paterson 等[34]研究发现,气温突然下降时,DON 的含量会显著升高。A.K.Audenaert 等[35]研究发现,低浓度的H2O2能够刺激禾谷镰刀菌中DON 的生物合成。而本试验培养条件恒定,没有温度或者其他外部条件刺激,从而造成DON 和15ACDON 积累未出现预期。玉米及其副产物实际存储条件存在缺氧和有氧条件,因此,为探明玉米蛋白粉中毒素与品质变化的关系,应进一步开展有氧、多菌共生和动态培养的试验。
4 结论
缺氧存储条件下,初始水分是玉米蛋白粉品质变化的主要影响因素,禾谷镰刀菌接种量不是主要影响因素,玉米蛋白粉品质随水分含量增高和培养时间延长逐渐降低。缺氧存储条件下,DON 和15ACDON 在培养的60 d 内,部分培养阶段有检出。

