干旱胁迫对甜菜块根膨大期光合光响应特性的影响
王克哲,李思忠,杜亚敏,侯丽丽,高丽丽,孙桂荣,彭云承,曹 禹
(1.伊犁州农业科学研究所,新疆伊宁 835000;2.新疆农业科学院经济作物研究所,乌鲁木齐 830052)
0 引 言
【研究意义】甜菜作为世界两大糖料作物之一,因具有耐盐碱、抗旱、耐贫瘠及适应性广、抗逆性强等特点,在我国北方干旱、半干旱地区广泛种植,是北方地区重要的经济作物之一[1]。干旱胁迫是作物主要非生物胁迫因子之一。在新疆干旱区,水资源相对短缺及时空分布不均仍然是影响甜菜生产发展的重要因素,干旱、高温等极端天气发生频率和强度的增加,将进一步限制甜菜生产[2, 3]。叶片是进行光合生产的主要器官,是产量形成的基础,光合作用不仅受品种内在遗传特性的影响,同时也受外部气候因素干旱天气的影响[4]。研究干旱胁迫对甜菜块根膨大期叶片光合光响应特性的影响,对干旱区滴灌甜菜高产栽培有实际意义。【前人研究进展】水分胁迫条件下甜菜叶片叶绿素含量减少,净光合速率、蒸腾速率和气孔导度下降,糖积累量减少,从而使甜菜减产[5, 6]。有研究表明,在适宜范围内减少滴水量,甜菜叶片净光合速率和蒸腾速率值反而较高,旱后复水对作物光合速率具有超补偿效应,利于作物增产和水分利用效率的提高[5, 7-9]。马永胜等[10]研究表明,相较其它生育时期,甜菜在叶丛生长期对水分的需求敏感,此时期的补水灌溉直接影响最终产量。当土壤水分含水量达田间持水量的50%时,甜菜减产25%[11]。【本研究切入点】前人对不同水分条件下甜菜叶片生理特性、光合物质生产及需水规律等进行了大量的研究[12, 13],而关于膜下滴灌甜菜块根膨大期干旱胁迫下叶片光合光响应特性研究较少,且目前光合光响应曲线的测定与拟合已广泛应用于水稻[14]、玉米[15]等作物。研究干旱胁迫对甜菜块根膨大期叶片光合光响应特性的影响。【拟解决的关键问题】选取2个甜菜品种,在甜菜块根膨大期进行控水,测定干旱条件下甜菜叶片的光响应过程,选用非直角双曲线数学模型进行拟合,并计算光响应参数,研究甜菜光合作用光响应过程及其主要参数对干旱胁迫的响应规律,为干旱区滴灌甜菜高产栽培提供科学依据。
1 材料与方法
1.1 材 料
试验在新疆伊犁州农业科学研究所试验田进行。试验地为壤土,含全氮0.78 g/kg,速效磷0.016 g/kg,速效钾0.019 g/kg,前茬作物为玉米。2018年4月9日施入基肥磷酸二铵225 kg/hm2后春翻整地,4月10日人工点播,4月28日出苗,5月8日定苗,理论保苗11.8×104株/hm2。5月10日中耕除草。6月10日灌头水。
1.2 方 法
1.2.1 试验设计
试验设2个处理:干旱胁迫(0~40 cm土层含水量为田间持水量的40%~45%)和对照(0~40 cm土层含水量为田间持水量的70%~75%),供试甜菜品种为H1352和81GM26(均由体系育种岗位提供),随机区组排列,3次重复,每小区宽3 m,长5 m,行距0.5 m,株距17 cm ,小区面积15 m2,滴灌带铺于行距中间,1条毛管控制2行甜菜,每小区前安装水表控制灌水量,于甜菜块根膨大期进行控水,达到预定土壤含水量后测定其相关光合参数。
1.2.2 测定指标
在甜菜块根膨大期,各处理选取3株,运用美国产CIRAS-3便携式光合仪测定叶片光合作用光强响应曲线。光强响应曲线测定时光强由强到弱,依次设定PPFD为2 500、2 200、2 000、1 800、1 500、1 200、1 000、800、600、400、200、175、150、100、50、30、0 μmol/(m2·s)进行测定,参比室二氧化碳浓度设置为390 μmol/mol,叶片温度设定为30℃。
绘制光强响应曲线,运用非直线双曲线模型进行模拟[16]。
式中,PAR为光合有效辐射;K为光响应曲线曲角;AQY为表观量子效率;Pnmax为最大净光合速率;Rd为暗呼吸速率。
在弱光照条件下,将初始部位(0≤PAR≤200 μmol/(m2·s))进行Pn-PAR线性回归,得到线性回归方程,将光响应曲线求出的最大净光合速率(Pnmax)带入该方程,求出光饱和点(LSP);将数值0带入该方程,即与X轴PAR的交点为光补偿点(LCP)。
1.3 数据处理
用SPSS19.0统计分析软件进行数据分析;Sigmaplot-10.0作图。
2 结果与分析
2.1 干旱胁迫对甜菜叶片净光速率的影响
研究表明,不同水分处理条件下,H1352和81GM26甜菜品种块根膨大期叶片Pn均随着PAR的增大的变化趋势基本一致。不同水分处理两甜菜品种叶片在PAR<200 μmol/(m2·s)初始阶段,Pn呈线性增加; 在PAR<800 μmol/(m2·s)时,Pn随PAR的升高而迅速增大;在PAR增加到光饱和点时,Pn随PAR的升高而增速减缓,渐趋平稳或下降。在不同PAR条件下,对照处理净光合速率大于干旱胁迫处理。在PAR<500 μmol/(m2·s)时,干旱胁迫处理和对照之间Pn差异不明显,而后随PAR的增大,各处理间差异达极显著水平。干旱胁迫条件下低光照对叶片净光合速率影响较小,在强光下叶片光合生产能力降低,甚至出现光抑制现象。图1

图1 干旱胁迫下甜菜叶片Pn-PAR响应曲线
Fig.1Pn-PARresponse curve of sugar beet leaves under drought stress
2.2 干旱胁迫对甜菜叶片最大净光合速率的影响
研究表明,H1352和81GM26甜菜品种最大净光合速率变化一致。与对照相比,干旱胁迫条件下叶片最大净光合速率降低,各处理间差异达极显著(P<0.01)。H1352和81GM26品种在干旱胁迫条件下最大净光合速率分别为24.8和21.0 μmol/(m2·s),分别比对照低18%和26%。干旱胁迫条件下甜菜叶片光合潜能降低,不利于叶片光合物质积累。图2
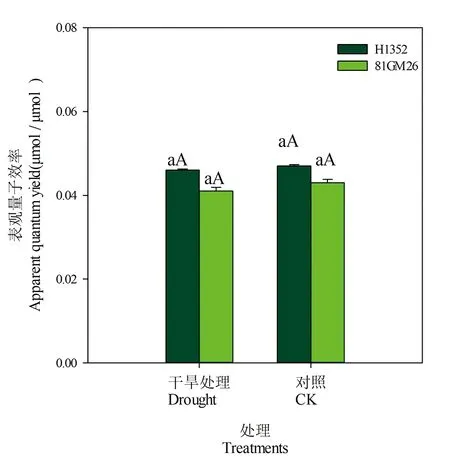
图2 干旱胁迫下甜菜叶片最大净光合速率
Fig.2 Maximum net photosynthetic rate of sugar beet leaves under drought stress
2.3 干旱胁迫对甜菜叶片暗呼吸速率的影响
研究表明,不同处理条件下甜菜品种叶片暗呼吸速率不同,H1352品种在干旱胁迫条件下叶片暗呼吸速率降低,比对照降低40.3%,而81GM26品种在干旱胁迫下叶片暗呼吸速率只有略微下降,各处理间没有显著差异。干旱胁迫条件下叶片呼吸消耗能力降低,且不同品种间有差异。图3

图3 干旱胁迫下甜菜叶片暗呼吸速率
Fig.3 Dark respiration rate of sugar beet leaves under drought stress
2.4 干旱胁迫对甜菜叶片表观量子效率的影响
在0≤PAR≤200 μmol/(m2·s)条件下进行Pn-PAR线性拟合,干旱胁迫和对照处理拟合度高达0.995(P<0.01)以上,同时根据光响应曲线拟合得出最大净光合速率值,计算出光补偿点和光饱和点。H1352和81GM26品种干旱胁迫条件下叶片表观量子效率降低,但各处理间没有显著差异。表1,图4
表1 光合-光响应曲线初始部位(0≤PAR≤200 μmol/(m2·s))的线性方程拟合
Table 1 Linear equation fitting of the initial part of photosynthetic-light response curve (0≤PAR≤200 μmol/(m2·s))

品种Cultivars处理Treatment线性拟合方程Linea fitting equation拟合度R2H1352干旱胁迫 Droughty=0.046x-2.800.997∗∗对照 CKy=0.047x-4.1880.995∗∗81GM26干旱胁迫 Droughty=0.041x-3.6280.998∗∗对照 CKy=0.043x-2.5200.998∗∗

图4 干旱胁迫下甜菜叶片表观量子效率
Fig.4 Apparent quantum efficiency of sugar beet leaves under drought stress
2.5 干旱胁迫对甜菜叶片光补偿点的影响
研究表明,不同处理间各品种叶片光补偿点表现略有不同,H1352品种在干旱胁迫条件下叶片光补偿点降低,比对照降低32%,各处理间差异达极显著水平,而81GM26品种表现则恰恰相反,叶片光补偿点升高,比对照高51%,各处理间差异达极显著水平。叶片光补偿点不仅受品种内在遗传特性的影响,同时也受干旱胁迫的影响。图5
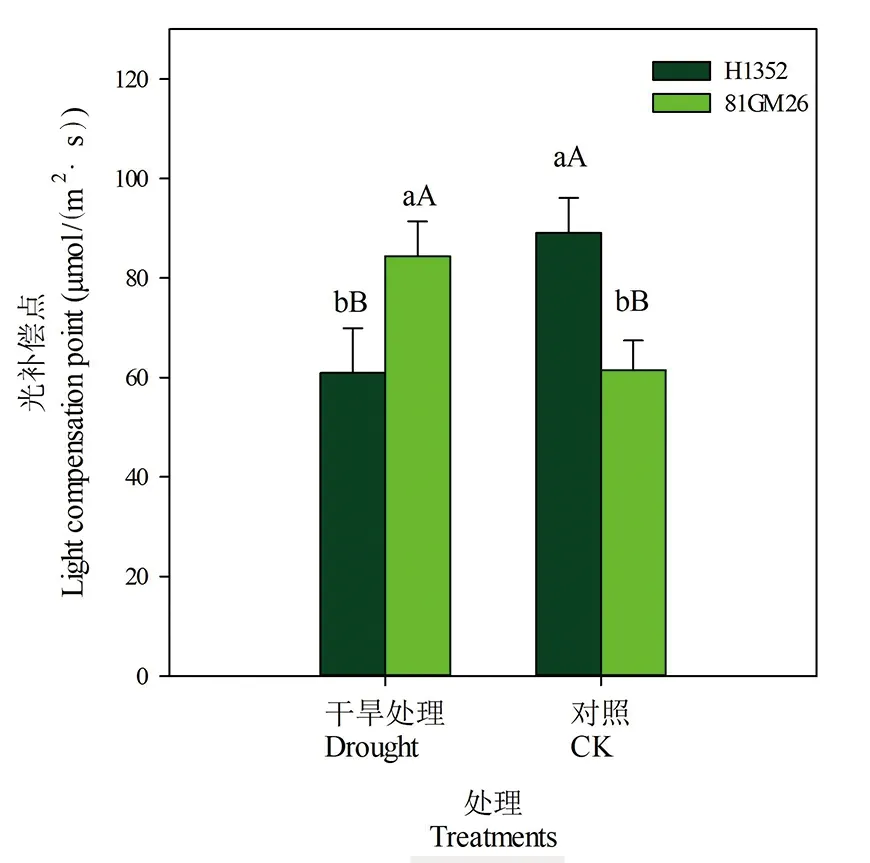
图5 干旱胁迫下甜菜叶片光补偿点
Fig.5 Light compensation point of sugar beet leaves under drought stress
2.6 干旱胁迫对甜菜叶片光饱和点的影响
研究表明,两甜菜品种(H1352、81GM26)光饱和点变化一致。与对照相比,干旱胁迫条件下叶片光补偿点降低,且处理间差异达极显著水平(P<0.01)。H1352和81GM26品种在干旱胁迫条件下光补偿点分别为600和601 μmol/(m2·s),分别比对照低18.5%和16.4%。干旱胁迫条件下甜菜叶片对强光利用效率降低。图6
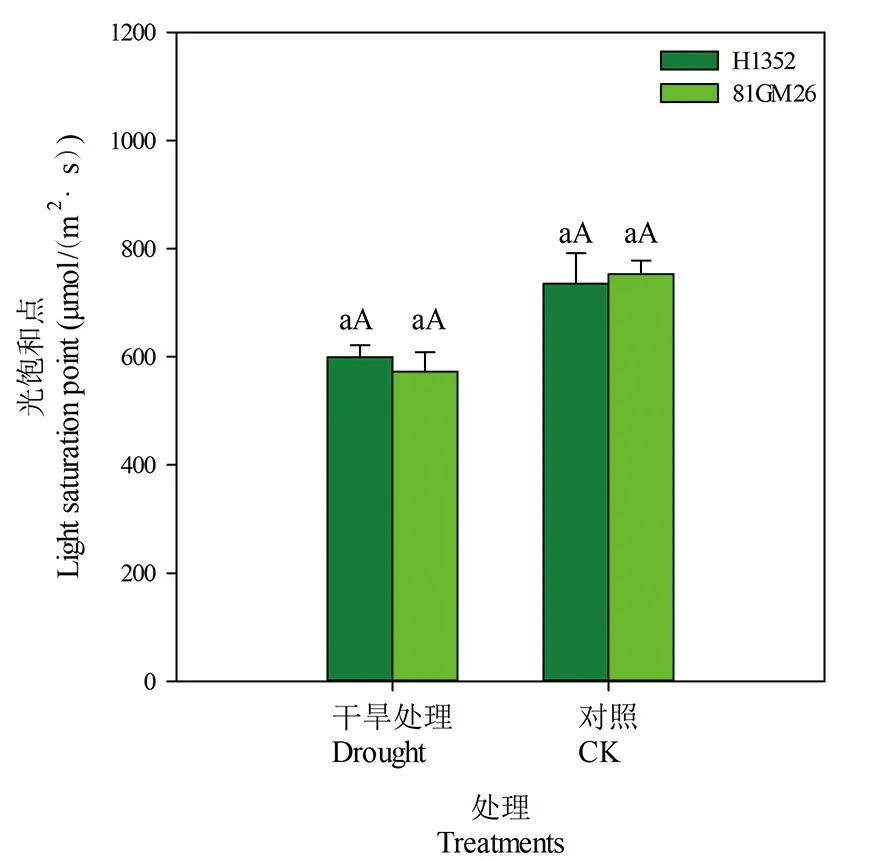
图6 干旱胁迫下甜菜叶片光饱和点
Fig.6 Light saturation point of sugar beet leaves under drought stress
3 讨 论
通过对光响应曲线的模拟是阐明植物光合作用在各种环境因子下生态适应性的重要手段之一[17]。光照和水分是影响甜菜叶片光合作用的重要生态因子。植物光合作用常受到干旱胁迫的影响而发生改变。通过分析甜菜叶片净光合速率与光合有效辐射的光响应曲线,可得出最大净光合速率(Pnmax)、暗呼吸速率(Rd)、表观量子效率(AQY)、光补偿点 (LCP)和光饱和点(LSP)主要光合参数[18]。研究结果表明,不同水分处理条件下,各品种块根膨大期叶片Pn均随着PAR的增大的变化趋势基本一致。不同水分处理两甜菜品种叶片在PAR<200 μmol/(m2·s)时初始阶段,Pn呈线性增加;后随PAR的升高而急速增大,最终渐趋平稳或下降,可能受Rubisco活性、光合中间产物磷酸丙糖代谢、叶片气孔等的限制[19]。H1352干旱胁迫处理Pn在PAR>1 800 μmol/(m2·s)左右时表现出明显的下降趋势,出现了光抑制现象,而其他处理均基本保持最大值不变。在不同PAR条件下,对照处理净光合速率大于干旱胁迫处理,且处理间差异达极显著水平,干旱胁迫下叶片光合生产能力减弱,不利于光合物质积累。研究表明,植株在干旱胁迫条件下叶片最大净光合速率、表观量子效率、暗呼吸速率、光饱和点均降低,但光补偿点升高[20, 21]。陈志成等[22]研究表明,随着土壤水分含量的降低,珍珠油杏叶片净光合速率、暗呼吸速率、光饱和点均呈降低趋势,表观量子效率先升高后降低,光补偿点先降低后升高。曹永慧等[23]研究表明,随着水分胁迫强度增加,不同产地茴香幼苗光饱和点(LSP) 和光补偿点(LCP) 值降低,最大净光合速率基本为先升后降; 而表观光量子效率(AQY) 呈增加的趋势。试验结果表明,各品种最大净光合速率和光饱和点变化一致。与对照相比,干旱胁迫条件下叶片最大净光合速率和光饱和点降低(P<0.01),H1352和81GM26品种在干旱胁迫条件下最大净光合速率分别为24.8和21.0 μmol/(m2·s),分别比对照低18%和26%;光补偿点分别为600和601 μmol/(m2·s),分别比对照低18.5%和16.4%,且处理间差异达显著水平,说明干旱胁迫条件下甜菜叶片光合生产能力和对强光利用效率降低,不利于光合物质积累。不同处理条件下甜菜品种叶片暗呼吸速率不同,H1352品种在干旱胁迫条件下叶片暗呼吸速率降低,比对照降低40.3%,处理间差异达极显著水平,可能是植株通过降低叶片呼吸消耗能力来维持碳的平衡[24],从而减轻干旱胁迫对其产生的影响,而81GM26品种干旱胁迫下叶片暗呼吸速率只有略微下降,处理间没有显著差异。低LCP和高LSP的植株,对光的生态适应性强[25]。试验结果显示,干旱胁迫条件下,H1352和81GM26LCP至LSP对应的光强范围分别在60.9~599.7和88.5~600.7 μmol/(m2·s),低于对照处理对应的光强范围,表明叶片干旱胁迫后,叶片光适应范围变窄,光能利用能力降低,耐旱型品种H1352光合能力下降幅度低于旱敏感型81GM26。
4 结 论
不同水分处理条件下,H1352和81GM26甜菜品种块根膨大期叶片Pn均随着PAR的增大的变化趋势基本一致;干旱胁迫条件下甜菜叶片最大净光合速率和光饱和点(P<0.01)降低,且处理间差异达极显著水平; H1352品种在干旱胁迫条件下叶片暗呼吸速率降低,比对照降低40.3%,且处理间差异达极显著水平,而81GM26品种处理间没有显著差异;干旱胁迫条件下叶片光适应范围变窄,光能利用能力降低,对强光利用效率降低,不利于光合物质积累。

