血清PTX3和Gal-3在高血压合并冠状动脉粥样硬化性心脏病患者中的水平变化及其临床意义*
何 杰,戴亨华,杜 令,赵 倩
(重钢总医院心血管内科,重庆 400081)
高血压是临床上十分常见的心血管疾病,主要以体循环动脉血压升高为主要表现,而长期持续性的高血压容易造成血流动力学紊乱,激活血液中的血小板,导致心肌功能、结构发生改变,是诱发动脉粥样硬化的重要危险因素[1]。相关数据显示,收缩压(SBP)每升高10 mm Hg,继发心肌梗死的风险就增加31%,在60%~70%的冠状动脉粥样硬化性心脏病(CHD)患者中有合并高血压的现象,而高血压患者发生CHD的概率是血压正常者的3~4倍[2]。目前对于高血压和CHD之间的确切机制仍未得到明确阐明,但近年来的大量研究表明,血管炎症在此过程中发挥着重要作用,炎性因子的大量释放可能是连接高血压和CHD的重要桥梁[3-4]。五聚素3(PTX3)是一种和C反应蛋白(CRP)同家族的炎性反应蛋白,主要产生于心肌和血管损伤组织。半乳糖凝集素3(Gal-3)本身也是类促炎因子,在心肌损害过程中有重要作用。因此,本研究通过探讨血清PTX3、Gal-3的浓度在高血压合并CHD患者中的浓度变化及临床意义,旨在进一步了解高血压和CHD之间的关系,现报道如下。
1 资料与方法
1.1一般资料 选择本院2017年2月至2019年2月所接诊的60例单纯高血压、60例高血压合并CHD患者作为研究对象。高血压诊断标准参照《中国高血压基层管理指南(2014年修订版)》[5]:在未使用降压药物的情况下,非同日三次检测结果显示SBP≥140 mm Hg和(或)舒张压(DBP)≥90 mm Hg。CHD诊断标准参照《实用内科学》[6]:经冠状动脉造影检查结果显示至少有≥1支的主要冠状动脉血管狭窄程度≥50%。排除标准:(1)继发性高血压;(2)近2周内接受过规律降压治疗,或服用过他汀类药物、阿司匹林等;(3)既往实施过冠状血运重建治疗或心脏手术;(4)近3个月内有重大外伤、手术、输血史;(5)合并周围血管疾病、血管栓塞性疾病等;(6)合并先天性心脏病,或由于其余心肌损伤疾病所致的心脏结构改变;(7)甲状腺功能异常;(8)合并消化系统疾病、恶性肿瘤、急慢性感染、严重肝肾疾病等;(9)精神异常。并选择同期于本院接受体检的健康人员50例作为对照组,该组患者经血压、血糖、血脂、心电图、血尿常规、肝肾功能检查均正常,上述所有研究者均签署本研究知情同意书。
1.2方法 记录所有研究者入组后血压情况,并采集第2天清晨空腹静脉血,采集剂量8 mL,置于离心管中,使用3 500 r/min的速度离心15 min后提取上层血清液储存于-80 ℃的冷冻箱中准备检测,使用瑞士罗氏公司生产的全自动生化分析仪ROCHE Modular DPP型检测血脂指标,包括三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C),并使用上海卡舒迈生物科技有限公司生产的酶联免疫吸附测定(ELISA)试剂盒检测血清PTX3、Gal-3水平。
冠状动脉造影检查:选择经验丰富的医师对高血压合并CHD患者实施冠状动脉造影检查,根据主要冠状动脉(左主干、回旋支、前降支、右冠状动脉)、主要分支(例如钝缘支、对角支)的狭窄情况进行病变支数的判定,结果分为多支病变组、双支病变组、单支病变组,对于左主干累及的患者,无论是否有回旋支、前降支狭窄情况,均纳入双支病变组。
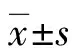
2 结 果
2.1三组临床资料比较 三组性别、年龄比较差异无统计学意义(P>0.05);高血压合并CHD组、单纯高血压组SBP、DBP、TG、TC、LDL-C均明显高于对照组,HDL-C明显低于对照组(P<0.05);高血压合并CHD组、单纯高血压组SBP、DBP、TG比较,差异无统计学意义(P>0.05);高血压合并CHD组高血压病程、TC、LDL-C明显长于或高于单纯高血压组,HDL-C明显低于单纯高血压组(P<0.05)。见表1。
2.2三组血清PTX3、Gal-3水平比较 三组血清PTX3、Gal-3水平比较,差异有统计学意义(P<0.05),高血压合并CHD组血清PTX3、Gal-3水平均明显高于单纯高血压组和对照组,单纯高血压组血清PTX3、Gal-3水平高于对照组(P<0.05),见图1、表2。
2.3不同病变支数高血压合并CHD患者血清PTX3、Gal-3水平的比较 经检查显示,单支病变12例,双支病变28例,多支病变20例,不同病变支数高血压合并CHD患者血清PTX3、Gal-3水平比较,差异有统计学意义(P<0.05),多支病变组血清PTX3、Gal-3水平明显高于双支病变、单支病变组,双支病变血清PTX3、Gal-3水平明显高于单支病变组(P<0.05),见图2、表3。
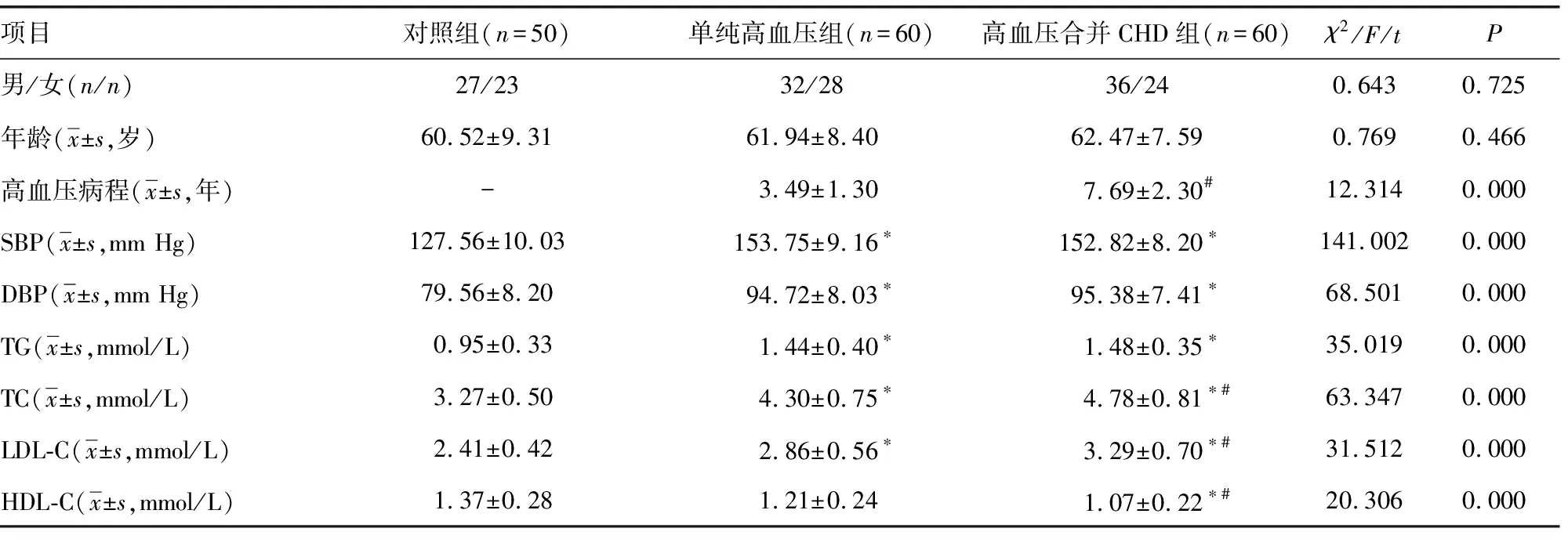
表1 三组临床资料比较
注:与对照组比较,*P<0.05;与单纯高血压组比较,#P<0.05;-表示该项无数据。

图1 三组血清PTX3、Gal-3的浓度比较
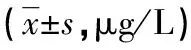
表2 三组间血清PTX3、Gal-3水平的比较
注:与对照组比较,*P<0.05;与单纯高血压组比较,#P<0.05。

图2 不同病变支数高血压合并CHD患者的血清PTX3、Gal-3水平比较
2.4高血压患者发生CHD的多因素logistic回归分析 将高血压病程,TC、LDL-C、HDL-C、PTX3、Gal-3纳入多因素logistic回归模型中,结果显示高血压病程、TC、LDL-C、PTX3、Gal-3水平与CHD的发生风险呈正相关,与HDL-C呈负相关(P<0.05),见表4。
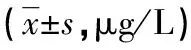
表3 不同病变支数高血压合并CHD患者血清PTX3、Gal-3水平的比较
注:与单支病变组比较,*P<0.05;与双支病变组比较,#P<0.05。

表4 高血压患者发生CHD的多因素logistic回归分析
3 讨 论
高血压是一种常见的慢性非传染性疾病,目前认为该病是由于遗传、环境、饮食等多因素共同所致的结果,而长期的血压升高,可直接加重心肌负荷,导致CHD的发生,在高血压和CHD的发生、发展过程中,血管炎症是一种十分重要且具有共性的病理特征,高血压作为CHD的重要危险因素,在高血压发病早期,机体便启动炎症状态,大量炎症细胞在血管壁聚集及释放,促进血管平滑肌增生,降低血管弹性,随着疾病进展可进一步增加心肌负荷,导致动脉粥样硬化[7]。并有较多研究证实,积极的抗感染治疗在降低高血压继发心血管疾病中有关键作用[8-9]。
PTX3是近年来新发现的一类促炎因子,CRP、血清淀粉样蛋白A(SAA)属短链五聚体蛋白,而PTX3属于长链五聚体蛋白,其可在炎性因子的诱导下,由血管内皮细胞所分泌,并刺激单核细胞、内皮细胞组织因子水平的增加[10]。有研究显示,PTX3主要来源于巨噬细胞、单核细胞、中性粒细胞,并推测其表达可直接了解血管炎性反应和斑块易损性[11]。杨雁华等[12]实验也指出,在血管紧张素Ⅱ(AngⅡ)的持续刺激下,PTX3的表达可逐渐升高,而通过下调PTX3的表达可削弱AngⅡ所致的血管内皮细胞损伤,减少血管活性物质的分泌,
Gal-3属半乳糖凝集素家族成员,广泛表达于巨噬细胞、中性粒细胞、嗜酸粒细胞、肥大细胞中,而这些细胞在心肌损害过程中起着重要作用,尤其是在心肌纤维化过程中起关键作用[13]。蔡皇娥等[14]的研究显示,在高血压后期纤维化和肥大的小鼠心肌组织中,Gal-3的表达明显升高,并认为可以使用Gal-3抑制剂干预自发性高血压大鼠心肌纤维化过程。且有研究显示,Gal-3可用于评价老年急性心力衰竭的严重程度及预后[15]。
本研究显示,在高血压患者中血清PTX3、Gal-3的水平明显升高,高血压合并CHD患者血清PTX3、Gal-3的水平比高血压患者高,且随着CHD病变支数的增加,血清PTX3、Gal-3的水平也有明显增加趋势。可能是由于长期的高血压加重了血管炎性介质的解放,诱导单核细胞进入血管壁转化成为巨噬细胞,刺激血清PTX3、Gal-3水平的增加,并随着疾病进展,逐渐加重局部血管壁的动脉粥样硬化,形成CHD。本研究通过多因素logistic回归模型分析显示,除高血压病程、TC、LDL-C、HDL-C之外,血清PTX3、Gal-3的水平也是高血压患者发生CHD的危险因素,提示血清PTX3、Gal-3的水平在评价高血压CHD发生风险方面有一定作用。但本研究也有一定不足,对于血清PTX3、Gal-3水平在判断高血压合并CHD病情上的特异性方面仍需进一步研究。
4 结 论
血清PTX3、Gal-3的水平在高血压合并CHD患者中明显上升,且随着CHD病变支数的增加而升高,可通过加重血管炎症的途径,进一步增加心肌损伤程度,本研究也为临床防治高血压合并CHD提供了新思路。

