甲烷蒸汽重整制氢反应路径研究
贺天智, 蔡 磊, 管延文, 刘文斌
(华中科技大学环境科学与工程学院,湖北武汉430074)
1 概述
随着社会的不断发展,人类面临的环境危机和能源危机日益加剧,寻找清洁能源的任务已经迫在眉睫[1]。氢气是清洁能源,其能量密度大,热值高[2],被誉为本世纪最具有发展潜力的清洁能源之一[2-3]。德国于20世纪末在慕尼黑机场建成了世界首座加氢站;日本在大力开发应用氢能方面一直处于领先地位,仅在2016年就新增了45座加氢站;2017年3月7日,美国空气产品公司(Air Products)宣布,公司旗下的美国加州氢气定价为9.99美元/kg,这是燃料电池汽车氢能源供应走向低价格的一个里程碑,进一步加快了氢气利用开发和燃料电池汽车的商业化步伐[3];另外,根据欧盟委员会的氢能方案,世界范围内更大规模的氢气生产将于2030年后开始[4]。在国内,自2017年以来,各地政府积极规划氢能及燃料电池产业布局,北京、上海、佛山、武汉、山东、安徽等地的氢能和燃料电池相关规划、补贴政策陆续出台,氢能产业呈现蓬勃发展景象[5]。
大力发展氢能需要稳定的氢源和成熟的制氢技术[1]。从全球范围来看,世界各国生产的氢气,将近50%是由天然气转化而来[4,6];在国内,随着西气东输和海气登陆,我国已经进入大规模开发利用天然气阶段,天然气管网已经四通八达。天然气作为一种重要的制氢原料[7],其主要成分为甲烷,由甲烷制氢途径有多种。其中,甲烷蒸汽重整制氢技术发展较为成熟,工业应用较为广泛[7-8]。许多研究者对甲烷蒸汽重整制氢技术作了大量的研究。Pashchenko[4]探究了重整管内温度和各组分的浓度分布,不同温度下甲烷转化率和氢气产率,以及不同流速下管内的压力降。Lao等人[9]模拟了重整管内温度场和各组分浓度场,并且从自动控制角度给出了反馈控制方案来应对外界条件的干扰和改善闭环动力学,从而对氢气的生产进行优化。Pajak等人[10]在考虑组分传输和反应动力学的基础上建立了重整管的数学模型,得到了与实验数据相匹配的出口组分浓度。Hoang等人[11]通过做实验研究了甲烷蒸汽重整反应的动力学,得出了重整温度和水碳比对实验影响较大的结论,并给出了合适的温度和水碳比范围,同时建立了二维重整管模型。综上所述,目前的研究集中在重整条件对温度场、各组分浓度场、氢气产率和甲烷转化率的影响,有关甲烷蒸汽重整反应路径等研究得较少。研究甲烷蒸汽重整的反应路径可以寻找其反应规律,探寻甲烷蒸汽重整反应的本质,分析氢气生成过程中重要的中间产物、基元反应和路径。同时利用对反应机理的掌握,可指导提高实际生产的选择性,从而获得较高的氢气产率。
通过实验来获得某些化学反应的规律非常困难,采用数值计算的方法可以详细考虑物理和化学现象,为实验提供指导,为设计和生产提供参考,从而节省人力、物力和时间[12]。Pashchenko[13]建立了重整管模型,利用Ansys Fluent模拟计算了管内的压力降,并匹配了实验结果。Ngo等人[14]通过CFD建立了重整器模型,得到了管内温度场和组分浓度场,与实验数据取得了良好的匹配。Latham等人[15]采用数值计算的方法建立了重整管数学模型,通过向模型输入原料气体的参数来预测管内外壁的温度分布以及管内组分的浓度分布。上述研究表明通过数值计算的方法来研究甲烷蒸汽重整反应是可行的。
本文采用CFD方法建立了合理的重整管模型,研究了甲烷蒸汽重整反应过程中重要中间产物的分布规律,分析得到由甲烷转化为氢气的反应路径,并探究了温度对基元反应速率和氢气生成路径的影响。
2 重整管模型构建与验证
① 模型构建
依据林德工程北美公司(Linde Engineering North America Inc.)所生产的重整管建立物理模型。该公司生产的工业顶烧式平行流重整炉见图1[16]6-8,内部共有336根重整管(内部均匀分为7排,每排48根重整管),每根重整管的内直径、外直径、长度分别为12.6 cm、14.6 cm、12.5 m。燃料气和助燃气体在一定条件下[9]从顶部的喷嘴进入,在管外空间燃烧,将热量传递给重整管壁,从底部的废气道排出。经过预处理后的天然气和水蒸气按照一定比例混合,进行预热后在2 994 kPa,614 ℃条件下从顶部通入重整管[16]239-242,充分反应后从另一侧出去。进口气体组成见表1。在理想的操作条件下,重整炉内每一根重整管所处的环境极为相似,它们的受热状况也极其接近。因此,以其中一根重整管为研究对象可以代表336根重整管的特性[9]。
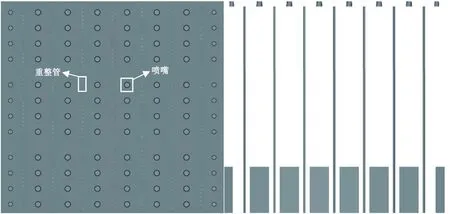
a.俯视图 b.主视图图1 工业顶烧式平行流重整炉结构图[16]6-8
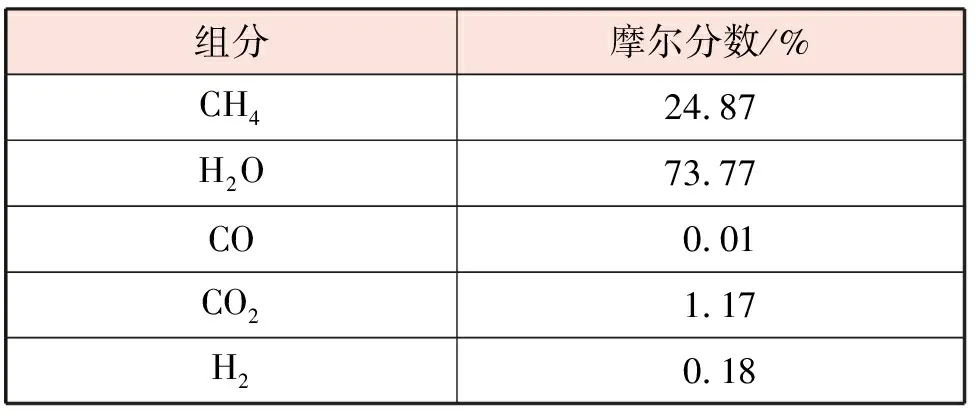
表1 进口气体组成[9]
本研究使用的重整管,其壁面温度通常处于1 100~1 178 K范围内[9],而并非恒定值。重整管实际壁温满足四次多项式分布[9],见式1。因此,本文通过编写UDF来构建更为准确的壁面温度分布。
Twall=-0.022 1L4+0.800 3L3-10.734L2+
64.416L+997.16
(1)
式中Twall——重整管壁面某点温度,K
L——壁面该点沿轴线方向距离进口的长度(轴向距离),m
本文利用CFD建立了二维轴对称的单管模型,重整管局部模型网格见图2。

图2 重整管局部模型网格
重整管进口为mass-flow inlet,出口为outflow;管壁厚度处理为薄墙模型[17];考虑到standardk-ε广泛的工程应用以及良好的收敛性和精确性[18],湍流模型使用standardk-ε;鉴于高温下气体反应的辐射特性,本研究选择能够考虑散射和气体与颗粒之间辐射换热影响的DO模型,其精度高且适用于任何场合[19];选择EDC模型从而考虑详细的化学反应机理和中间产物的分布[12];同时,本文使用FFCM机理文件来研究甲烷蒸汽重整的反应机理。FFCM包含38种组分和291个基元反应。
本文涉及的主要基元反应如下(括号前面为反应编号,括号内为基元反应,后文中涉及该基元反应时,只出现反应编号):


















在目前的实际工业生产中,普遍使用镍基催化剂来降低反应的活化能,提高反应速率。无论是采用干重整还是蒸汽重整的方式,甲烷中C-H键的断裂是整个过程中非常重要的步骤[20-23],整个反应的动力学特征与其息息相关,而与其他反应物的关系并不大[24-26]。甲烷的一级脱氢作为其第一步分解反应格外重要,它将关系到脱氢的连续性和后续其他基元反应的速率[20-21,26]。因此,甲烷的分解反应是目前催化领域和化工生产中至关重要的步骤。基于此,本文对甲烷脱氢反应R97的动力学参数作出一定调整[27],以匹配实验数据。调整后甲烷脱氢反应动力学参数见表2。
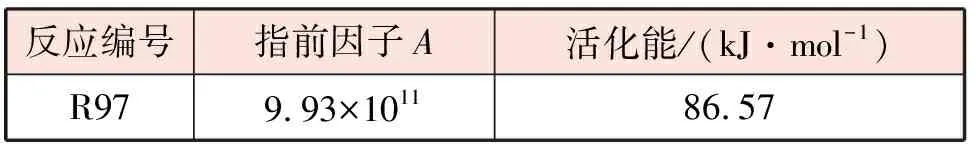
表2 调整后甲烷脱氢反应动力学参数[27]
当混合气体流经多孔催化剂床时,会出现压力的损失,产生压力降。为了模拟实际生产中的压力降,本文通过设置多孔区域,采用半经验欧根方程来定义多孔介质的流动阻力。模型进口气体组成参见表1,进口气体温度为614 ℃,进口气体压力为2 944 kPa[16]241。
② 模型验证
利用CFD软件进行模拟,取出口处各参数的面积加权平均值为依据,模拟结果与实验数据[16]242的比较见表3。各参数的相对误差均在允许范围内。其中,产物中氢气的摩尔分数模拟结果与实验数据的相对误差为-1.32% ,因此,本研究所使用的模型合理可靠,可以用于甲烷蒸汽重整反应路径的研究。

表3 模拟结果与实验数据的比较
3 模拟结果分析
3.1 反应路径分析
本文以进口气体温度614 ℃,进口气体压力2 944 kPa,进口水碳比(进口气体中水蒸气与甲烷摩尔分数的比值)2.97为基准工况进行模拟,气体组成如表1所示。反应过程涉及291个基元反应,其中主要基元反应的反应速率见图3(图中“×(-1)”表示反应速率为负),这些基元反应构成了生成氢气的主要路径。本研究根据基元反应速率大小及其涉及到的基团或物质,分析由CH4生成H2的主要反应路径。在甲烷蒸汽重整制氢反应中,原料气甲烷(CH4)通过R97脱氢裂解为甲基(CH3),CH3通过R112合成乙烷(C2H6), C2H6将发生一系列的脱氢反应如R258、 R250、 R239等,生成中间产物C2H5、C2H4、C2H3等,每一步的脱氢反应都将伴随着H2的生成。
这些反应路径有:
CH4→H2
CH4→CH3→C2H6→H2
CH4→CH3→C2H6→C2H5→H2
CH4→CH3→C2H6→C2H5→C2H4→H2
CH4→CH3→C2H6→C2H5→C2H4→C2H3→H2
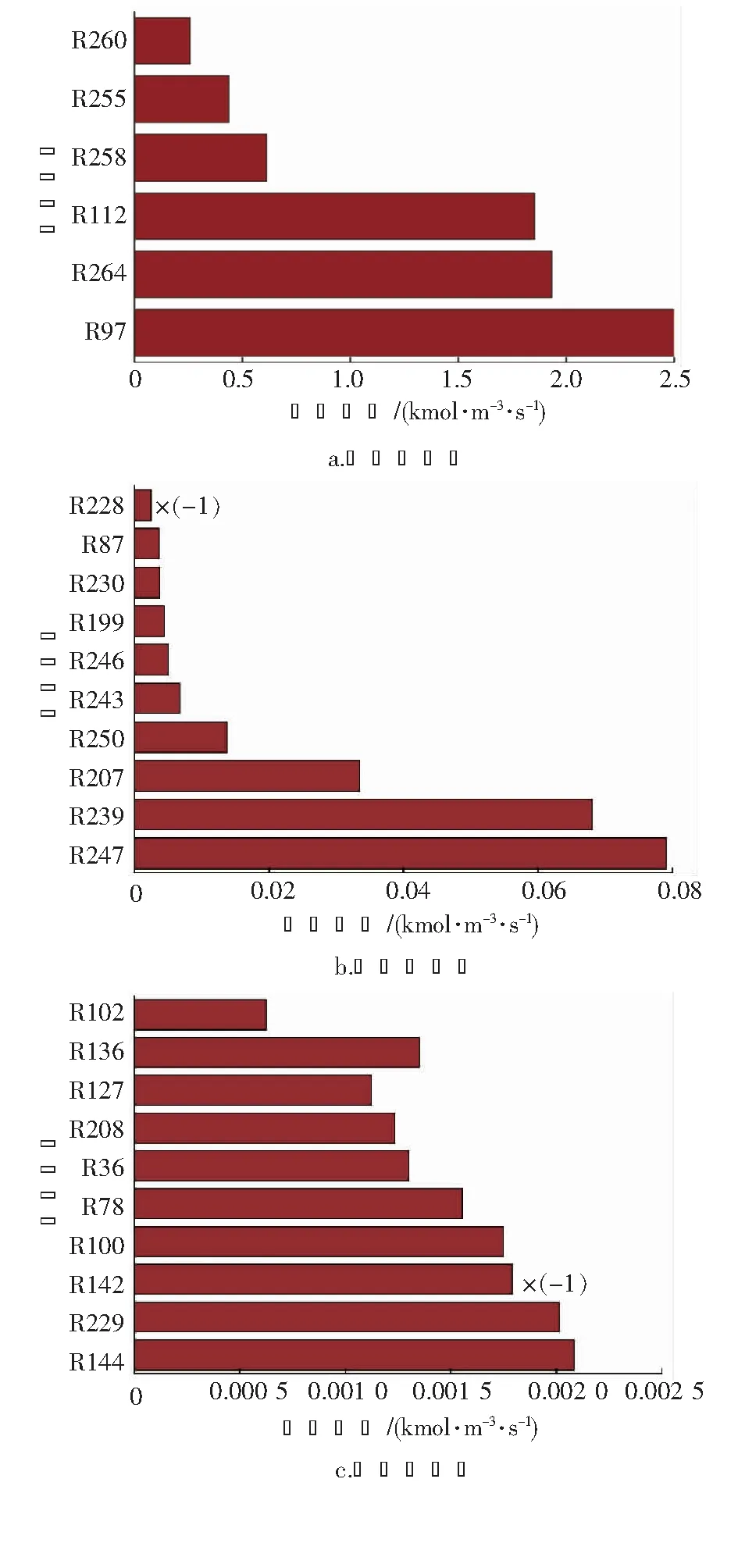
图3 主要基元反应的反应速率
同时,CH3可以与羟基(OH)通过R100反应生成甲醇(CH3OH),亦可通过R102进一步脱氢裂解为亚甲基(CH2),CH2经过R78生成CH3OH。CH3OH后进行脱氢反应如R144、R127、R87生成中间组分CH2OH、CH2O、HCO,每一步的脱氢都伴随着氢气的生成。其中,HCO基团可与CH3发生反应R228(速率为负)生成CH3CHO,CH3CHO通过R230、R229发生脱氢反应生成CH3CO、CH2CHO和H2。反应路径有:
CH4→CH3→CH3OH→H2
CH4→CH3→CH2→CH3OH→H2
CH4→CH3→CH3OH→CH2OH→CH2O→H2
CH4→CH3→CH2→CH3OH→CH2OH→
CH2O→H2
CH4→CH3→CH3OH→CH2OH→CH2O→
HCO→H2
CH4→CH3→CH2→CH3OH→CH2OH→
CH2O→HCO→H2
CH4→CH3→CH3OH→CH2OH→CH2O→
HCO→CH3CHO→H2
CH4→CH3→CH2→CH3OH→CH2OH→
CH2O→HCO→CH3CHO→H2
CH4→CH3→C2H6→C2H5→C2H4→
CH3CHO→H2
详细氢气生成路径见图4。图例表示反应速率量级,“-H”代表某物质脱去了一个H,“-CO”代表某物质脱去了一个CO,“H”代表某物质与H发生反应。本图中,反应编号均写在线的左方或上方;反应所涉及到的基团均写在了线的右方或下方。其中,标记为绿色的为温度升高时速率减小的路径,将在3.2中详细阐述。速率量级大于10-3的反应路径主要可以分为两类,一类是涉及到轻烃和烃基之间反应的路径,主要集中在路径图的右侧;另一类为主要涉及到烃基与羟基之间反应生成醇类基团或者物质的路径,集中在路径图的左侧。除了这些量级大于10-3的反应路径外,还有若干条其他的反应路径,例如:
CH4→CH3→H2
CH4→CH3→CH2→H2
CH4→CH3→C2H6→C2H5→C2H4→
CH3CHO→CH2CHO→CH3CO→CH2CO→
HCOO→CH2→H2
在H2的生成过程中,除了反应物甲烷与蒸汽之外,中间产物CH3、CH3OH同样扮演重要角色,对氢气的生成起着非常重要的作用。图5为CH3和CH3OH沿轴线方向的摩尔分数分布。
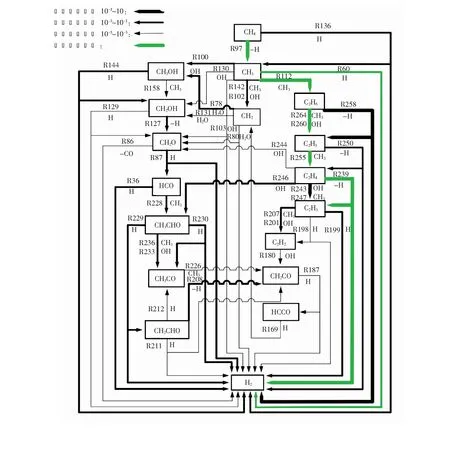
图4 氢气生成路径
如图5所示,CH3和CH3OH沿轴向的摩尔分数并不是简单的单调递变,而是先升高后降低的过程。CH3的摩尔分数从接近重整管进口处开始逐渐升高,在距离进口8 m左右处达到最大值,其摩尔分数最大值位于0.011 5%附近,超过8 m后其摩尔分数又逐渐降低;同样,CH3OH的摩尔分数沿轴向先升高后降低,在距离进口5 m附近摩尔分数达到最大值,最大值位于0.001 25%附近。
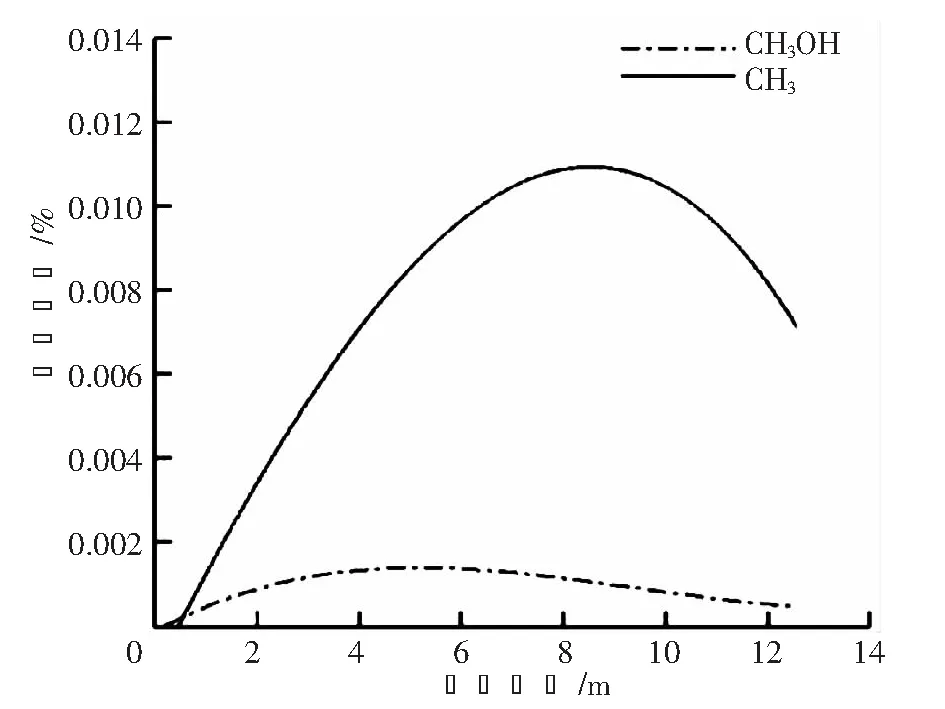
图5 CH3和CH3OH沿轴线方向的摩尔分数分布
为了进一步探究CH3和CH3OH沿轴向摩尔分数先上升后下降的原因,本文绘制了两种中间产物沿轴线方向的净反应速率分布图,分别见图6、7。由图6可以看出,开始时,CH3的净反应速率始终为正,在距离进口8 m左右时,CH3的净反应速率曲线出现了零点,此后为负值,直到出口处净反应速率持续为负。以上结果表明,自进口开始,随着重整反应的进行,大量的甲烷裂解为CH3,使得CH3的摩尔分数逐渐上升。从净反应速率来看,自8 m处至出口CH3处于消耗状态。对应图5,8 m左右处CH3摩尔分数达到了最大值,此后直到出口处,其摩尔分数逐渐降低。同理,由图7可以看出,CH3OH的净反应速率在距离进口5 m左右处出现了零点,距离进口小于5 m时净反应速率为正,CH3OH处于生成状态;5 m之后净反应速率为负,CH3OH处于消耗状态。对应图5,从接近进口处开始CH3OH逐渐增加,5 m左右处达到最大值,此后开始逐渐降低。
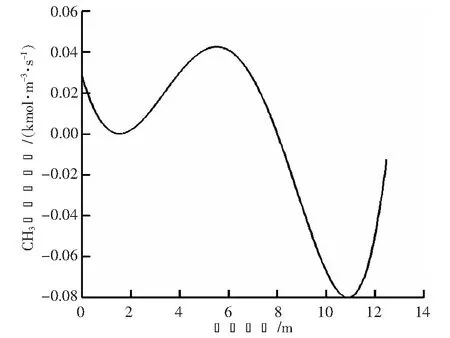
图6 CH3净反应速率分布

图7 CH3OH净反应速率分布
3.2 温度对反应路径的影响
在甲烷蒸汽重整制氢反应中,温度是非常重要的因素。它影响着重整管内的组分分布、H2的生成以及各种物质的反应速率,甚至影响着重整管的经济性和使用寿命。压力为3 MPa,水碳比为3.00时,在进口气体温度分别为600 ℃、700 ℃、800 ℃、900 ℃、1 000 ℃下进行模拟,分析温度对反应路径的影响。温度对重整管出口H2摩尔分数和CH4转化率的影响见图8。

图8 温度对H2摩尔分数和CH4转化率的影响
由图8可以看出,当温度从600 ℃提高到1 000 ℃,出口氢气的摩尔分数(产率)从44.91%升高到了50.21%, 甲烷的转化率相应地由79.9%升高到89.7%。氢气的产率变化实际上是由于温度改变了基元反应速率。一些基元反应速率增加,使得这些基元反应所构成的产氢路径得以增强;一些基元反应速率减小,削弱了对应的反应路径强度。为了进一步探究温度对反应速率的影响,分析基元反应速率变化情况,给出氢气生成过程中起主导作用的基元反应反应速率随温度的变化趋势,见图9。
随着温度的逐渐升高,基元反应R97(图9a)、R112(图9a)反应速率的增大促进了CH3合成C2H6的过程;R136(图9f)的增大使得CH4→H2路径增强;C2H6逐步脱氢所涉及到的R258(图9a)、R260(图9b)、R250(图9c)、R247(图9b)、R239(图9b)等反应速率的增大使更多的氢气通过CH4→CH3→C2H6→H2, CH4→CH3→C2H6→C2H5→H2, CH4→CH3→C2H6→C2H5→C2H4→H2等路径生成。如图9e,R100(图9e)的增大促进了CH3OH的生成;R144(图9d)、R127(图9f)、R87(图9d)、R36(图9e)等反应的反应速率均随温度增加而不同程度地升高,进一步推动CH3OH的脱氢过程,路径CH4→CH3→CH3OH→H2,CH4→CH3→CH3OH→CH2OH→CH2O→HCO→H2等路径增强。
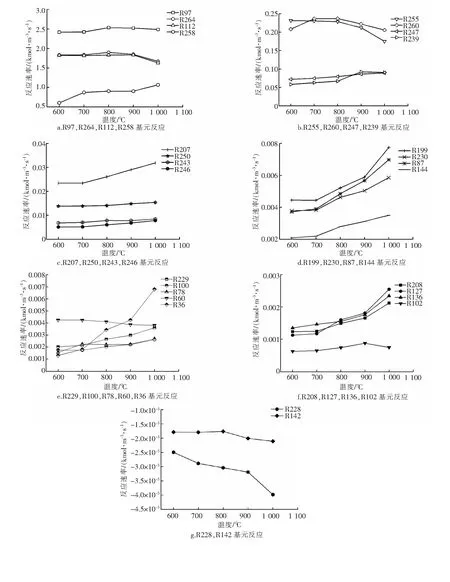
图9 重要基元反应反应速率随温度的变化
当温度超过800 ℃,虽然氢气的产率和甲烷的转化率依旧在增加,但是一些反应的反应速率已经开始发生轻微的减小,如图9a、9b中R97、R264、R260、R255反应。当温度超过900 ℃后,更多反应 R112(图9a), R239(图9b),R102(图9f), R60(图9e)的速率开始减小。R60反应速率的减小限制了CH3脱氢生成氢气的路径;R112速率的显著减小将会使CH3合成C2H6的过程受到抑制,C2H6摩尔分数的降低一定程度上限制了其所参与的部分脱氢反应,如R255,R239,从而使CH4→CH3→C2H6→C2H5→C2H4→H2等路径相对减弱。R136反应速率随温度升高持续增加,路径CH4→H2依旧增强,CH4亦可通过R136生成CH3。CH3与OH合成CH3OH的反应R100以及CH3OH逐步脱氢所涉及的反应R144、R127、R87、R36等随温度升高持续增强,促使更多的氢气通过如下路径生成:
CH4→H2
CH4→CH3→CH3OH→H2
CH4→CH3→CH3OH→CH2OH→CH2O→H2
CH4→CH3→CH3OH→CH2OH→CH2O→
HCO→H2
分析得到,温度升高时R112等基元反应的速率先升高后降低,C2H6的合成及其逐步脱氢反应将受到一定程度的限制,更多的氢气将由CH4直接脱氢和CH3OH逐步脱氢生成。图4标记了温度升高时明显减弱的路径。
4 结论
利用CFD建立了合理的重整管模型,在进口气体614 ℃、2 944 kPa,水碳比为2.97的实验条件下进行甲烷蒸汽重整制氢的模拟计算,分析得到了由CH4生成H2的反应路径,研究了进口气体温度对反应路径的影响。研究结果表明:
① 在甲烷蒸汽重整制氢反应中,CH4首先裂解为CH3,CH3合成C2H6,C2H6通过逐步的脱氢反应生成氢气;或者CH3转化为CH3OH,CH3OH发生一系列的脱氢反应生成氢气。从净反应速率来看,反应的重要中间产物CH3和CH3OH沿重整管轴线方向先生成后消耗,故其摩尔分数沿轴线方向先升高后降低。
② 进口气体温度从600 ℃升高到1 000 ℃,氢气的产率从44.91%提高至50.21%。温度超过900 ℃时,基元反应 R60和R112速率的显著减小使CH3脱氢及其转化为C2H6的过程受到阻碍,R100速率依旧增大使得更多的CH3转化为CH3OH;C2H6所参与的部分脱氢反应路径强度减小,更多的氢气通过CH4直接脱氢和CH3OH逐步脱氢生成。

