不同种类茶叶冲泡前后中红外光谱变化探析
许 娜 陈 玲 马玉涵 刘 超 董荣荣 姜 浩
(1安徽农业大学茶与食品科技学院/茶树生物学与资源利用国家重点实验室,安徽 合肥 230036;2 安徽科技学院生命与健康科学学院,安徽 凤阳 233100)
茶叶为山茶科山茶属植物茶[Camellia sinensis(L.) O.Kuntze]的干燥嫩叶,具有重要的经济、药理和文化属性。茶叶起源于中国,在我国被誉为“国饮”,有着悠久的种植和饮用历史[1]。全世界有58个国家和地区种茶,有30亿人口饮茶,茶叶已成为位居世界三大非酒精饮品之首。茶叶按照发酵工艺可分为非发酵茶、半发酵茶、发酵茶和后发酵茶四大类;按照加工工艺和产品特性则分为绿茶、白茶、黄茶、乌龙茶、红茶和黑茶六大类[2]。化学成分是评价茶叶特性的物质基础,其各成分间的比例是茶叶感官品质的具体表征[3]。不同的茶树品种、生长环境和加工工艺均会对茶叶品质及其化合物组成[4]产生影响。茶叶的品质不仅影响其经济价值,也决定其药理功能[5]。茶叶含有的典型功能活性成分包括茶多酚、茶多糖、生物碱等,这些组分构成“复方药剂”[6],综合决定了茶叶的降血糖、调控血脂、改善糖尿病和心脑血管疾病以及预防癌症的功效[7]。
茶叶质量安全准入制度的实施,对其品质鉴定和检测提出了更高的要求。茶叶化学成分的定性/定量分析常用的检测方法虽详实有效,但也存在一定局限性。例如采用分光光度法测定茶多糖、茶多酚含量,茶水本身颜色也会对检测结果有一定影响;采用高效液相色谱法(high performance liquid chromatography,HPLC)测定儿茶素类含量,对实验室硬件和操作人员技能要求较高[8];较多文献也报道了各种成品茶叶中多酚和嘌呤碱含量的分析方法,但这些方法通常较复杂[9-10]。上述常规检测方法均属于化学分析法,需要对样本进行预处理,虽然分析精度高,但分析过程复杂,耗时费力,技术要求和检测成本高,且易造成环境污染。因此,寻找一种能用于茶叶市场中常规、快速、简便的检测分析方法,符合市场迫切需求,具有重要的社会价值和经济价值。
傅里叶变换中红外光谱(fourier transform infrared spectroscopy,FTIR)技术基于样本分子的吸收频率,从而对物质分子基团、化学键等化学特性进行分析,此方法具有样本前处理操作简单,分析速度快,环境友好等优点,已被广泛应用到食品质量检测中,在茶叶质量评估、掺假检测领域的研究也逐渐增多[11-13],也被用于茶叶的产地检测[14]。随着茶叶市场中茶饮料、冷泡茶、速溶茶粉等产品的大量涌现,而有关茶汤化学品质分析、茶汤与茶叶化学成分比较的相关研究较缺乏。因此本研究首先基于不同茶类FTIR 光谱差异,评价不同茶类主要化学成分差异,并对不同茶类进行聚类分析,为判断样品光谱特征性区间和峰位指明方向;同时基于茶叶与其对应茶汤的FTIR 光谱分析,探讨茶叶冲泡前后主要化学成分的溶出率差异,及茶叶种类对各茶叶小分子化合物溶出的影响,旨在为市场中茶叶、速溶茶粉等产品化学品质鉴别及色泽品评提供一定的依据。
1 材料与方法
1.1 材料与试剂
7个供试茶样购于2015年,全部为合肥市场市售茶叶,分别是黄山毛峰(绿茶,安徽)、安吉白茶(绿茶,安徽)、白牡丹(白茶,福建)、抱儿钟秀(黄大茶,安徽)、亨大兰花(黄大茶,安徽)、天方安茶(黑茶,安徽)、祁门红茶(红茶,安徽)。
10个标准品(峰面积归一化法下纯度均大于98%):没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)、表儿茶素(epecatechin,EC)、儿茶素(catechin,C)、咖啡碱(caffeine,CAFF)和可可碱(theobromine,THB)购于合肥一力生物公司;表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表儿茶素没食子酸酯(epicatechin gallate,ECG)、没食子酸(gallic acid,GA)、没食子酸儿茶素(gallocatechin,GC)和表没食子儿茶素(epigallocatechin,EGC)购于西安玉泉生物公司。乙腈和甲醇均为色谱纯,购于美国Tedia 公司;其余试剂均为分析纯,购于国药集团。
1.2 茶汤冻干粉的制备
取茶叶100 g 粉碎,按1∶30 固液比添加煮沸蒸馏水,70℃保持15 min,8 000 r·min-1离心10 min 收集上清茶汤,-40℃冻结并真空冷冻干燥(升华干燥参数:冷阱温度-45℃、真空度60 Pa),制得干粉备用[15]。7种茶样的茶汤冻干粉得率分别为:黄山毛峰(24.3%)、安吉白茶(24.8%)、白牡丹(24.1%)、抱儿钟秀(22.7%)、亨大兰花(23.6%)、天方安茶(16.4%)、祁门红茶(24.9%)。
1.3 茶叶和茶汤浸提物的FTIR 光谱采集及曲线拟合
样品干粉过200目筛,精确称取2.0 mg,加0.2 g光谱纯干燥KBr 晶体,红外灯烘烤下于玛瑙研钵中研磨至细粉状,置于模具中。抽气加压20 MPa,维持3 min,成半透明锭片,于20℃条件下进行FTIR 扫描(MPA,德国Bruker)。扫描范围4 000~400 cm-1,扫描32 次,分辨率4 cm-1。同一样品随机测定3 次,取平均值,并对获得的光谱进行归一化处理,以消除每次压片厚度不同对光谱的影响[16]。利用Omnic 8.0软件进行后续分析,用光谱分析拟合软件Peakfit 4.0对测定样品光谱曲线进行拟合,baseline 选择linear D2,Peak Type 选择Gauss Amp[17]。
1.4 样品茶多糖、可溶性总糖、总茶多酚、总游离氨基酸、儿茶素类和生物碱类物质含量测定
采用蒽酮-硫酸法测定样品茶多糖和可溶性总糖含量[18-19];福林酚比色法测定样品总茶多酚含量[8],所有样品独立测定6 次。样品中游离氨基酸的测定采用L-8900 全自动氨基酸分析仪(日本Hitachi),该方法可鉴定出38种氨基酸及其衍生物。制样步骤:取0.2 g 样品,加10 mL 100℃水浸提5 min,取浸提液0.5 mL,加4%磺基水杨酸酸解,12 000 r·min-1离心20 min,取上清过0.22 μm 水相膜,20 μL 进样测定。所有样品独立测定3 次,依据标准曲线的浓度计算样品中各种氨基酸含量,样品中总游离氨基酸含量记为所有38种氨基酸及其衍生物的总和[20]。
参考GB/T 8313-2018 检测茶叶中儿茶素、咖啡碱类化合物[8]。参考Zhang 等[21]的方法测定样品中儿茶素、生物碱等10个标准物含量,并稍作改进,采用1260 高效液相色谱仪(美国Agilent),Agilent ZORBAX SB-Aq C18 色谱柱(4.6 mm×250 mm,5 μm,美国)测定。以进样量中各成分质量对相应峰面积作图,制作10个标准品的标准曲线,在10 ng~50 μg之间呈良好的线性关系[22]。标准曲线图谱见图1。
1.5 数据统计与分析
试验数据以平均值±标准误表示,采用GraphPad Prism 5软件进行Student’s t-test显著性分析,P<0.05为差异显著。采用GraphPad Prism 5软件制图。
2 结果与分析
2.1 茶叶与茶汤的FTIR 光谱图及聚类分析
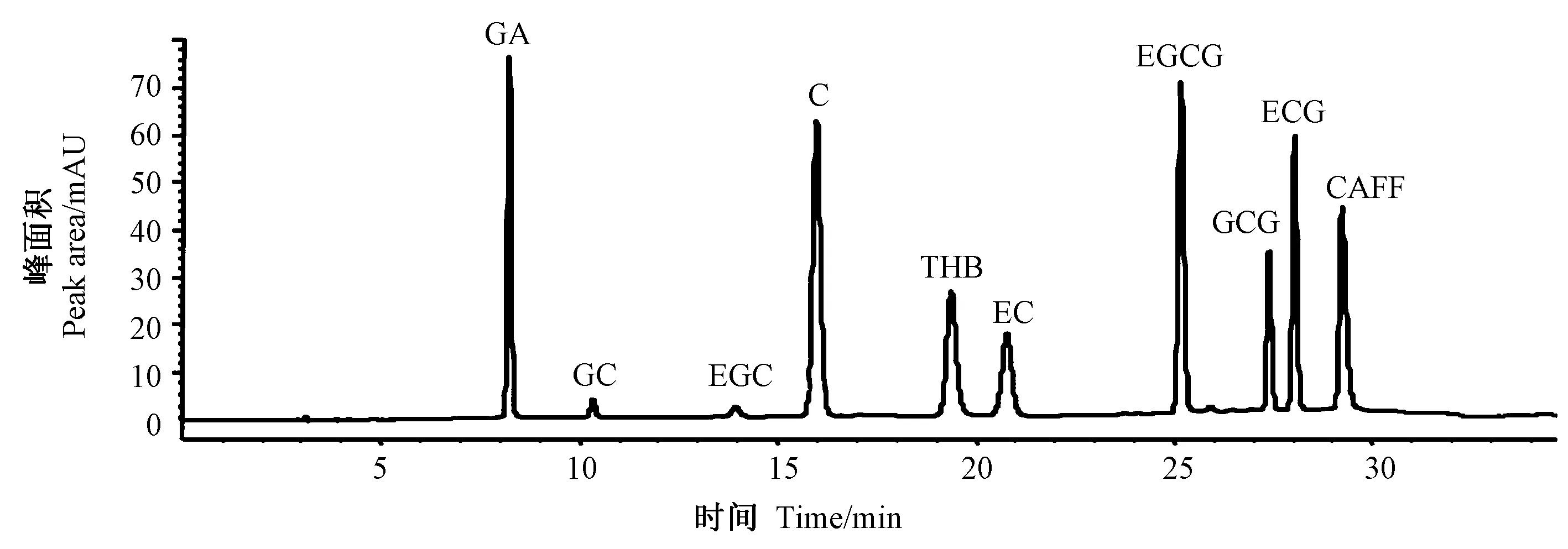
图1 HPLC 标准曲线图谱Fig.1 Standard curve of HPLC
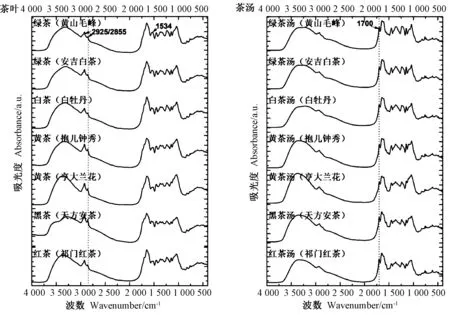
图2 茶叶及茶汤的FTIR 光谱图Fig.2 The FTIR spectra of tea leaves and tea beverages
由图2可知,不同茶叶与其对应茶汤的光谱图虽有相似之处,但也存在一些明显差别。其中茶叶的特征性峰位于3 306、2 922、2 852~2 855、1 648、1 534、1 451、1 367、1 238、1 147和1 103 cm-1;茶汤的特征性峰位于3 300、2 924~2 925、1 700、1 643、1 451、1 364、1 451、1 364、1 238、1 146和1 039 cm-1。不同茶叶与茶汤峰形的典型差别区域位于2 925/2 855 cm-1、1 700 cm-1和1 534 cm-1附近峰位的狭窄区域,表明干茶叶与开水冲泡茶汤的化学成分有明显差异。
为分析FTIR 光谱数据中的位置信息,寻找不同茶类的代表峰区,对不同茶类光谱进行聚类分析。对茶叶和茶汤样品光谱数据,选取谱段1 800~1 170 cm-1预处理,处理方式为一阶导数。由图3可知,茶叶和茶汤的聚类趋势基本一致,由加工工艺决定的茶叶分为两大类:一类是非发酵的绿茶、白茶,另一类为发酵的黄茶、红茶、黑茶;再进一步,绿茶(黄山毛峰和安吉白茶)、黄茶(亨大兰花和抱儿钟秀)各自聚为一类。聚类分析结果表明,1 800~900 cm-1区域是区分不同茶类的主要光谱范围。因此,后续主要针对样品光谱差 异 明 显的2 925/2 855 cm-1、1 700 cm-1和1 534 cm-13个位点进行结果分析。
2.2 茶叶与茶汤在2 925/2 855 cm-1区段光谱峰差异解析
在测定的所有样品中,与茶叶波峰相比,茶汤在2 955 cm-1峰位明显降低、在2 855 cm-1峰位降至肉眼不可见(图2)。这是由于2 925/2 855 cm-1区域是CH2反对称/对称伸缩振动的特征性峰位[23-24],属于脂类化合物。茶叶中脂类物质广泛存在,而在冲泡过程中脂类难溶于水,因而造成茶汤在2 925/2 855 cm-1区域特征峰位降低。表明茶叶中所含的脂溶性成分,经开水冲泡后仍难以溶解于茶汤中。
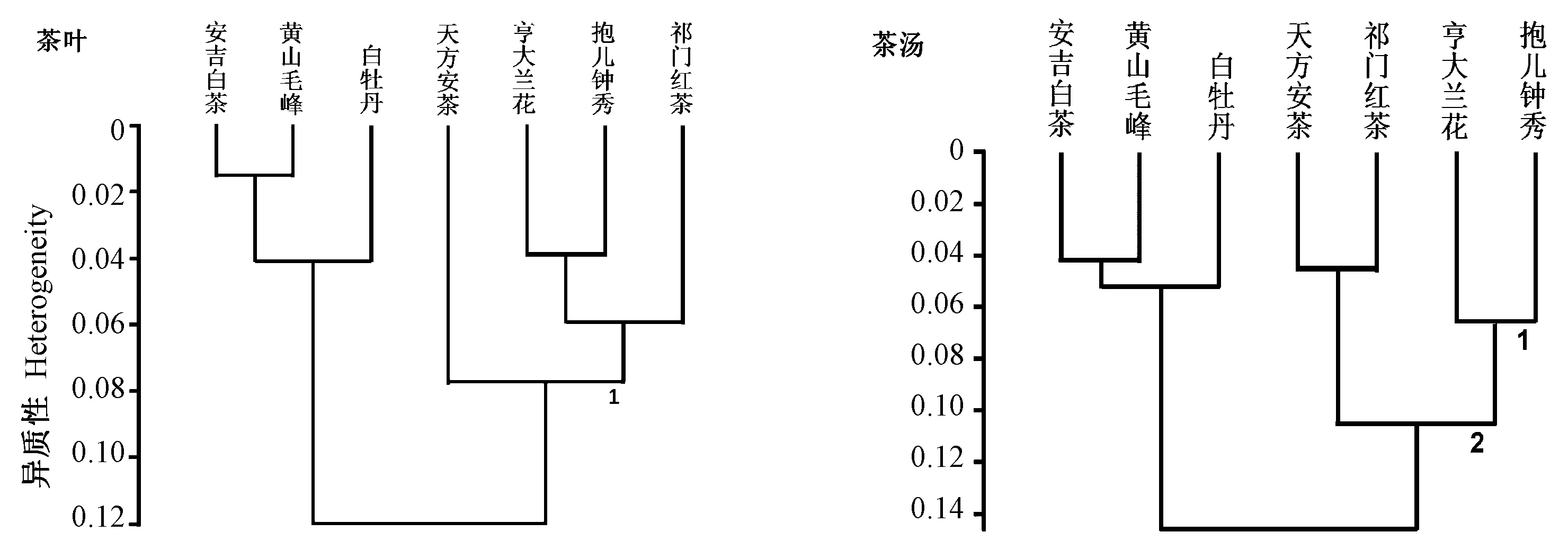
图3 茶叶及茶汤FTIR 光谱的聚类分析Fig.3 FTIR spectrum cluster analysis of leaves and tea beverages
2.3 茶叶与茶汤在1 700 cm-1峰位差异解析
1 700 cm-1峰作为C=O和C=C 伸缩振动位点,可能来源化合物为氨基酸、糖类或茶多酚,在所测定的茶叶及相应茶汤样品中此峰区存在差异,表明茶叶与茶汤含有的这三类化合物存在差异。聂志矗[25]对茶叶中氨基酸单体进行FTIR 光谱分析发现,茶氨酸(占氨基酸含量50%以上)、谷氨酸和酪氨酸的C=O 伸缩振动均与1 700 cm-1距离较远,其中茶氨酸的波峰位于1 647 cm-1。胡皆汉等[26]研究表明,虽然-COOH 伸缩振动位于1 701 cm-1附近,但氨基酸看不到任何谱带。因此,本试验分析了糖类的FTIR 光谱图,包括几种单糖、不可溶/可溶性葡聚糖。由图4-a可知,无论是葡萄糖、半乳糖、木糖、甘露糖等单糖,还是葡聚糖,在1 701 cm-1均未出现明显谱峰;而儿茶素类和CAFF的FTIR 光谱检测结果表明,EGCG、ECG、GA和CAFF 因分子中含有的-COO-或C=C 基团,在1 700 cm-1附近均有典型的特征性峰位出现(图4-b)。以上结果表明,茶叶与茶汤在1 700 cm-1光谱峰的差异,是由儿茶素类和CAFF 分子引起的,也证明茶叶冲泡过程中有儿茶素类和CAFF的溶出。
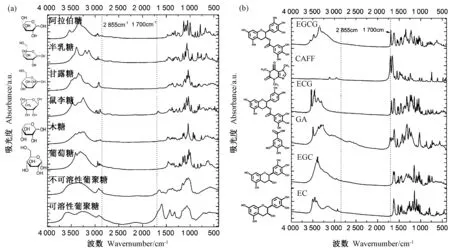
图4 糖类(a)、儿茶素类和CAFF 单体(b)的FTIR 光谱图Fig.4 FTIR spectrogram of carbohydrate (a),catechin and caffeine monomer (b)
2.4 茶叶与茶汤在1 534 cm-1峰位差异解析
由图2和图5可知,茶叶样品在1 534 cm-1特征峰位清晰,但茶汤的光谱中此峰位不明显,进一步光谱拟合后,可以更清楚地看到二者之间的差别(图6)。1 534 cm-1峰位对应叶绿素a与Mg 原子中心5 价配位键结合[27],说明茶叶冲泡过程中,叶绿素作为脂溶性成分,难以溶出,因此在茶汤中的含量比茶叶中明显降低,造成了茶汤光谱中1 534 cm-1峰位的缺失。红茶和绿茶茶汤在此位置相对高度不同,表明2种茶汤在色泽上存在差异。
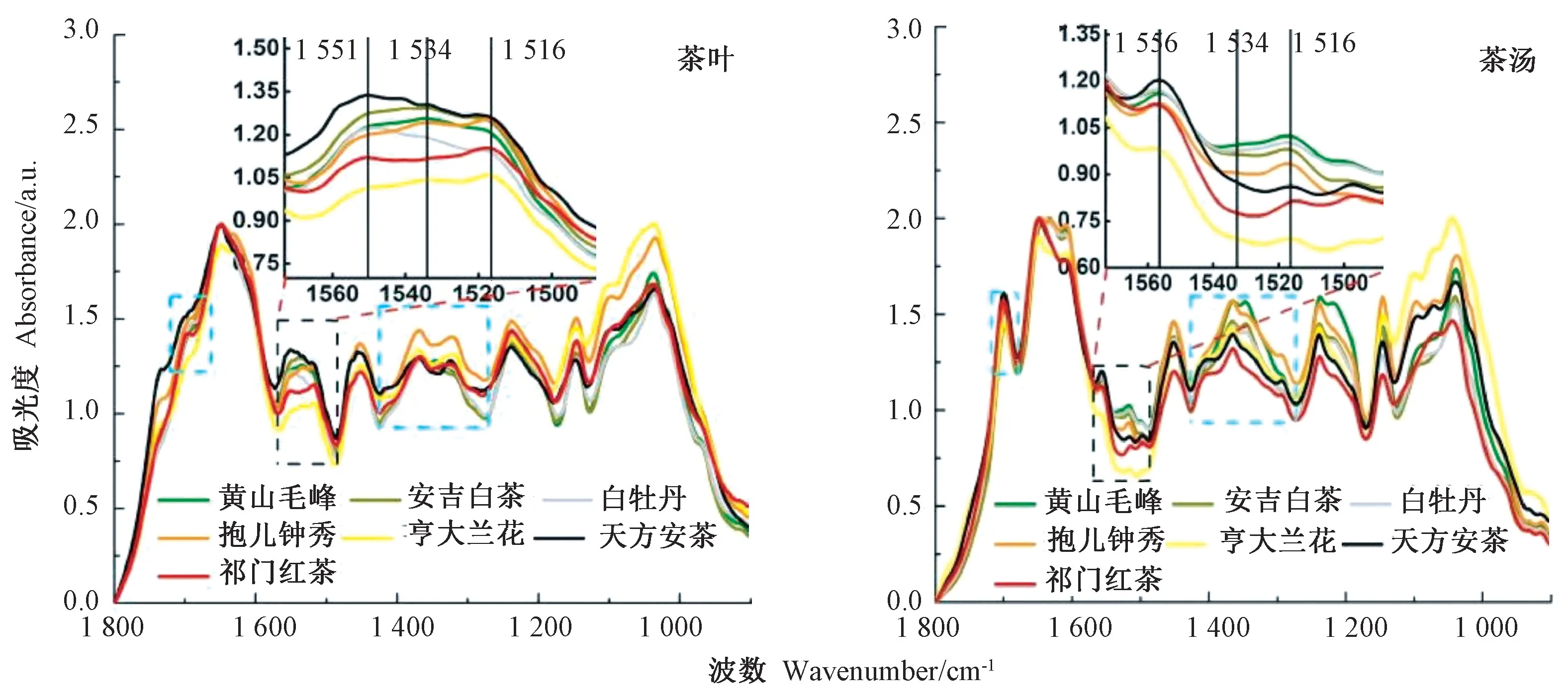
图5 茶叶及茶汤样品在1 800~900 cm-1段FTIR 光谱图Fig.5 The FTIR spectra of tea leaf and tea beverage samples in the 1 800~900 cm-1 region
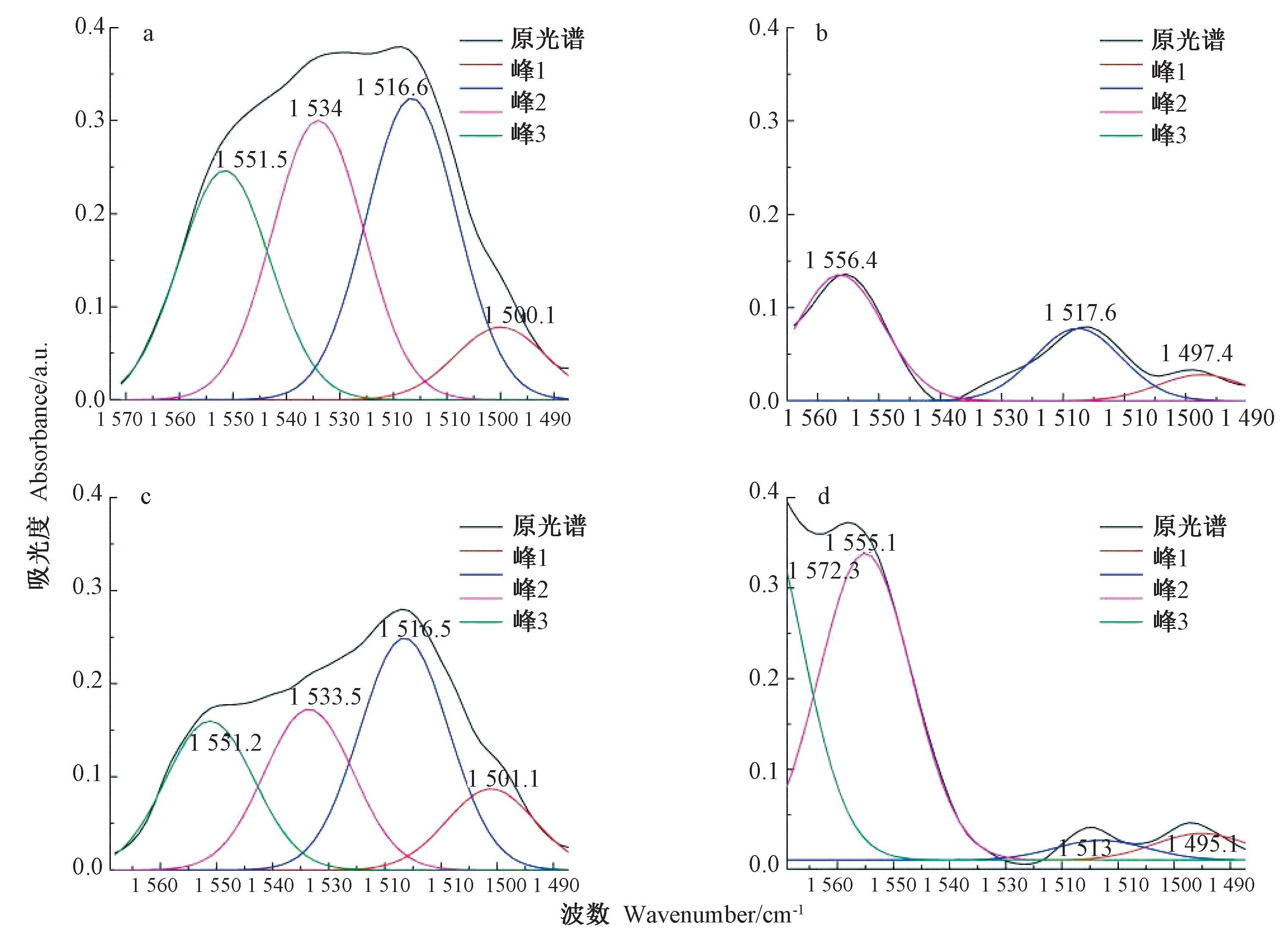
图6 黄山毛峰与祁门红茶在1 573~1 487 cm-1光谱区域FTIR 分峰结果Fig.6 The results of FTIR in the spectral region of 1 573~1 487 cm-1 were obtained by Huangshan maofeng and Keemun tea
不同茶叶品种的光谱在1 534 cm-1峰位也存在明显差异,绿茶在此位点的峰明显高于红茶。这是由于绿茶加工过程中的杀青工艺,导致茶叶中的酶失活、叶绿素未脱镁,从而保存了更多的含镁叶绿素,此外绿茶未经发酵从而降低了叶绿素被微生物降解的比例,因此在5种茶中绿茶的叶绿素保留最为完整(1 534 cm-1波峰最高)。而红茶在揉制过程中,叶绿素脱镁,使得红茶颜色呈现红褐色。黑茶在全发酵过程中叶绿素被微生物分解,导致发酵型茶中叶绿素含量较低,形成各自独有的颜色,也造成了在1 534 cm-1位置峰型的差异。因此,1 534 cm-1特异性波峰可以作为判断不同茶叶加工方式的定性分析标准之一。
在1 534 cm-1峰区还存在另外3个峰位变化,分别是1 551/1 556 cm-1、1 500/1 497 cm-1和1 516/1 517 cm-1。其中,1 551/1 556 cm-1和1 500/1 497 cm-1与叶绿素有关,为叶绿素中亚甲基桥的伸缩振动[28]。由图6可知,绿茶茶叶在这2个峰位均高于红茶茶叶。1 516/1 517 cm-1为木质素中的苯环C=C 伸缩振动[29],茶汤无法溶解木质素,光谱中也显示这一峰位明显低于茶叶。
2.5 样品中总茶多酚、茶多糖、可溶性糖、总游离氨基酸等的定量分析
由图7可知,在茶叶和茶汤所含干物质中,茶多酚占据首要地位,也是茶叶风味的主要来源;其次是可溶性糖,对茶叶和茶汤口感也有重要影响;而总游离氨基酸含量在茶叶中较低,与茶多糖相当。氨基酸极易溶于水,其在茶汤中易富集,是决定茶汤鲜爽滋味的另一类重要组分。茶叶中单一儿茶素类的含量往往高于总游离氨基酸或茶多糖的含量(图7、图8),因此对中红外光谱影响尤为重要;而茶多糖和总游离氨基酸因含量相对较低,对FTIR 光谱的影响较小,印证了茶叶与茶汤在1 700 cm-1峰位差异是由儿茶素类,而不是由茶多糖或氨基酸的含量差异引起的。
EGCG含量由茶叶中的33.5 mg·g-1(7种茶叶平均值)提升至茶汤中的64.9 mg·g-1(7种茶叶平均值);CAFF含量从26.5 mg·g-1(7种茶叶平均值)提升至85.4 mg·g-1(7种茶叶平均值)。一般在茶叶中EGCG和CAFF含量占总多酚的58%~74%之间,是茶叶多酚中的主要化合物。比较黄山毛峰的茶叶与茶汤,EGCG 从77.6 mg·g-1上升至116.7 mg·g-1,CAFF从36.3 mg·g-1上升至87.4 mg·g-1(图8)。表明茶叶冲泡过程中儿茶素和生物碱有效溶出,大量的EGCG、CAFF、ECG 等单体溶出进入茶汤,茶多酚在茶汤干粉中得到富集,含量明显提升。
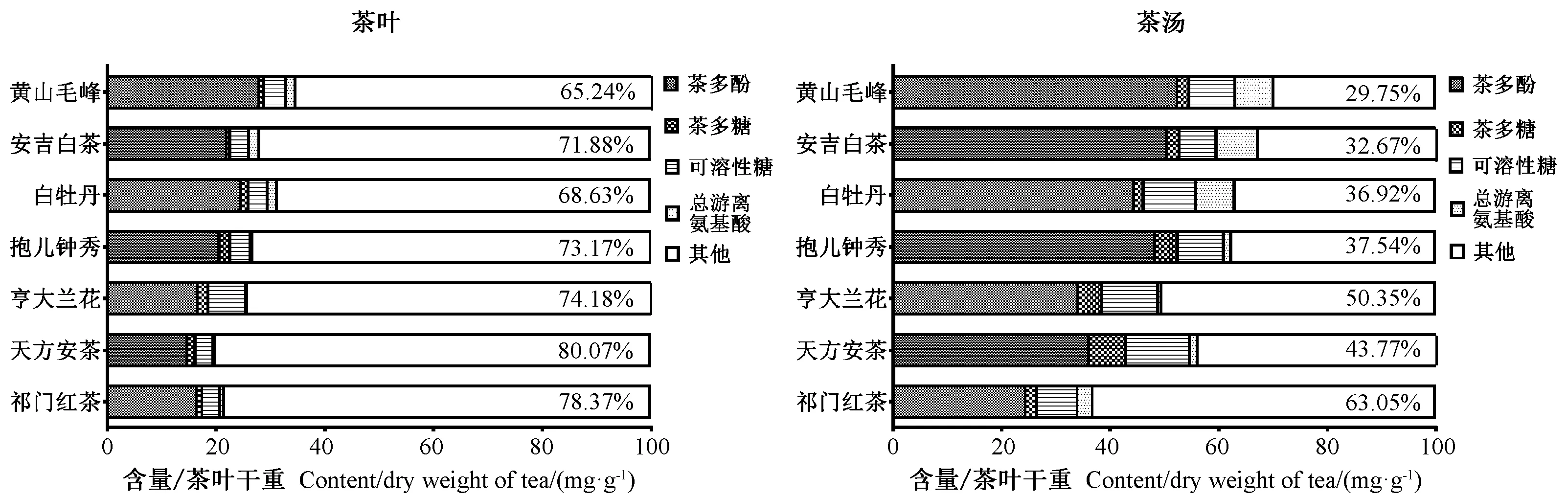
图7 茶叶和茶汤中总茶多酚、茶多糖、可溶性糖、总游离氨基酸及其他物质含量Fig.7 The tea polyphenols,polysaccharides,soluble sugar and other substances in tea leaf and tea beverage samples
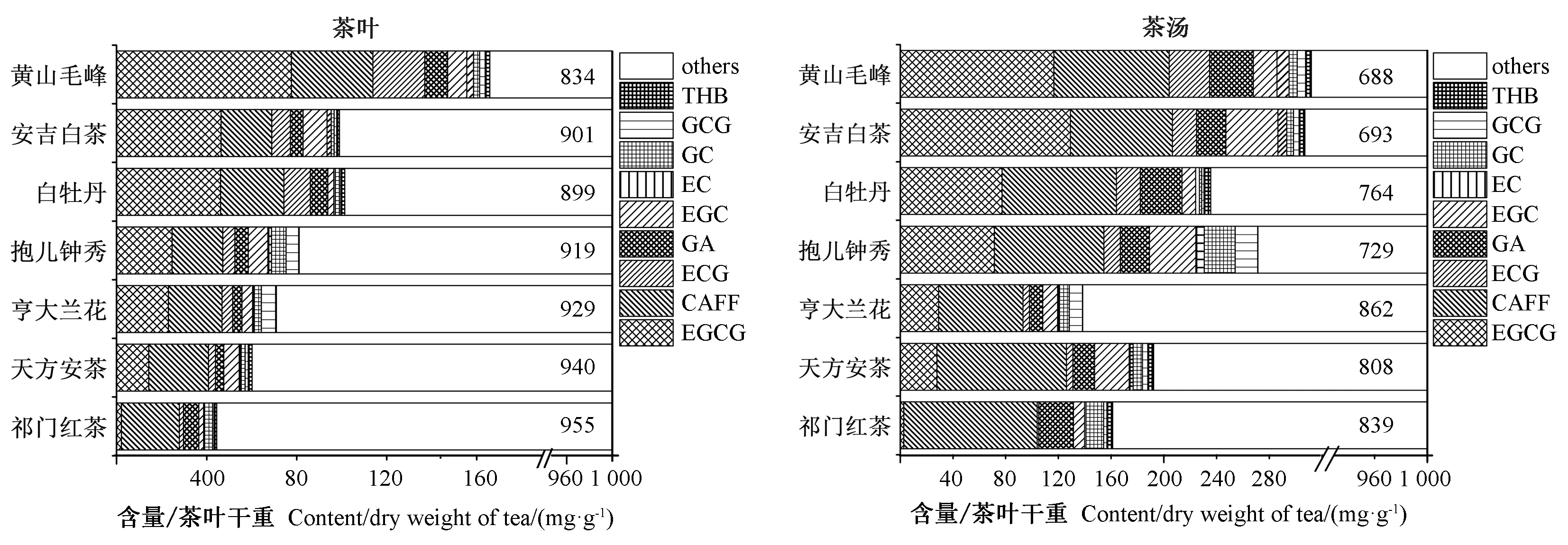
图8 茶叶和茶汤中儿茶素类和生物碱含量Fig.8 The content of catechins and alkaloids in tea leaf and tea beverage samples
3 讨论
FTIR 作为分析分子振动规律的检测手段,可以在不破坏原有样品的前提下对微量样品进行分析[30]。基于FTIR 技术在探知物质内在组成和含量方面的独特优势,可以快速高效的检测到样品中化合物含量的变化。如李晓丽等[31]利用FTIR对茶叶中非法添加滑石粉进行了检测分析;也有研究利用FTIR 光谱对茶叶加工过程进行监控,如李栋玉等[12]对普洱熟茶陈化过程进行研究;还可以利用FTIR对不同年份的茶叶进行鉴定等[32]。
在光谱分析中,聚类分析法和判别分析法是两种可相互补充的方法。吴全金等[33]对乌龙茶、绿茶、红茶和白茶开展判别分析,采用Wilks’ Lambda 判别模型,以1 000~1 800 cm-1波段中筛选获得的谱峰的吸收值建立了每个茶类的特定判别函数,可应用于对未知茶类的判别,但也存在一定的局限,如所需选峰位多达12个,而且对所选峰位归属、针对不同茶类的光谱特征差异并未解析;此外,这种一分为二的判别方法无法阐明茶类之间的“亲缘”关系,而本研究所采用的聚类分析法则是一种较好的补充。本研究在对不同茶类聚类分析时,选用光谱范围为1 800~1 170 cm-1,该区域比胡燕等[14]的选择更狭窄;同时包含了本研究中前述的各特征区域,可作为区分不同茶类,以及茶叶与对应茶汤的特征性位点。
与以往的聚类分析不同,本研究不仅对样品特征峰位进行了指认,所选特征峰位包含脂类、儿茶素类、CAFF和叶绿素等与茶类特征密切相关的典型峰位;还对茶叶加工过程中内含物的理化变化和光谱差别机理进行了探索。通过光谱曲线拟合对比分析茶叶和茶汤的光谱信息,确定它们的特征性峰位在2 925/2 855 cm-1、1 700 cm-1和1 534 cm-1狭窄区域。2 925/2 855 cm-1区域代表脂类饱和烃链-CH2振动,而脂类物质难溶于水,因此经冲泡后的茶汤在此位点的峰形明显低于茶叶。1 700 cm-1峰位对应化合物是儿茶素类和CAFF,这些水溶性物质在茶汤中大量溶出,构成了茶汤的主要色泽、滋味及健康功效成分。而儿茶素类和CAFF 在茶汤干粉中得到了富集,因此在此位点茶汤的峰形明显高于茶叶。1 534 cm-1和1 516/1 517 cm-1特征峰位分别对应叶绿素和木质素。样品在该位点的峰形和走势不同,体现了不同茶叶加工工艺所造成的不同茶类中叶绿素含量的差异,以及木质素难溶于茶汤的溶解特性。
1 700 cm-1峰位对应样品中儿茶素类和CAFF含量变化,此结果得到了罗婧等[34]的研究证实。而Breton[27]和Sato 等[28]研究表明1 534 cm-1峰位与叶绿素分子振动有关,Butler 等[35]表明1 534 cm-1峰位的降低代表叶绿体的降解,表征着植物的衰老。红茶在鞣制发酵过程中叶绿素脱镁,导致其叶绿素含量降低,因而其FTIR 光谱在1 534 cm-1位点峰形较低,所以1 534 cm-1峰位特征可用于定性分析不同加工工艺的茶叶。以往光谱学研究往往以干茶叶为研究对象,缺乏对冲泡后茶汤内含物的分析,考虑到现实生活中泡茶方式的广泛使用,茶汤的化学品质及其理化状态是一个重要是营养学问题。本研究详细对比分析了茶叶、茶汤的化学品质,具有重要的指导实践和社会意义,且从侧面佐证了筛选的3个特征峰的归属。
4 结论
本研究采集茶叶和茶汤FTIR 光谱数据,对1 800~900 cm-1峰区聚类分析,建立了一种基于FTIR的快速茶叶分类方法。通过光谱曲线拟合,探明了茶叶与茶汤的特征性峰位为2 925/2 855 cm-1、1 700 cm-1和1 534 cm-1;并进一步结合化合物单体的光谱信息,解析了不同茶类差异峰位的化合物来源包含脂类、儿茶素类/CAFF、叶绿素和木质素。本研究采用的FTIR 光谱分析法可作为判别分析和化学测定的有效补充,实现茶叶/茶汤化学品质分析、茶汤色泽审评的快速定性分析,为茶叶市场的大量检测需求,特别是新型速溶茶粉的质量检测提供一种简便、可行的方法。

