补肾壮骨颗粒对去卵巢大鼠血清GH和IGF-1及其骨组织中受体表达的影响*
苏海容, 程文姚, 袁秋虹, 欧阳菁, 邓伟民,3△
(1. 中国人民解放军南部战区总医院康复科, 2. 中国人民解放军南部战区总医院军队伤病员管理科, 广东 广州 510010; 3. 前海人寿广州总医院康复科, 广东 广州 511300; 4. 广州中医药大学2017级在读博士研究生, 广东 广州 510405)
生长激素(growth hormone,GH)对人的影响重大,主要表现为青年时期骨长度的生长和成年后骨量的维持。而胰岛素样生长因子-1(insulin-like growth factor 1,IGF-1)作为GH刺激肝脏产生的激素对骨代谢同等重要。GH和IGF-1分别与成骨细胞上的GH受体(growth hormone receptor,GHR)和IGF-1受体(insulin-like growth factor 1 receptor,IGF-1R)结合可刺激成骨细胞的增殖和分化,从而增加骨密度(bone mineral density,BMD)。在垂体发育过程中,雌激素(estrogen,E2)可引起GH细胞的增殖与分化,在成年时,可维持垂体GH细胞的数量[1]。有研究发现激素替代治疗(estrogen replacement theropy,ERT)可提高卵巢切除骨质疏松大鼠股骨BMD和血清GH、IGF-1水平[2,3],E2直接与下丘脑雌激素受体(estrogen receptors, ER)结合,一方面可能通过生长激素释放激素的增加间接使GH分泌增加,另一方面可能直接作用于垂体前叶的生长激素细胞从而增加GH的分泌[4]。但长期E2治疗可能增加冠心病和乳腺癌发生率以及脑卒中风险,由于长期激素替代治疗治疗弊大于利,激素替代治疗不再推荐用于绝经后骨质疏松(postmenopausal osteoporosis,PMO)预防和治疗的一线药物。因此,寻找一种E2作用类似但副作用小的治疗药物具有重要意义。补肾壮骨颗粒治疗PMO疗效肯定,副作用小,团队前期对其作了大量相关研究[5,6-8],但其具体作用机理仍须进一步探讨。本研究通过去卵巢建立骨质疏松大鼠模型,运用补肾壮骨颗粒干预去卵巢骨质疏松大鼠,同时选用治疗PMO疗效确切的西药戊酸雌二醇作为阳性对照组,对比观察补肾壮骨颗粒促进骨形成的效果,推测补肾壮骨颗粒促进去卵巢骨质疏松大鼠骨形成的作用可能是通过调控血清GH和IGF-1浓度及其骨组织中受体的表达水平实现的,为临床应用治疗提供更多的依据。
1 材料与方法
1.1 动物与分组
6月龄SPF级SD未育雌性大鼠48只,体重273±21.3 g,由南方医科大学实验动物中心提供,许可证号:SCXK(粤)2016-0041。适应喂养7 d后,大鼠随机分为12只假手术组(SHAM)和36只手术组(OVX),建立去卵巢骨质疏松模型后,手术组随机分为模型组(OVX组),戊酸雌二醇(E2组),补肾壮骨颗粒组(BSZG组),每组12只。
1.2 实验药物
补肾壮骨颗粒由龟板胶、鹿角胶、水蛭、生地、淫羊藿、山药、骨碎补等中药组成(10 g/袋,南部战区总医院,批号15K04001)。戊酸雌二醇(E2)(补佳乐,1 mg/片,德国先灵公司生产,广州先灵药业有限公司分装,国药准字J20030089),由南部战区总医院药剂科提供。
1.3 实验主要试剂及仪器
试剂:GH一抗抗体(abcam公司生产),GH二抗为山羊抗兔鼠通用二抗(上海基因科技公司生产),TRIzol Reagent(天根生产),逆转录试剂盒(DBI生产),荧光定量PCR检测试剂盒(Genecopies生产),大鼠生长激素(GH)ELISA试剂盒(酶免生产),大鼠胰岛素样生长因子1(IGF-1)ELISA试剂盒(酶免生产)。仪器:台式高速离心机(SCIlogex公司生产),纯水仪(重庆艾科浦生产),荧光定量PCR仪(ABI生产),微量核酸定量仪(Merinton生产),基因扩增仪(珠海黑马生产),多功能酶标仪(南京东华电子公司),光密度及阳性细胞分析软件采用Image J,美国GE双能X线骨密度仪(型号:Prodigy由通用电气(中国)有限公司生产)。
1.4 实验方法
1.4.1 造模 术前禁食6 h,无菌条件下,按3 ml/kg水合氯醛(浓度为10%)进行腹腔注射,俯位固定,于腰椎两侧旁约1 cm处纵行切开皮肤,皮下及肌肉组织分离后,手术组找到双侧卵巢,子宫角处结扎后摘除,SHAM组大鼠仅切除卵巢周围与卵巢组织大小相当的脂肪组织。术后大腿肌肉注射40 KU/(kg·d)青霉素,连续用药3 d,以防术后感染。
1.4.2 给药方法 术后2周,各组大鼠均存活。各组大鼠每日定时灌胃给药1次,BSZG组给予补肾壮骨颗粒最佳治疗剂量为2.5 g/(kg·d)[5],给药浓度为0.25 g/ml。按照人与动物体表面积比值折算得等效给药剂量,E2组给药量为0.071 mg/(kg·d),给药浓度为7.1 μg/ml,SHAM组及OVX组灌服等量生理盐水10 ml/kg。每周称量体重1次,根据体重调整受试药物剂量。连续给药3个月后,每组随机选取半数大鼠取材,剩下继续前干预至6个月末取材。
1.4.3 取材 最后一次灌胃后2 h,每组随机选取半数大鼠麻醉,活体测定其脊柱及股骨颈BMD,酒精浸泡下半身消毒,随后腹主动脉取血,静置2h,即时分离血清,3 000 r/min离心5 min后,吸取血清置-80℃冰箱保存。取完血标本后迅速处死,取出垂体,用滤纸吸干,再用4%多聚甲醛固定,垂体放入该固定液后固定4 h( 4℃),梯度酒精脱水,常规石蜡包埋,切片厚度5 μm。迅速取其左侧胫骨,剔净其上软组织后,0.9%生理盐水洗净后用无菌纱布包裹放于-20℃保存。
1.4.4 指标检测 骨密度仪检测,重点检测部位为脊柱和股骨。ELISA法检测血清GH及IGF-1浓度,qPCR法检测左侧胫骨组织GHR、IGF-1R的表达水平(GHR引物序列为:GAATGTCCGAGACAGCAGATAC,IGF-1R引物序列为CAATATC A CAGACCCGGAAGAG)。电子显微镜和JVCCCD摄像头摄像采集脑垂体免疫组化片,显微放大倍数40×,垂体GH免疫反应阳性细胞的检测系统通过每张切片随机选10个不重叠的视野,计数每个视野细胞数。最后采用Image J软件分析光密度值。
1.5 统计学处理
2 结果
2.1 补肾壮骨颗粒对去卵巢大鼠脊柱及股骨BMD的影响
股骨BMD比较:(1)两阶段干预后均表现:OVX组较SHAM组下降(P<0.05);BSZG组较OVX组高(P<0.05),与SHAM组比较不具统计学差异(P>0.05),BSZG组及E2组与SHAM组比较无统计学差异(P>0.05)。(2)干预3个月后,E2组与OVX组、BSZG组比较无统计学差异(P>0.05),6个月后,E2组较OVX组高(P<0.05),与BSZG组比较无统计学差异(P>0.05,表1)。
脊柱BMD比较:(1)两阶段干预后均表现:OVX组较SHAM组下降(P<0.05);BSZG组和E2组均较OVX组上升(P<0.05),但两药物干预组比较无统计学差异(P>0.05)。(2)干预3个月后,两药物干预组与SHAM组比较无统计学差异(P> 0.05);干预6个月后E2组低于SHAM组(P< 0.05,表1)。
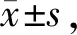
Tab. 1 Femoral and vertebral BMD of rats in each group(g/cm2, n=6)
2.2 补肾壮骨颗粒对去卵巢大鼠血清GH/IGF-1水平的影响
大鼠血清IGF-1水平比较:(1)两阶段干预后均表现为:OVX组低于SHAM组(P<0.05);BSZG组高于OVX组高(P<0.05),与SHAM组比较无统计学差异(P>0.05)。(2)干预3个月后,E2组与OVX组比较无统计学差异(P>0.05),低于SHAM及BSZG组(P<0.05);6个月后,E2组较SHAM、OVX及BSZG组低(P<0.05,表2)。
血清GH水平比较:(1)两阶段干预后均表现为:OVX组较SHAM组下降(P<0.05);BSZG和E2组均较OVX组上升(P<0.05),两药物干预组比较无统计学差异(P>0.05)。(2)干预3个月后,E2组较SHAM组低(P<0.05),BSZG组与SHAM组比较无统计学差异(P>0.05);干预6个月后,两药物干预组与SHAM比较无统计学差异(P>0.05,表2)。
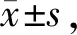
Tab. 2 Comparison of serum IGF-1and GH expressionlevels in each group(ng/ml, n=6)
2.3 补肾壮骨颗粒对去卵巢大鼠胫骨GHR及IGF-1R表达水平的影响
IGF-1R相对表达水平比较:两阶段干预后均表现为:(1)OVX组较SHAM组下降(P<0.05)。(2)BSZG组和E2组均OVX组上升(P均<0.05),两药物干预组组间比较无统计学差异(P>0.05),两药物干预组与SHAM组比较无统计学差异(P>0.05,表3)。
GHR相对表达水平比较:(1)两阶段干预后均表现为:OVX组较SHAM组下降(P<0.05);BSZG组和E2均较OVX组高(P均<0.05)。(2)干预3个月后,E2组较SHAM组和BSZG组低(P均< 0.05);但干预6个月后,E2组与SHAM组及BSZG组比较无统计学差异(P均>0.05,表3)。
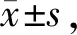
Tab. 3 Comparison of the relative expression levels of left tibial GHR and IGF-1R in rats in each group(ng/ml, n=6)
2.4 补肾壮骨颗粒对去卵巢大鼠垂体光密度及阳性细胞数的影响
光密度值比较:两阶段干预后均表现为:(1)与SHAM组相比,OVX组有所下降(P<0.05)。(2)BSZG组和E2组均较OVX组升高(P均<0.05),两药物干预组比较差异无统计学差异(P>0.05,表4,图1)。
GH阳性细胞数比较:两阶段干预后均表现为:(1)OVX组较SHAM组下降(P<0.05)。(2)BSZG组和E2组均较OVX组上升(均P<0.05);两药物干预组组间比较差异无统计学差异(P>0.05),与SHAM组比较无统计学差异(P>0.05,表4,图1)。
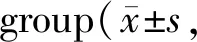
Tab. 4 Comparison of optical density and GH cell count of pituitary immunostaining in each n=6)

Fig. 1 The pituitary gland (10×), The GH cells were observed by pituitary gland immunohistochemistry (20×)
2.5 骨密度与有关变量之间的相关性分析
血清GH和IGF-1浓度、骨组织GHR和IGF-1表达水平与股骨BMD呈正相关(分别为r=0.725,P<0.01;r=0.469,P<0.01;r=0.660,P<0.01;r= 0.648,P<0.01);血清GH和IGF-1浓度、骨组织GHR和IGF-1表达水平与脊柱BMD呈正相关(分别为r=0.707,P<0.01;r=0.429,P<0.01;r= 0.573,P<0.01;r=0.630,P<0.01)。
2.6 大鼠血清GH水平与垂体GH免疫染色光密度值及阳性细胞数的相关性分析
血清GH浓度与光密度值、阳性细胞数呈正相关(分别为r=0.721,P<0.01;r=0.829,P<0.01)。
3 讨论
骨质疏松症的中医基本病机为肾虚、脾虚及血瘀,以肾虚为根本,血瘀为重要病因。补肾壮骨颗粒正是基于此种理论组方而成,主要包括鹿角胶、龟板胶、淫羊藿、生地、骨碎补、山药、水蛭等成分。淫羊藿、鹿角胶、骨碎补可补肾强筋、益精填髓。龟板胶、生地可补肾精,益阴血。山药可健脾和胃,养后天脾胃以充养先天之肾精。水蛭、三棱活血祛瘀止痛。前期研究发现临床使用该方治疗PMOP取得了公认的良好效果,补肾壮骨颗粒可以增加BMD及骨矿含量、降低骨折率、缓解疼痛及改善骨代谢情况,具有良好的成本-效果比[6,7]。补肾壮骨颗粒可提高去卵巢大鼠血清E2水平及股骨雌激素受体α(estrogen receptor α,ERα)和雌激素受体β(estrogen receptor β,ERβ)的表达,效果优于E2治疗[8]。绝经后骨质疏松症患者血中GH、IGF-1和IGFBP3水平下降,与BMD、血清E2水平呈正相关[9,10]。因此,可以推测补肾壮骨颗粒的“补肾健骨”功效可能是经由E2调控GH/IGF-1轴的表达水平实现。
IGF-1和GH是调节人一生骨平衡的主要因素,它们决定青春期前骨的生长长度、成熟和最大骨量的获得,成年后则主要表现为对骨量的维持。大鼠成骨细胞系上表达GHR是GH发挥细胞增殖作用的一个重要因素[11],GH结合成骨细胞上的GHR,从而促进其有丝分裂。当成骨细胞上的GHR缺乏时,IGF-1增殖和抗凋亡的作用减弱[12]。有研究发现成骨细胞IGF-1R缺乏小鼠成骨细胞分化降低、骨密度下降,同时发现,高龄野生型小鼠的IGF-1R较低龄的明显降低[13]。成骨细胞上的IGF-1R与配体IGF-1结合,可促进成骨细胞的增殖与分化,成骨细胞上IGF-1R基因敲除大鼠成骨细胞数量减少、骨重建率下降和松质骨密度下降及微观结构异常[13]。可见,IGF-1/GH轴对骨代谢平衡维持的重大作用。
有研究发现雌激素可促进大鼠生长激素细胞的增殖,大鼠下丘脑中GH释放因子神经细胞、生长激素抑制素神经细胞和垂体GH细胞均含有雌激素受体,此为E2影响GH水平提供了证据[14]。本研究显示,OVX组大鼠血清GH及IGF-1浓度、胫骨组织GHR及IGF-1R水平、脑垂体光密度值、GH阳性细胞数和脊柱BMD均较SHAM组低,E2干预3个月及6个月后,以上指标均有上升,与前研究中E2可影响GH细胞的增殖和分泌功能结论相符,同时也说明了E2治疗骨质疏松可能的作用机制。补肾壮骨颗粒组大鼠血清GH及IGF-1浓度、胫骨组织GHR及IGF-1R水平、脑垂体光密度值、GH阳性细胞数较OVX组上升,与E2组比较未见明显差异。结合团队前期研究发现补肾壮骨颗粒可提高去卵巢大鼠血清E2水平[11],考虑补肾壮骨颗粒可能通过提高血清E2表达水平调节GH/IGF-1的分泌。补肾壮骨颗粒干预3个月后股骨及脊柱BMD均所上升,与E2组干预3个月时只有脊柱BMD上升相比,说明在干预早期,对BMD的提高方面补肾壮骨颗粒较E2更具优势。干预6个月时,两组药物干预组的BMD未见明显差异,说明两种药物长期疗效相当。因E2的副作用较大,在绝经后骨质疏松症治疗方面,补肾壮骨颗粒可能更为适合。相关性分析显示,血清GH与垂体光密度值、GH阳性细胞计数呈正相关,E2可能结合下丘脑GH释放因子神经细胞、GH抑制素神经细胞和垂体GH细胞上的雌激素受体,促进垂体GH细胞增殖和分泌GH。此外,相关性分析显示股骨与脊柱BMD与血清GH、IGF-1呈正相关,再次验证了GH和IGF-1对骨代谢的正向调节作用。
综上所述,我们发现补肾壮骨颗粒可提高去卵巢大鼠血清GH及IGF-1水平和其在胫骨中的受体表达水平、垂体GH细胞数量和光密度值以及BMD,骨密度的提高可能与补肾壮骨颗粒调节GH/IGF-1轴的功能有关。

