Cordyceps fumosorosea和Beauveria bassiana来源的碱性蛋白酶在毕赤酵母中的异源表达与性质测定
任雅馨, 罗会颖, 姚斌 , 王国增, 涂涛*
(1.中国农业科学院饲料研究所, 农业农村部饲料生物技术重点实验室, 北京 100081; 2.福州大学生物科学与工程学院, 福州 350116)
蛋白酶是特异水解蛋白质中肽键的一类酶的总称,其来源丰富,广泛存在于动物、植物及微生物中[1]。蛋白酶的结构性质多样,种类繁多,有多种分类方式,根据其作用的不同pH范围,可将其分为酸性蛋白酶、中性蛋白酶和碱性蛋白酶[2,3]。碱性蛋白酶主要在碱性环境中发挥酶活性,最适pH主要集中在9.0~11.0,最适作用温度范围较广[2-3]。目前已发现的碱性蛋白酶主要为丝氨酸蛋白酶,催化三联体中起核心作用的残基为丝氨酸[4]。碱性蛋白酶的分子量大小主要分布在15~34 kD,少部分可达45甚至82 kD,也有分子量为8 kD的碱性蛋白酶[5-6]。其等电点一般较高,大多分布在pH 8.0~9.0[7]。尽管碱性蛋白酶的来源广泛,但微生物来源的碱性蛋白酶以其周期短、成本低、限制因素少等优点成为目前生产工艺最为成熟的一类碱性蛋白酶。目前,能产碱性蛋白酶的微生物有很多,大部分是芽孢杆菌,如枯草杆菌(Bacillussubtilis)、短小芽孢杆菌(Bacilluspumilus)、地衣芽孢杆菌(Bacilluslicheniformis)等;有关真菌来源的碱性蛋白的报道也在逐年增多,以酵母和丝状真菌为主,如棕曲霉(Aspergillusochraceus)、嗜热圆酵母(Torulathermophila)等;部分放线菌也可以分泌碱性蛋白酶,如灰色链霉菌(Streptomycesgriseus)、费氏链霉菌(Streptomycesfradiae)等[8]。
作为应用最为广泛的工业酶制剂之一,蛋白酶约占酶制剂总销售量的60%,其中碱性蛋白酶的占比近40%[2-3],发挥着巨大的工业应用价值。洗涤剂中添加碱性蛋白酶能提高洗涤剂的清洁能力,加快对蛋白类污渍的分解,作为碱性蛋白酶最主要的应用市场,洗涤剂等相关工业蛋白酶需求量洗涤剂等相关工业的碱性蛋白酶需求量约占其全球需求总量的2/3[2-3]。在食品行业中,碱性蛋白酶被应用于大豆蛋白的水解,以产生高营养价值的水解产物[9];此外,乳制品及肉制品加工也需要碱性蛋白酶的作用[10-11]。在饲料行业中,部分碱性蛋白酶具有水解角蛋白的能力,可以降解包括羽毛在内的富含角蛋白却难以降解的蛋白资源,应用于饲料的生产中[12]。在制革过程中,可以利用碱性蛋白酶处理皮革原料,不仅可以有效的避免环境污染和安全问题,而且可以大大提高脱毛速度,增加皮革面积,保留皮革原本的颜色,达到更好的脱毛效果[13]。在医药领域,碱性蛋白酶也发挥着一定的作用,其被对于烧伤、伤口化脓、血栓溶解具有一定的疗效[14-15]。此外,碱性蛋白酶在污水处理、废弃银回收、丝绸脱胶等方面也有所应用。巨大的应用前景使得针对碱性蛋白酶的研究十分必要。
直接利用野生菌株发酵生产碱性蛋白酶存在产酶水平低、性质不稳定、分离纯化麻烦等缺点。随着基因工程技术的发展,建立了许多优质的表达系统以实现目标蛋白的高效表达。目前,已成功构建的蛋白表达系统有大肠杆菌表达系统、酵母表达系统、枯草芽孢杆菌表达系统、昆虫表达系统和哺乳动物表达系统等。其中,毕赤酵母表达系统以其表达局限性小、产量高、可控性强、产品投入少、产物易分离及纯化效果好等特点成为备受青睐的表达系统,尤其是对于真菌来源的目的蛋白,其具有完善的翻译后修饰功能。目前,已有碱性蛋白酶实现了在毕赤酵母中的表达,如来源于Aspergillusoryzae的Alp[16]及来源于Aspergillussojae的AP[17]等。本研究对来源于真菌Cordycepsfumosorosea和Beauveriabassiana的碱性蛋白酶基因pa1及pa2成功实现了在毕赤酵母GS115中的高效表达,对重组蛋白的酶学性质进行了系统的研究,以期挖掘具有潜在工业应用前景的优质碱性蛋白酶。
1 材料与方法
1.1 材料
1.1.1菌株与质粒 质粒pEASY-T3和菌株EscherichiacoliTrans-T1购自北京全式金公司,分别用作克隆载体和宿主;质粒pPIC9和毕赤酵母PichiapastorisGS115 为本实验室保存,分别用作表达载体和宿主。
1.1.2培养基 LB培养基:酵母浸提物5 g·L-1、胰蛋白胨10 g·L-1、NaCl 10 g·L-1,固体培养基添加15 g·L-1琼脂粉。
MD固体培养基:葡萄糖20 g·L-1、琼脂糖20 g·L-1、YNB 13.4 g·L-1、生物素0.004 g·L-1。
YPD培养基:葡萄糖20 g·L-1,蛋白胨20 g·L-1,酵母提取物10 g·L-1。
BMGY培养基:酵母提取物10 g·L-1、蛋白胨20 g·L-1、1%甘油(体积分数)、YNB 13.4 g·L-1、生物素0.004 g·L-1。
BMMY培养基:酵母提取物10 g·L-1、蛋白胨20 g·L-1、0.5%无水甲醇(体积分数)、YNB 13.4 g·L-1、生物素0.004 g·L-1。
牛奶双层固体培养基:上层包含酵母提取物10 g·L-1、蛋白胨20 g·L-1、0.5%无水甲醇(体积分数)、YNB 13.4 g·L-1、生物素0.004 g·L-1、琼脂粉20 g·L-1;下层包含脱脂奶粉80 g·L-1、琼脂粉20 g·L-1。
1.1.3试剂 底物酪蛋白(casein sodium salt from bovine milk)购自Sigma公司;福林酚试剂购自上海荔达生物科技有限公司;质粒小提中量试剂盒、蛋白分子量Marker(M221)购自天根生化科技有限公司;DNA纯化试剂盒购自OMEGA公司;限制性内切酶EcoRⅠ、NotⅠ、BglⅡ购自TaKaRa公司;Assembly Kit试剂盒2×FastPfuPCR SuperMix购自北京全式金公司;2×TaqPCR StarMix、核酸分子量Maker(MD113)购自GenStar康润生物公司;其他试剂均为国产分析纯。
1.1.4仪器 纯水仪(美国Millipore)、立式高速冷冻离心机与台式高速冷冻离心机(日本HIMAC)、移液器(德国Eppendorf)、凝胶成像系统,PCR仪与电转仪(美国Bio-Rad)、膜包(德国Vivascience)、AKTA avant蛋白纯化仪与阳离子交换柱HiTrap SP HP 5 mL(美国GE)、酶标仪(美国Thermo),其他均为国产仪器。
1.2 方法
1.2.1菌株产酶能力的鉴定 蛋白酶的酶活(U)定义为:标准条件下(pH 8.5,60 ℃,反应20 min),每分钟释放1 μg酪氨酸所需的酶量为一个酶活单位。
电击转化后获得携带碱性蛋白酶基因的转化子,转接到牛奶双层平板上,30 ℃条件下培养72 h,根据转化子周围是否出现牛奶水解圈及出圈大小,判断转化子是否表达蛋白酶活性,并衡量其活性高低。
1.2.2碱性蛋白酶的酶活测定 本文以福林酚法测定蛋白酶活性,以酪蛋白为底物:500 μL底物(1% ,质量体积分数)和500 μL适当稀释倍数的酶液,在60 ℃反应20 min后加入1 mL 0.4 mol·L-1三氯乙酸溶液终止反应。将终止后的反应体系12 000 r·min-1离心3 min后,取上清进行显色。显色反应体系:2.5 mL 0.4 mol·L-1碳酸钠溶液,500 μL上清和 500 μL 福林酚试剂,40 ℃反应20 min,待其冷却至室温后读取其波长680 nm的吸光值,计算酶活力。所有反应均设有三个平行和空白对照。
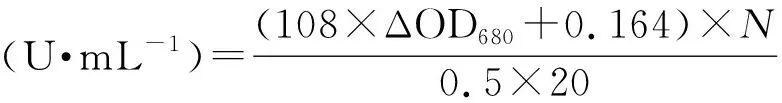
式中,ΔOD680=实验组OD680-空白对照OD680;N为配液的稀释倍数。
1.2.3编码碱性蛋白酶基因的获取及其表达载体的构建与鉴定 本研究中异源表达的两条碱性蛋白酶基因分别来源于真菌Cordycepsfumosorosea和Beauveriabassiana,根据Genbank中公布的蛋白序列(ANV82734.1和AHA43398.1),基于毕赤酵母的偏好性对其二者进行密码子优化,并送至深圳华大基因有限公司进行合成,分别命名为pa1和pa2。
合成获得的基因通过同源重组的方法连接在pUC57载体上。首先,通过PCR方法借助特异性引物向目的基因中引入同源区段(pa1-F:GGCTGAAGCTTACGTAGAATTCGCTCCAGTTGTT-GAACCAGCTCCT,pa1-R:CTAAGGCGAATTAAT-TCGCGGCCGCTTAAGTAGCACCGTTAAAAGCCAA-GTAGTTGACA;pa2-F:GGCTGAAGCTTACGTA-GAATTCGCTCCAGTTGTTGAACCAGCTCCA,pa2-R:CTAAGGCGAATTAATTCGCGGCCGCTTAAGT-AGCACCGTTGAAAGCCAAGTAGTTAAC,下划线标注为与载体pPIC9同源区段)。PCR反应体系:2×FastPfuPCR SuperMix 25 μL,pUC57-X1 μL,引物 各1 μL;ddH2O 22 μL(X表示基因编号)。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。同时,利用限制性内切酶EcoRⅠ、NotⅠ对表达载体pPIC9进行酶切,并回收PCR产物和酶切产物。回收后的表达载体pPIC9和携带同源区段的目的片段通过Assembly Kit试剂盒进行连接,连接产物转化E.coliTrans-T1感受态,转化菌液涂布于LB平板(含100 μg·mL-1氨苄青霉素)。 37 ℃培养箱过夜培养后,挑取转化子进行菌落PCR验证,反应体系:2×TaqPCR StarMix 10 μL,引物各1 μL,ddH2O 8 μL,挑取转化子加入上述反应体系中。反应条件同上。将阳性转化子送华大基因测序,正确的重组质粒命名为pPIC9-pa1、pPIC9-pa2。
1.2.4重组碱性蛋白酶表达载体在毕赤酵母中的表达及纯化 通过质粒小提中量试剂盒提取重组pPIC9-pa1、pPIC9-pa2质粒,利用限制性内切酶BglⅡ对其进行线性化处理,利用DNA纯化试剂盒进行纯化。取20 μL纯化后的线性化产物加入80 μL毕赤酵母感受态进行电击,设置Fungi档位为PIC模式。电击完毕后,立即加入200 μL预冷的1 mol·L-1山梨醇,悬浮菌液并转移至灭菌的EP管中,30 ℃静置复苏30~60 min。将菌液涂布在MD平板上,30 ℃培养48 h。随后将MD平板上生长的毕赤酵母单菌落转接到牛奶双层平板上,30 ℃培养72 h,若转化子表达蛋白酶酶活,则可水解牛奶双层平板中所含的牛奶,形成明显的水解圈。通过水解圈出现与否及其大小判断各阳性转化子的酶活,挑选最早出圈且水解圈最大的转化子进行摇瓶发酵。
将选中的重组酵母菌株接种到30 mL YPD液体培养基中,30 ℃、200 r·min-1活化培养48 h。随后按1%的接种量将其转接到300 mL的BMGY培养基中,30 ℃、200 r·min-1培养48 h,后将菌体转移到200 mL的BMMY培养基中,30 ℃、200 r·min-1诱导培养48 h,期间每隔24 h补加0.5%甲醇。发酵过程结束后,将菌液12 000 r·min-1离心10 min,收集上清,即为粗酶液。用截留分子量5 kD的膜包对粗酶液进行浓缩,并通过透析(截留分子量:3 kD)将粗酶液置换到pH 6.5的10 mmol·L-1磷酸氢二钠-柠檬酸缓冲液(buffer A)中实现脱盐。脱盐后的酶液通过阳离子交换柱(HiTrap SP HP 5 mL)进行纯化,利用buffer B (在buffer A基础上添加1.0 mol·L-1NaCl,并调节为pH 6.5)进行梯度(0~1.0 mol·L-1NaCl)洗脱,收集洗脱下来的具有酶活力的组份,利用SDS-PAGE验证其蛋白的纯度及分子量大小,并送目的条带至中国农业科学院蜜蜂研究所进行液相色谱-电喷雾离子化-质谱联用(liquid chromatography-electrospray ionization-tandem mass spectrometry,LC-ESI-MS)鉴定。蛋白浓度通过Easy Protein Quantitative Kit蛋白定量试剂盒进行定量。
1.2.5碱性蛋白酶的酶学性质研究 酶学性质研究所用酶液均达到电泳纯。缓冲体系:乳酸-乳酸钠缓冲体系(50 mmol·L-1,pH 3.0~5.0),磷酸盐缓冲体系(200 mmol·L-1,pH5.0~8.0),硼砂-氢氧化钠缓冲体系(100 mmol·L-1,pH 8.0~12.0)。
①最适pH及pH稳定性。利用pH 5.0~12.0的缓冲液将纯化后的PA1、PA2酶液稀释适当倍数,在60 ℃下,与处于相应pH的底物反应20 min,测定其活性,以探究PA1、PA2的最适pH。
将纯化后的PA1、PA2酶液在37 ℃、pH 3.0~12.0条件下预处理1 h后进行适当稀释,在60 ℃、pH 8.5条件下测定剩余酶活,以探究PA1、PA2的pH稳定性。
②最适温度及热稳定性。将纯化后的PA1、PA2酶液用100 mmol·L-1,pH 8.5的硼砂-氢氧化钠缓冲体系稀释适当倍数,测定二者在不同温度下(20~80 ℃)的酶活,以探究其最适温度。
将纯化后的PA1、PA2用100 mmol·L-1、pH 8.5的硼砂-氢氧化钠缓冲体系稀释到50 μg·mL-1,分别在50、55、60和65 ℃下进行热处理,处理时间分别为2、5、10、20、30和60 min,处理后的样品置于冰上以终止酶的热损失,冷却后稀释适当倍数,在60 ℃,pH 8.5条件下测定剩余酶活,以探究其热稳定性,以未处理酶液所测的活性为100%。
③对不同金属离子及化学试剂的反应。在酶促反应体系中加入不同金属离子及化学试剂(Na+、K+、Cu2+、Ca2+、Mg2+、Zn2+、Mn2+、Co2+、Ni2+、Fe3+、Pb2+、Cr3+、EDTA、β-巯基乙醇、SDS),终浓度为5 mmol·L-1,60 ℃、pH 8.5(100 mmol·L-1硼砂-氢氧化钠缓冲体系)条件下反应20 min,以探究不同金属离子及化学试剂对酶活性的影响。以未添加金属离子或化学试剂的反应体系所测酶活为100%。
④对不同蛋白酶抑制剂的反应。在酶促反应体系中分别加入蛋白酶抑制剂E-64(半胱氨酸蛋白酶抑制剂)、phenylmethylsulfonyl fluoride(PMSF,丝氨酸蛋白酶抑制剂)、ethylenediaminetetraacetic acid(EDTA, 金属蛋白酶抑制剂)及pepstatin A(天冬氨酸蛋白酶抑制剂),终浓度为1 mmol·L-1,60 ℃、pH 8.5(100 mmol·L-1硼砂-氢氧化钠缓冲体系)条件下反应20 min,以探究不同蛋白酶抑制剂对酶活性的影响。以未添加抑制剂的反应体系所测酶活为100%。
⑤动力学参数。分别配制浓度为0.5、0.8、1.0、1.3、1.5、2.0、2.5、5.0、8.0、10.0 mg·mL-1的酪蛋白为底物,对纯化后的PA1、PA2酶液适当稀释与不同浓度的底物在60 ℃、pH 8.5条件下反应10 min,测定酶活力。利用GraphPad Prism version 5.01 (La Jolla, CA)软件计算Km及Vmax,再根据酶的理论分子量计算kcat值。
1.2.6序列分析及结构建模 利用在线软件Signal P 4.0 (http://www.cbs.dtu.dk/services/SignalP/)预测其信号肽,Motif Scan(https://myhits.isb-sib.ch/cgi-bin/motif_scan/)预测其N端前肽;利用NetNGlyc 1.0 Server预测N糖基化位点;利用Vector NTI Advance 10.0 software分析PA1、PA2的蛋白理论分子量、等电点;SWISS-MODEL (https://www.swissmodel.expasy.org/)进行三级结构的建模及其活性位点分析。
2 结果与分析
2.1 碱性蛋白酶PA1及PA2序列分析
来源于真菌Cordycepsfumosorosea的碱性蛋白酶PA1全长380个氨基酸,预测其N端1~15个氨基酸为信号肽。根据毕赤酵母偏好性对去除信号肽外的365个氨基酸进行密码子优化,获得全长为1 098 bp的基因序列(包括终止密码子),提交至NCBI数据库,序列号为MK622909。胞外蛋白酶通常由三部分组成,信号肽、N端前肽及催化功能区,少部分蛋白酶前体还具有C端前肽或C端延伸区。酶原表达至胞外后,需加工去除N端前肽(或C端前肽)才可成为有活性的成熟酶[18],预测PA1的16~100位氨基酸构成其N端前肽。N-糖基化预测结果显示PA1含有1个潜在的N-糖基化修饰位点Asn270。PA1成熟蛋白理论蛋白分子量为28.6 kD,等电点为8.82。
来源于真菌Beauveriabassiana的碱性蛋白酶PA2全长为379个氨基酸,经过序列分析,其与PA1的一致性为80.0%,前1~15位氨基酸为信号肽,对除去信号肽外的364个氨基酸进行密码子优化,获得全长为1 095 bp的基因序列(包括终止密码子),优化后的序列提交至NCBI数据库,序列号为MK622910。PA2蛋白的16~99位氨基酸构成其N端前肽,加工去除N端前肽后的成熟蛋白的理论蛋白分子量大小为28.2 kD,等电点为9.10。不含潜在的N-糖基化修饰位点。
2.2 碱性蛋白酶PA1及PA2结构分析
PA1与已有晶体结构的Lecanicilliumpsalliotae来源的碱性蛋白酶Ver122(PDB登录号:3F7M)一致性为82.44%。以3F7M为模板对PA1进行同源建模(图1)。这是一个典型的枯草杆菌类蛋白酶的结构,由两层α-螺旋结构以及夹在中间的一层β-折叠结构构成。第五个β-折叠和第四个α-螺旋之间以及第六个β-折叠和第五个α-螺旋之间的两段肽段形成底物结合区域,底物结合区域向内存在三个催化位点,分为别Asp 141、His171和Ser326。PA1成熟蛋白中共有5个Cys,其中Cys136-Cys225和Cys280-Cys351分别形成两对二硫键,Cys175并未形成。此外,在PA1成熟蛋白中还存在一个保守的Ca2+结合位点,残基Pro277、Val279、Asp302与Ca2+形成稳定的作用网络。
与PA1一样, PA2与已有晶体结构的Lecanicilliumpsalliotae来源的碱性蛋白酶Ver122(PDB登录号:3F7M)的一致性最高,为79.21%。以3F7M为模板对PA1进行同源建模(图1)。根据同源建模结果,PA2的蛋白结构与PA1相似,都是典型的枯草杆菌类蛋白酶结构,底物结合位置、催化三联体、二硫键及钙离子结合位点的分布均十分相似。
2.3 碱性蛋白酶PA1及PA2的表达与纯化
重组表达载体pPIC9-pa1及pPIC9-pa2在毕赤酵母GS115中成功实现异源表达,根据牛奶水解圈的大小及出圈先后,从36个转化子中筛选出酶活较高的一株进行摇瓶发酵。摇瓶发酵获得的粗酶液经过截留分子量为5 kD膜包浓缩后,进一步通过利用阳离子交换柱进行纯化,纯化后的蛋白分子量大小及其纯度通过SDS-PAGE电泳的验证(图2)。在25~35 kD处分别有单一的蛋白条带,这与PA1和PA2的理论分子量大小相符。在N糖基化预测时表明蛋白PA1仅存在一个潜在糖基化位点,PA2没有潜在糖基化位点,说明该蛋白在酵母表达时的N糖基化程度低或者无N糖基化修饰。
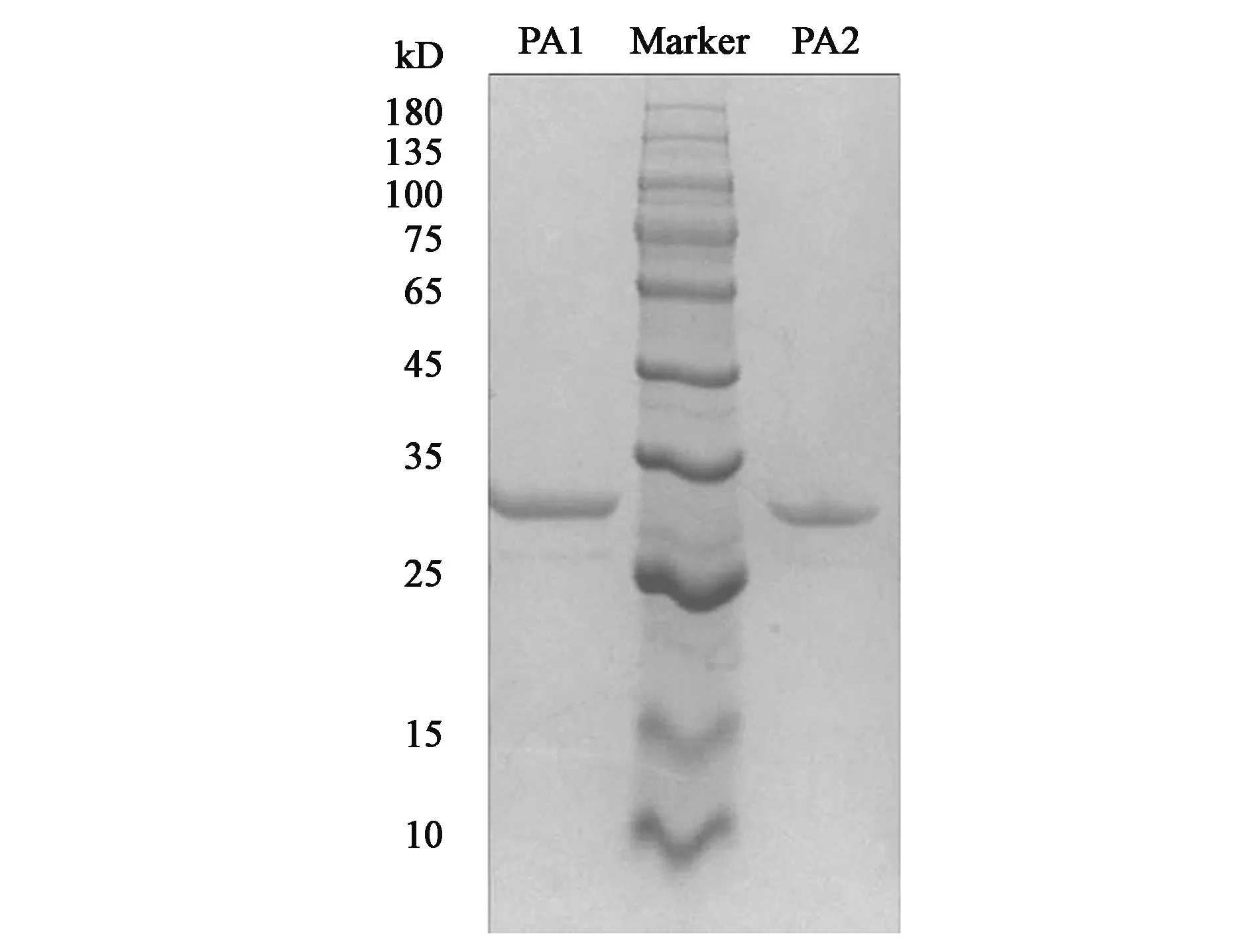
图2 PA1及PA2纯化产物SDS-PAGEFig.2 SDS-PAGE analysis of purified PA1 and PA2
2.4 碱性蛋白酶PA1及PA2的酶活测定
对于挑选获得的PA1及PA2转化子进行摇瓶发酵,测定结果显示,在60 ℃、pH 8.5条件下,PA1的粗酶液酶活为(218.4±2.7)U·mL-1,根据诱导时间,其平均生产力可以换算为4.55 U·mL-1·h-1。同样条件下,PA2的粗酶液酶活为(246.5±3.5) U·mL-1,其平均生产力可以换算为5.14 U·mL-1·h-1。以酪蛋白为底物,纯化后的PA1及PA2比活分别为(2 705.3±31.9)和(2 242±39.5)U·mg-1。
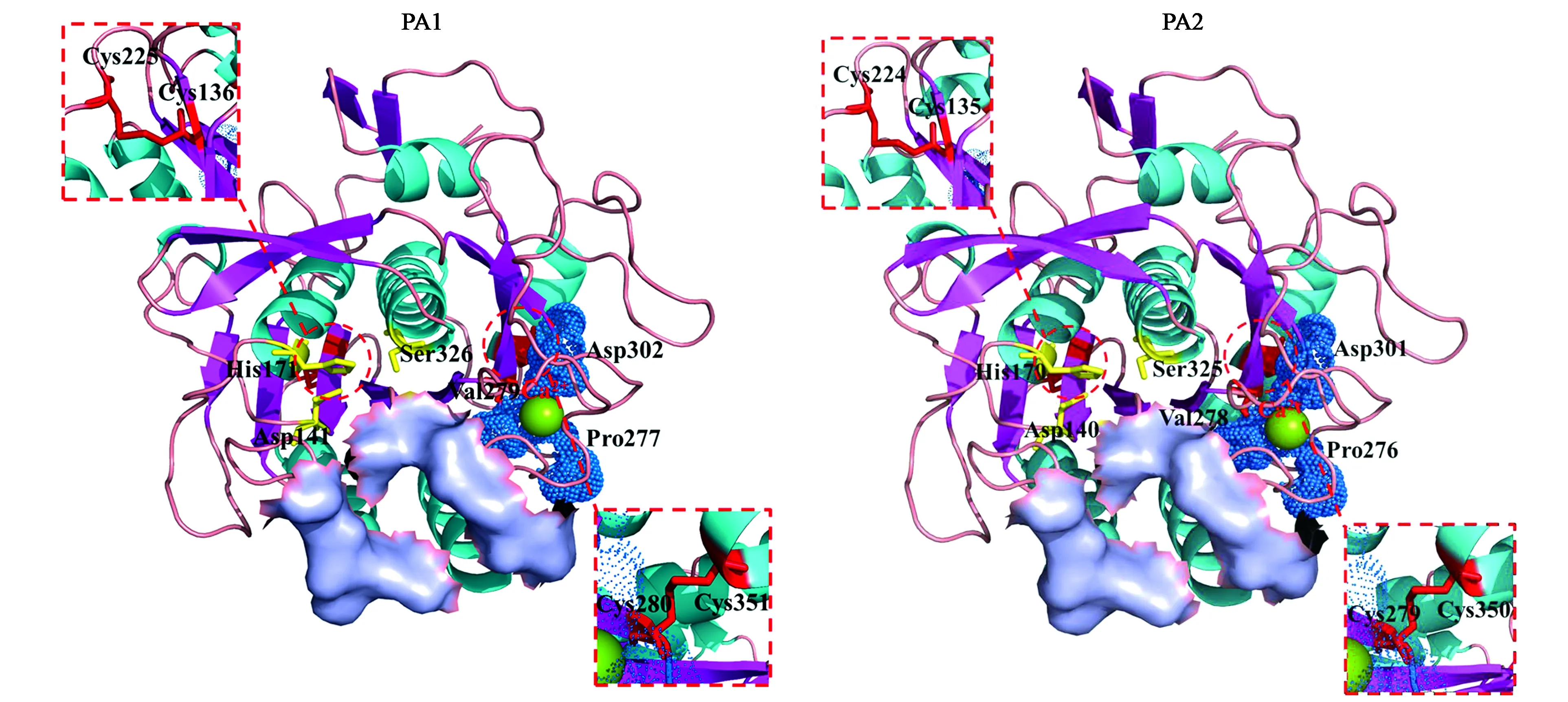
注:黄色标注的氨基酸为催化三联体;绿色球体为Ca2+;蓝色球体为与Ca2+结合的氨基酸;紫色标注部分为底物结合位置;红色标注部分为二硫键。Note: Yellow labeled amino acids are catalytic triads; green spheres are Ca2+ atom; blue spheres are the amino acids bound to Ca2+; purple surfaces are the substrate binding position; the sites marked in red are disulfide bonds.图1 PA1及PA2三级结构Fig.1 Putative modeled structure of PA1 and PA2
2.5 pH对碱性蛋白酶PA1及PA2的影响
纯化后的PA1最适pH为8.5(图3),整体嗜碱,在pH 7~10之间酶活均保持在50%以上,其中pH 8.0~9.5条件下,更是保持在90%以上。当pH上升至10.5后,酶活明显降低,pH 12.0条件下,基本检测不到蛋白酶活性。尽管属于碱性蛋白酶,PA1在偏酸条件下仍能检测到一定活性,pH 6.0时仍保持30%以上的活性。与PA1相同,纯化后PA2的最适pH也为8.5(图3),整体嗜碱,但相较于PA1,PA2的整体作用范围稍向酸偏移,在pH 10.0条件下,仅保持30%左右的酶活,较PA1低了30%左右,而在pH 6.0条件下,PA2保持40%以上的活性,较PA1高近10%。
PA1和PA2都具有良好的pH稳定性(图3),在pH 4.0~11.0条件下处理1 h后,PA1仍能保持80%以上的剩余酶活,而PA2的剩余酶活可以保持85%以上,这充分说明PA1和PA2的pH稳定性范围十分宽泛。
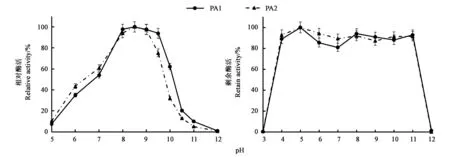
图3 PA1及PA2最适pH和pH稳定性Fig.3 Optimum pH and pH stabilities of PA1 and PA2
2.6 温度对碱性蛋白酶PA1及PA2的影响
PA1的最适温度为60 ℃(图4),最适温度以下,酶活性随温度变化趋势较为平缓,反应温度在40 ℃时,仍保持40%以上的酶活。当反应温度高于60 ℃后,酶活性随温度变化趋势相对陡峭,尽管65 ℃条件下,仍能保持近50%的酶活,但当温度达到70 ℃时,仅保持10%左右的活性。与PA1相同,PA2的最适温度也为60 ℃,酶活性随温度变化的整体趋势与PA1相似。在目前已报道的真菌来源的碱性蛋白酶中, PA1及PA2属于真菌来源的碱性蛋白酶中的高温酶。
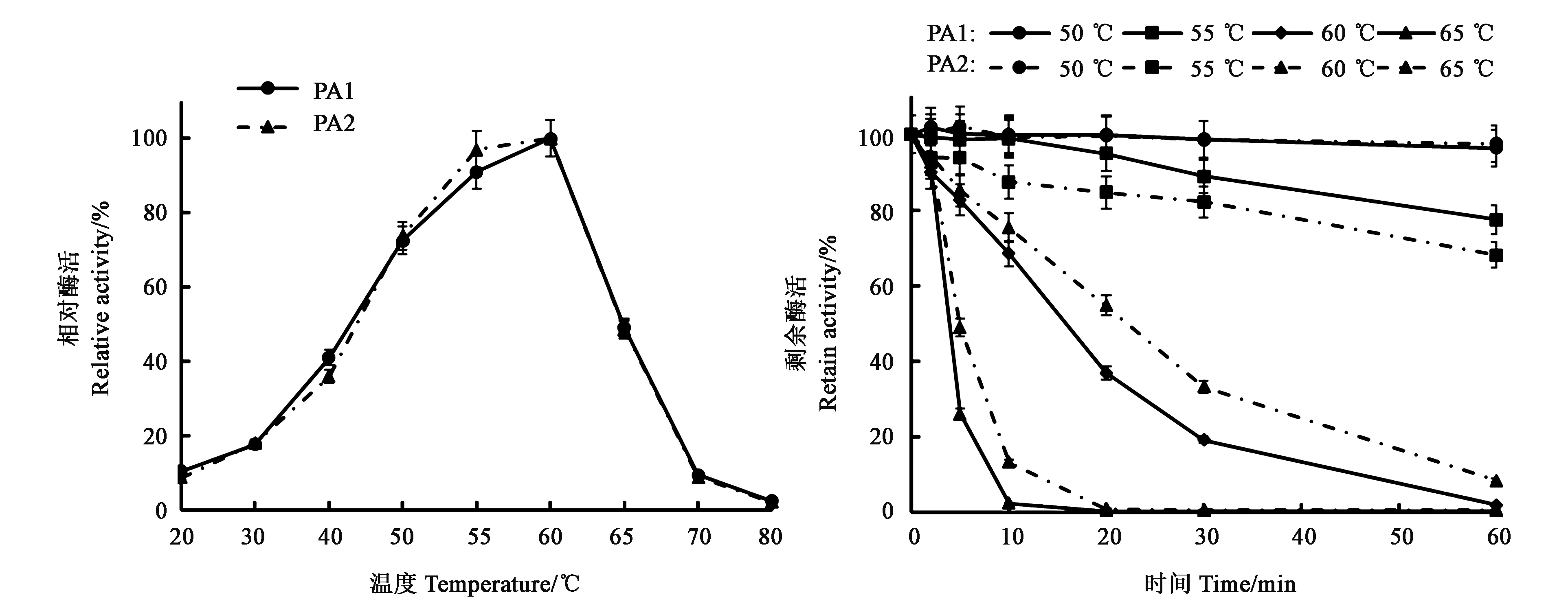
图4 PA1及PA2最适温度和热稳定性Fig.4 Optimum temperature and thermostability of PA1 and PA2
PA1的温度稳定性也较好(图4),在50 ℃条件下高度稳定,处理1 h几乎没有酶活损失;55 ℃处理1 h,仍保持近80%的剩余酶活;在60 ℃的条件下处理10 min后还有70%左右的剩余酶活,30 min时就仅剩20%左右的酶活;当处理温度达到65 ℃时,酶活降低比较明显,处理10 min后,几乎检测不到活性。PA2的温度稳定性也较好,在50 ℃条件处理1 h几乎没有酶活损失;与PA1相比,在相对低温的条件下,PA2的稳定性略低,55 ℃条件下处理1 h,PA2的剩余酶活比PA1低10%左右。但在相对高温的条件下,PA2的稳定性优于PA1,PA2在65 ℃条件下处理10 min后,仍能检测到13%左右的活性。
2.7 金属离子和化学试剂对碱性蛋白酶PA1及PA2的影响
从表1可以看出,Ni2+和Mn2+对PA1及PA2有明显的促进作用,Zn2+、Co2+和Cu2+对PA1及PA2的抑制作用明显,其中Cu2+的抑制效果最为严重,终浓度5 mmol·L-1Cu2+存在的情况下PA1和PA2几乎损失90%左右的酶活。其他金属离子对PA1及PA2活性也有程度不同的作用。EDTA对PA1及PA2的酶活影响几乎没有影响,在表面活性剂SDS存在的情况下,PA1及PA2的酶活性仍能保持60%,还原剂β-巯基乙醇存在时,PA1及PA2的酶活性仍能保持近90%,这二者作为常用的工业添加剂,PA1及PA2在其存在的情况下仍能保持不低的活性,这表明PA1及PA2具有一定的工业应用潜力。
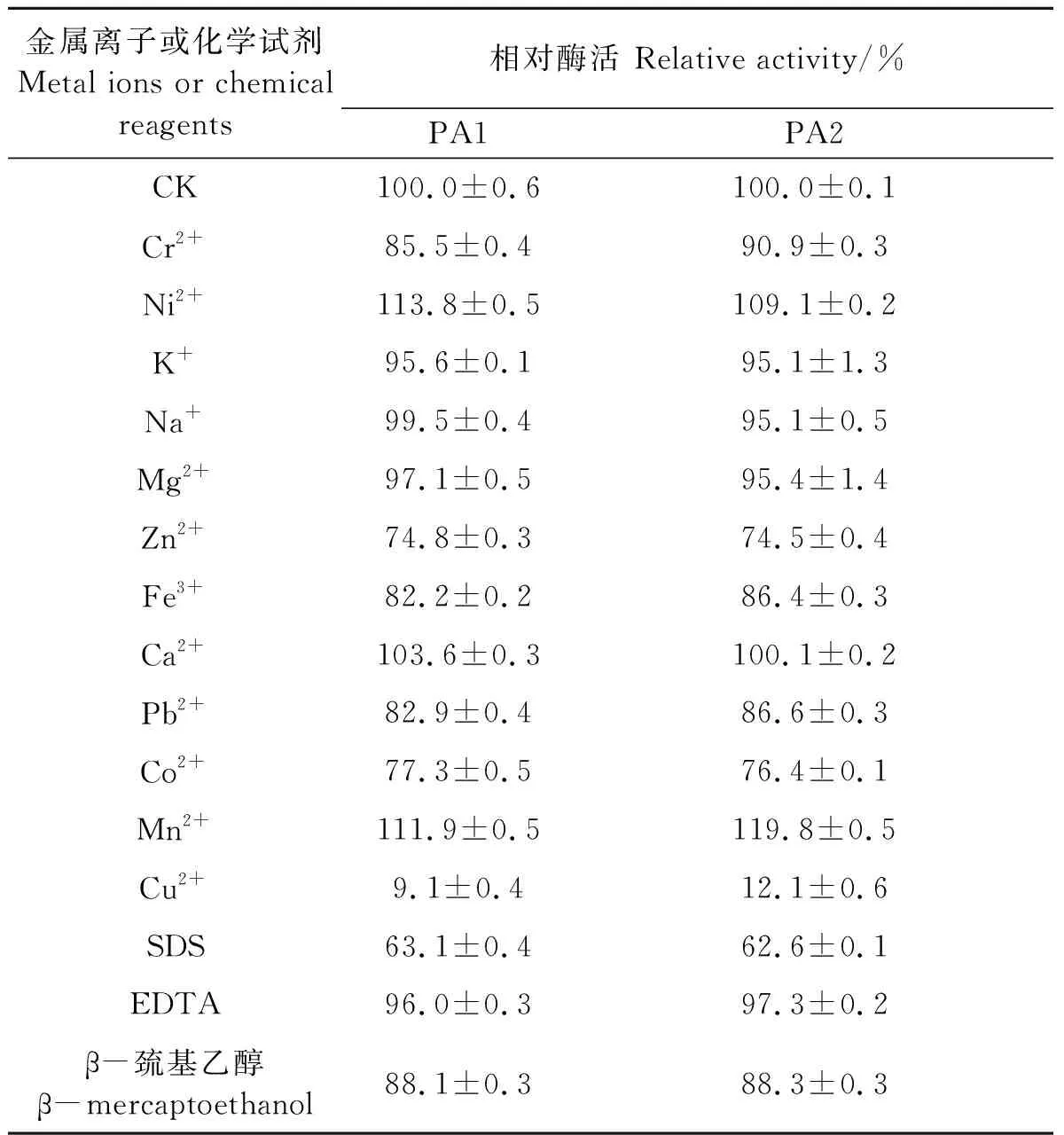
表1 金属离子及化学试剂对PA1及PA2活力的影响Table 1 Effect of metal ions and chemical reagents on the activity of PA1 and PA2
2.8 不同蛋白酶抑制剂对碱性蛋白酶PA1及PA2的作用
如图5所示,半胱氨酸蛋白酶抑制剂E-64、金属蛋白酶抑制剂 EDTA及天冬氨酸蛋白酶抑制剂 Pepstatin A对PA1及PA2几乎没有抑制作用,而在丝氨酸蛋白酶抑制剂PMSF存在的情况下,PA1及PA2酶活性基本完全丧失,该结果进一步证明PA1及PA2属于丝氨酸蛋白酶。
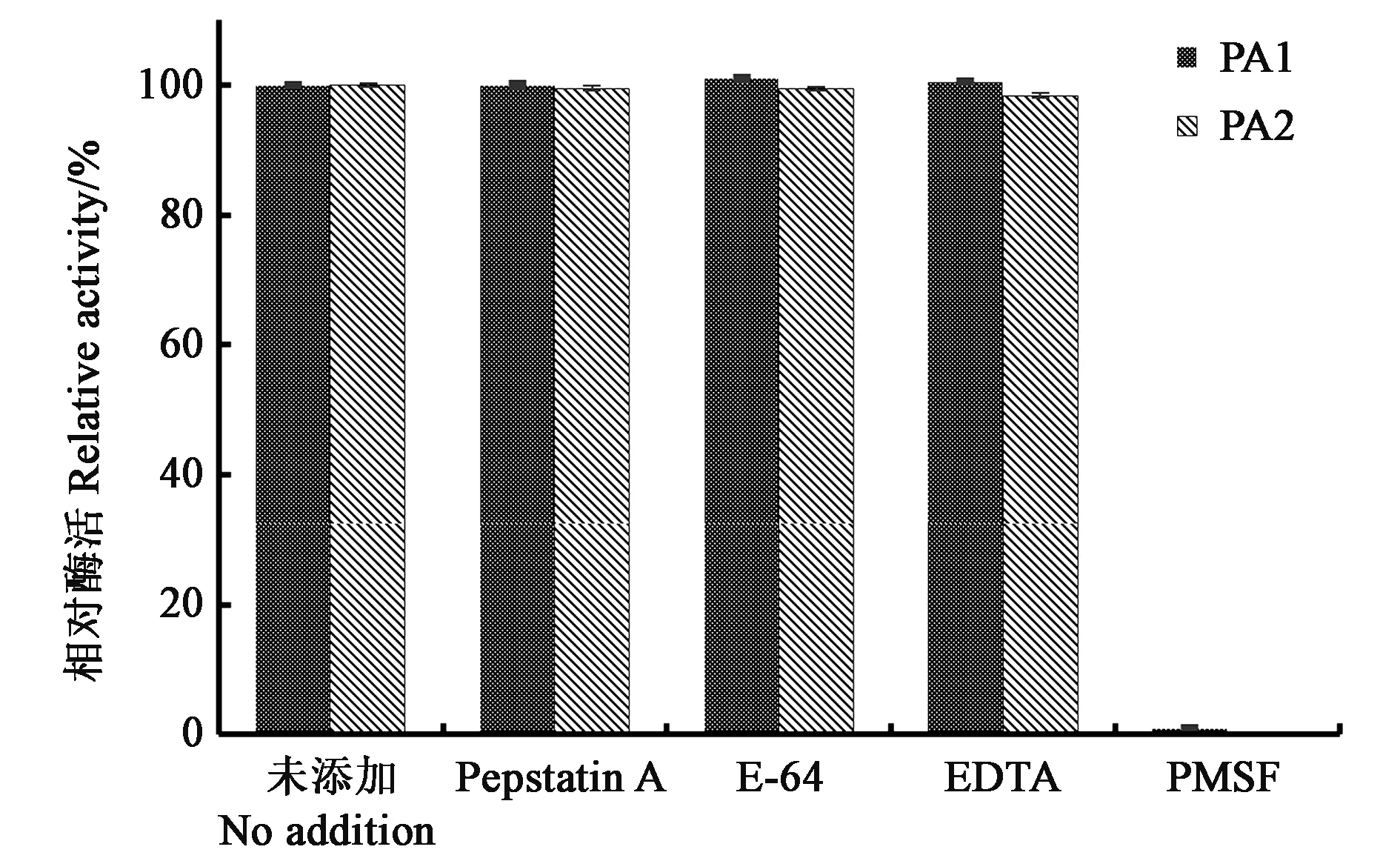
图5 蛋白酶抑制剂对PA1及PA2活力的影响Fig.5 Effect of protease inhibitors on the activity of PA1 and PA2
2.9 碱性蛋白酶PA1及PA2的动力学常数
以酪蛋白为底物,在60 ℃、pH 8.5的条件下,测得碱性蛋白酶PA1的Km值为(3.46±0.23) mg·mL-1,Vmax值为(4 283.0±56.4) μmol·min-1·mg-1,进一步计算得,其kcat值为2 027.8 s-1,催化效率kcat/Km为585.6 mL·s-1·mg-1。相同条件下测定PA2的Km值为(4.39±0.58) mg·mL-1,Vmax值为(4 596.0±68.9) μmol ·min-1·mg-1,进一步计算得,其kcat值为2 150 s-1,催化效率kcat/Km为490.3 mL·s-1·mg-1。
3 讨论
本文以Parengyodontiumalbum来源的优质碱性蛋白酶Proteinase K的蛋白序列出发,通过序列和进化分析,获得真菌Cordycepsfumosorosea和Beauveriabassiana来源的碱性蛋白酶基因pa1及pa2。其中pa1尚无功能验证相关报道,对于pa2,2014年,Borgi等[19]曾通过原酶纯化手段获得对其所表达蛋白,并确定为碱性蛋白酶,但尚未发现对其二者进行异源表达及性质研究的报道。目前,已报道的用于碱性蛋白酶异源表达的宿主菌有大肠杆菌、枯草芽孢杆菌、毕赤酵母、解脂耶氏酵母,酿酒酵母及鲁氏酵母。本文利用毕赤酵母表达系统对pa1及pa2进行异源表达,按照毕赤酵母偏好性进行密码子优化,去除了其二者的天然信号肽,与pPIC9表达载体连接,采用载体上存在α-factor信号肽引导实现跨膜转移。重组菌株P.pastorisGS115 PA1及P.pastorisGS115 PA2在摇瓶发酵水平上,PA1平均生产力可以换算为4.55 U·mL-1·h-1,PA2平均生产力可以换算为5.14 U·mL-1·h-1。二者的表达水平比大多数报道的同类型重组菌株要高,如来源于Aspergillusoryzae的Alp在P.pastorisGS115中实现异源表达,平均生产力为0.4 U·mL-1·h-1[16];来源于BacillusstearothermophilusFI的F1在P.pastorisGS115中实现异源表达,平均生产力为0.6 U·mL-1·h-1[20];来源于BacilluscereusYSQ08的aprA在P.pastorisX33中实现异源表达[21],平均生产力为1.7 U·mL-1·h-1。2018年,Ke等[17]实现了Aspergillussojae来源的碱性蛋白酶Ap在PichiapastorisKM71中的高效表达,72 h发酵后测得酶活为400.4 U·mL-1,平均生产力约为5.6 U·mL-1·h-1,相较于本文所报道的PA1及PA2略高,但分析诱导过程,其所添加的甲醇量为本实验的两倍。因此,后续工作中可通过优化P.pastorisGS115 PA1及P.pastorisGS115 PA2的发酵工艺参数,进一步提高其表达水平。
真菌来源的碱性蛋白酶的最适温度一般较低,多数处于35到50 ℃,如来源于Aspergillusfumigatus的TKU003的最适温度为40 ℃[22],来源于Aspergillusustus的NIOCC#20的最适温度为45 ℃[23]。本研究中PA1及PA2的最适温度均为60 ℃,与近年来报道的一些真菌来源的高温碱性蛋白酶相一致,如来源于Streptomycesambofaciens.的DP2[24]和来源Engyodontiumalbum的碱性蛋白酶[25],因此认为PA1及PA2属于高温碱性蛋白酶。除最适温度较高以外,PA1及PA2也具有较好的热稳定性,在50 ℃条件下处理1 h几乎没有酶活损失,60 ℃环境中,PA1及PA2处理30 min后仍具有一定活性。多数碱性蛋白酶的热稳定性较差,如来源于Aspergillusclavatus的碱性蛋白酶在50 ℃条件下处理18 min,剩余50%的活性[26],来源于Beauveriabassiana的碱性蛋白酶在50 ℃条件下处理5 min,仅剩余40%左右的活性[27]。从结构角度分析,PA1及PA2的蛋白结构中还存在一个Ca2+结合位点,Ca2+对大多数碱性蛋白酶的热稳定性有增强作用[28-29]。
已报道的真菌来源的碱性蛋白酶最适pH从7.5到11均有分布,如来源于Beauveriabassiana的BBP的最适pH为7.5[30],来源于Engyodontiumalbum的碱性蛋白酶最适pH为11.0[25]。PA1及PA2的最适pH为8.5,与早先报道的最适pH分布在8.0~9.5的真菌来源的碱性蛋白酶相一致,如Aspergillusparasiticus[31]、Aspergillusfumigatus[32]及Aspergillusclavatus[26]来源的碱性蛋白酶,符合碱性蛋白酶的pH活性范围。此外,PA1及PA2还具有极好的pH稳定性,大部分碱性蛋白酶在中性及碱性环境中稳定,如来源于AspergillusclavatusES1的碱性蛋白酶蛋白酶在4 ℃下处理1 h,仅在pH 8.0~9.0的环境中保持稳定,pH 6及pH 10环境中酶活损失50%左右[33];来源于AspergillusnidulansHA-10的碱性蛋白酶在37 ℃条件下处理1 h,其活性稳定范围为pH 6.0~10.0,在pH 4环境中仅保持30%左右的活性[34]。目前,也有一些真菌来源的碱性蛋白酶在酸性环境中保持一定的稳定性,如Fusariumsp. BLB来源的碱性蛋白酶在37 ℃ 1 h的处理条件下,在pH 3.0~9.0的环境中保持稳定,尽管在酸性环境中具有良好的稳定性,但其在碱性条件下的稳定较差,pH 11.0的环境中酶活几乎完全损失[35]。PA1及PA2在37 ℃ 1 h的处理条件下,在pH 4.0~11.0的环境中均保持80%以上的活性,呈现出良好的稳定性。
综上所述,来源于真菌Cordycepsfumosorosea和Beauveriabassiana的碱性蛋白酶基因pa1和pa2与pPIC9表达载体连接,经转化后成功实现在毕赤酵母中的高效表达。对纯化后的PA1及PA2的酶学性质进行测定,确定其二者的最适pH均为8.5,最适温度均为60 ℃,都具有良好的pH稳定性和温度稳定性,对于表面活性剂和还原剂也具有一定的耐受性,表明二者具有一定的工业应用潜力。在后续工作中,可对二者的应用价值展开进一步研究,如可将其应用于加酶洗涤剂、羽毛降解、皮革制造、肉质嫩化等领域,分析比较其各自在实际生产中的优劣,更好地发挥其本身价值,丰富碱性蛋白酶资源,为工业生产提供更多选择。

