水稻短胚芽鞘基因SCP1的图位克隆
王芳芳, 李宇翔, 梁宇航, 黄荣峰, 张玉琼, 秦华*
(1.安徽农业大学生命科学学院, 合肥 230036; 2.中国农业科学院生物技术研究所, 北京 100081)
水稻是重要的粮食作物,作为半水生作物,其需要长期对抗低氧环境。水稻黄化苗的胚芽鞘能够在低氧、无光环境下保护真叶,胚芽鞘通过伸长使真叶尽快接触到氧气和光,对于水稻幼苗的形态建成尤其重要[1]。胚芽鞘伸长受到诸多因素影响,植物激素在此过程中发挥着重要作用[2-3]。
水稻G蛋白α亚基(OsRGA1)参与激素信号转导及生长发育和耐逆性调控。osrga1突变体表现出植株矮化、小粒、穗直立、耐盐、耐旱等表型[4-5]。近些年通过正向遗传学等方法已克隆了8个OsRGA1等位突变体,其中d1突变体耐旱性比野生型显著增强,在连续干旱14 d的条件下,d1突变体叶片依然呈现深绿的状态,而野生型叶片早已萎蔫发黄[4]。sd58是OsRGA1的另一个等位突变体,与野生型相比,sd58突变体耐盐性更强,进一步研究表明,OsRGA1通过调控盐胁迫条件下水稻体内活性氧的积累来提高水稻的耐盐性[5]。油菜素内酯处理d1突变体,发现其叶夹角和胚芽鞘对油菜素内酯敏感性降低,说明OsRGA1可能参与油菜素类固醇信号的转导[6]。除此之外,OsRGA1位于赤霉素信号转导关键组分SLR1的下游,参与GA 信号的转导[7]。在水稻中敲除OsRGA1将抑制乙烯诱导的表皮细胞死亡[8-9],说明OsRGA1参与乙烯信号的传递。
乙烯作为一种重要的植物激素,在植株的生长发育及应对外界环境胁迫过程中发挥着重要作用[10],植物内源乙烯含量主要取决于乙烯合成。乙烯的合成是以甲硫氨酸(Met)作为前体在S-腺苷甲硫氨酸合成酶(S-adenosylmethionine synthetase, SAMS)的催化作用下生成SAM,SAM进一步由1-氨基环丙烷羧酸合成酶 (1-aminocyclopropane-1-carboxylate synthase,ACS) 催化生成 5′-甲硫基核糖(5′-methylthiribose,MTR)和1-氨基环丙烷羧酸(1-amino-cyclopropanecarboxylic acid,ACC),ACC在ACC氧化酶(ACO)作用下生成乙烯[11],该步骤是整个乙烯合成过程的限速步骤[12]。已有研究表明,对乙烯合成基因的调控主要集中在转录水平和转录后水平,水淹可以诱导OsACS1、OsACS5和OsACO1基因的表达,从而促进胚芽鞘生长和节间伸长来使机体免受损害[13-14];OsEOL1和OsEOL2都编码E3连接酶,均可与OsACS5相互作用,促进其泛素化并加速其降解,从而降低体内乙烯含量[15]。乙烯合成后,会通过相应的乙烯信号转导途径进行传递,调控下游乙烯响应基因,从而调节植株生长发育和应对外界生物和非生物胁迫[16]。水稻中乙烯能够抑制黄化苗根生长和促进胚芽鞘伸长,即典型的“二重反应”[17]。目前利用此“二重反应”,对水稻黄化苗外源施加乙烯,已经筛选和鉴定出很多乙烯响应缺陷突变体,如mhz2[18]、mhz3[19]、GY1[20]、mhz4[21]、mhz5[22]、mhz6[3]、mhz7[2]等。但是对本身具有组成型乙烯表型即与内源乙烯合成相关的突变体克隆较少。
虽然关于OsRGA1已有很多报道,但是该基因是否参与调控乙烯的合成还并不清楚。本研究利用水稻的乙烯“二重反应”从本课题组构建的水稻突变体库中筛选到一个短胚芽鞘突变体(shortcoleoptile1,scp1),其乙烯合成基因表达水平及乙烯释放量均低于野生型,并且表现出较强的耐盐和耐旱性。通过图位克隆将突变基因定位在5号染色体上32.01 kb的区间内,扩增与测序发现该区间内OsRGA1基因存在大片段缺失,从而导致该基因功能缺失。本研究结果为探究OsRGA1调控水稻乙烯合成,解析影响胚芽鞘的生长及耐逆性的分子机理奠定了基础,有助于丰富水稻体内乙烯合成的调控机制。
1 材料与方法
1.1 试验材料
1.1.1供试材料 野生型华占(Huazhan,HZ)与中花11(Zhonghua11,ZH11)水稻种子由本课题组保存,并创建3 000份以HZ为背景且用钴诱变后的水稻突变体库,筛选获得scp1突变体,创建用于克隆SCP1基因的F2群体。d1突变体由中国科学院植物研究所种康研究员惠赠,并由本实验保存和繁殖。
1.1.2种植条件 用于农艺性状调查及基因定位的群体均在河北廊坊试验基地种植。用于盐及干旱处理的幼苗种植于小方盒中土培,放在28 ℃温室中(16 h光/8 h 暗),生长14 d后分成三组,对照组正常条件下生长,盐处理组加入适量150 mmol·L-1NaCl溶液生长7 d,干旱处理组保持干旱状态生长7 d。用于观察胚芽鞘表型的幼苗种植于放在水中的铁丝网架上,保持水面刚好接触到种子,放入28 ℃避光生长3~5 d左右。
1.1.3试验试剂 用于提取RNA的Trizol试剂盒购自康为世纪生物技术有限公司; 用于反转录的试剂盒购自南京诺唯赞有限公司;用于荧光定量 PCR的SYBR Green Mix购自依联轩生物科技有限公司,用于普通PCR的Mix购于擎科生物技术有限公司。
1.1.4主要仪器及设备 用于培养水稻幼苗的GP-01光照培养箱购自湖北黄石恒丰医疗器械有限公司;用于测定乙烯含量的GC-2014气相色谱仪购自日本岛津公司; Bio-Rad iQ5实时荧光定量PCR仪购自于美国伯乐公司;用于扩增DNA序列的ETC-811 PCR仪购自于北京东胜创新生物科技有限公司。
1.2 突变体筛选
将辐射诱变的每一份突变体材料各取出30粒种子,37 ℃浸种24 h,选取萌动一致的种子种在不锈钢网架上,放入塑料盒中,加水至液面刚接触到种子,置于黑暗条件下,28 ℃培养3~5 d,筛选出胚芽鞘较野生型过长或过短的突变体,用于后续研究。
1.3 乙烯的测定
在150 mL的透明玻璃小瓶中倒入50 mL 1/2 MS固体培养基[23],待培养基冷却后将已萌动的水稻种子均匀种在瓶子里,光照培养箱(28 ℃,光照16 h/黑暗8 h )生长3 d后用封口膜将瓶口密封,继续培养12 h,从每个小瓶中抽取1 mL气体,用气相色谱仪测定瓶内乙烯含量[24]。
1.4 表型分析及农艺性状统计
将scp1突变体材料和野生型HZ浸水后放在37 ℃培养箱中,待萌动后,挑取萌动一致的种子种在不锈钢网架上,暗培养3 d,观察并统计胚芽鞘长度。选取土培14 d左右的幼苗进行拍照并统计株高;成苗株高、节间长与分蘖数等农艺性状在大田中选取成熟期植株进行拍照和统计;在种子成熟后对其称重,并拍照统计粒形与千粒重;重复3次。
1.5 实时荧光定量PCR
取暗下培养3 d幼苗的胚芽鞘,提取总RNA,反转录成cDNA作为实时荧光定量PCR的模板,检测目的基因的表达。PCR反应体系:cDNA模板1 μL,SYBR Green Mix 10 μL,正反向引物各0.3 μL(表1),双蒸水8.4 μL。反应程序: 95 ℃ 10 min;95 ℃ 10 s,58 ℃ 30 s,72 ℃ 20 s,45个循环;以每30 s上升0.5 ℃的速率从55 ℃升至95 ℃来作为溶解曲线程序。
1.6 耐盐性和耐旱性实验
将在温室生长14 d的HZ和scp1幼苗分成三组,对照组浇自来水,盐处理组浇含有150 mmol·L-1NaCl的水溶液,干旱处理组不浇水保持干旱状态,每日观察叶片萎蔫和黄化情况,当同组内材料之间存在显著差异时拍照并复水,复水培养7 d后统计成活率,重复3次。
1.7 基因定位
在实验田中将scp1和ZH11杂交获得F1,加繁一代得到F2群体,筛选F2群体中具有短胚芽鞘表型的单株,用CTAB法提取基因组DNA后,随机选取20份所提取的DNA等浓度混匀作为DNA混池。分别以混池DNA及HZ和ZH11的DNA作为模板,利用本实验室已鉴定的覆盖水稻全基因组的SSR和Indel标记作为引物(表1)进行RCR扩增。扩增体系:DNA模板1 μL,2× PCR Mix 10 μL,正反向引物各0.5 μL,双蒸水8 μL。扩增程序:95 ℃ 5 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 15 s,共32个循环;72 ℃ 5 min。PCR产物用浓度为4% (质量体积份数) 的琼脂糖凝胶进行电泳。通过统计交换率确定SCP1基因所在的染色体及区间。通过国家水稻数据库RAP-DB(https://rapdb.dna.affrc.go.jp/index.html)查找该区域存在的功能基因,用NCBI数据库(https://www.ncbi.nlm.nih.gov/)设计引物扩增候选基因并测序,确定突变基因。
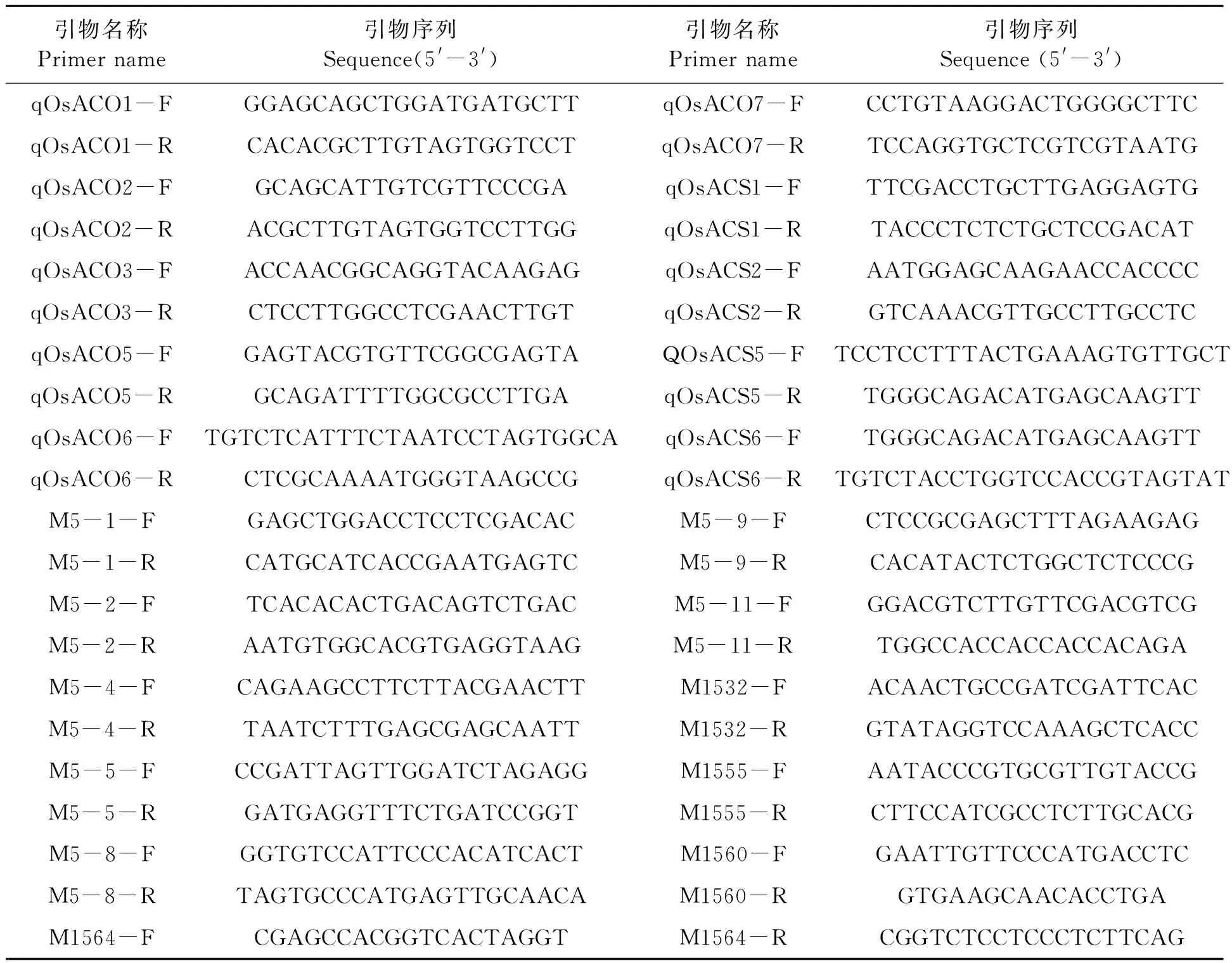
表1 实验所用引物Table 1 Primers used in the study
2 结果与分析
2.1 SCP1调控胚芽鞘的生长及乙烯合成
从图1可以看出,scp1突变体胚芽鞘长度只有对照的57%左右。已有研究表明,乙烯促进胚芽鞘的伸长[17]。为了探究scp1短胚芽鞘的表型是否是由于乙烯合成减少所致,测定scp1与HZ的乙烯释放量,发现scp1乙烯释放量明显低于HZ,进一步利用qPCR检测scp1和HZ胚芽鞘中乙烯合成基因的表达,发现在scp1突变体中乙烯合成基因ACO5、ACO6、ACS2、ACS5、ACS6表达水平均明显降低。以上结果说明,scp1突变体的短胚芽鞘表型是由于体内乙烯合成量减少导致的。
2.2 scp1突变体农艺性状分析
从表2和图2可以看出,scp1突变体除了短胚芽鞘的表型之外,在幼苗期和成熟期株高也显著低于野生型,其中幼苗期scp1突变体株高只有HZ的一半。测量成熟期植株的节间长度发现,scp1突变体各节间长度均短于HZ,第三节间和第五节间最为显著。scp1突变体的粒长只有HZ的51%左右,但粒宽没有明显差异,千粒重明显低于HZ。这些结果表明,SCP1影响株高、粒形和产量。

图2 scp1突变体的农艺性状Fig.2 Agronomic traits analysis of scp1 mutants
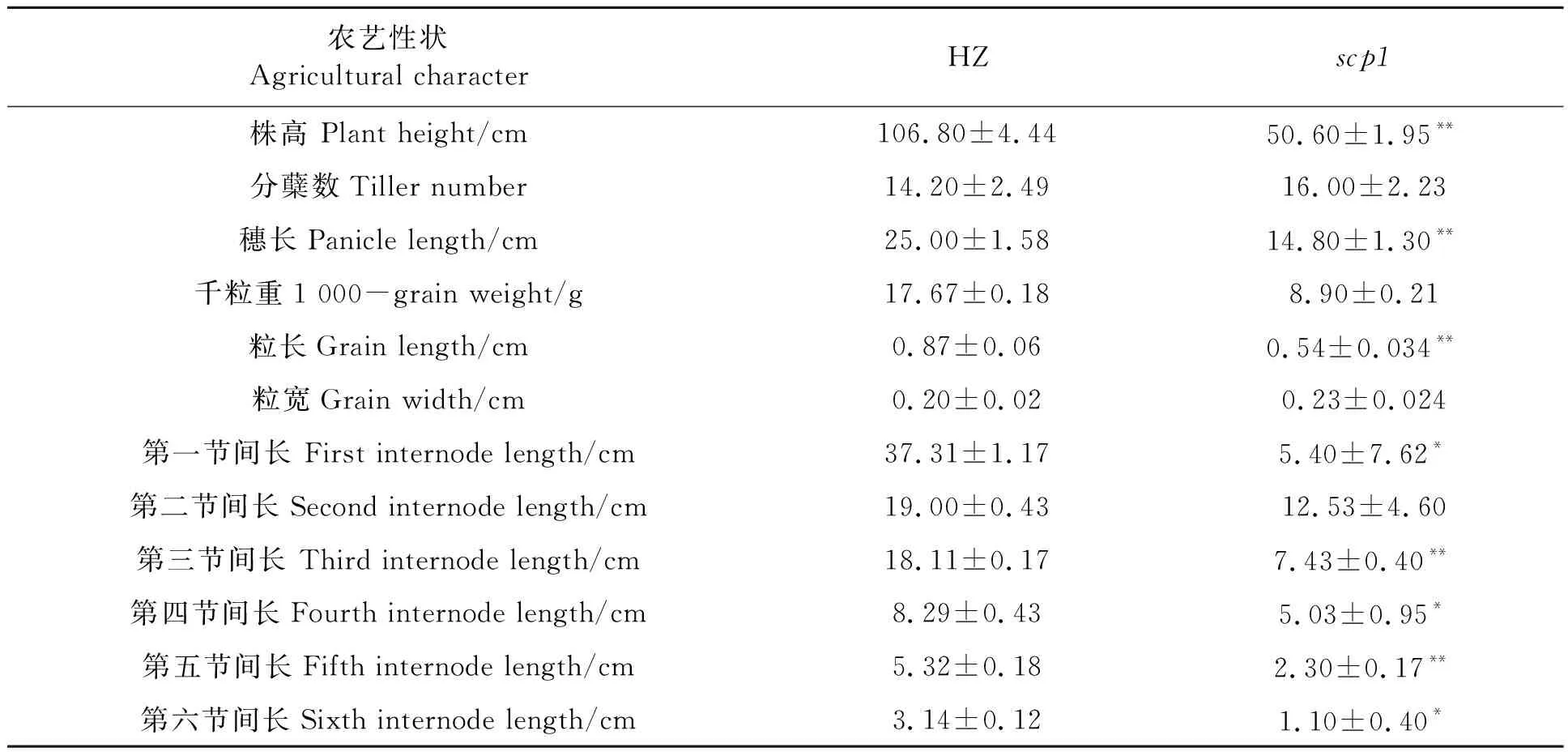
表2 scp1突变体农艺性状Table 2 Agronomic traits of scp1 mutants
2.3 SCP1参与盐和干旱胁迫应答
盐和干旱是两种常见的非生物胁迫,严重影响水稻产量,因此,提高水稻耐盐性和耐旱性具有重要的意义。乙烯作为重要的植物激素,在调控植物耐盐性[3]和耐旱性[25]中发挥重要作用。SCP1影响乙烯合成,表明SCP1可能参与调控水稻的耐盐性和耐旱性。对土培14 d的幼苗进行盐处理和干旱处理,结果(图3)发现,两个处理组内scp1突变体的萎蔫率明显低于HZ,且HZ的叶色发黄而scp1突变体叶片仍旧保持绿色且舒展。复水后scp1突变体成活率显著高于HZ。以上结果表明,SCP1负调控水稻的耐盐性和耐旱性,而这种调控作用可能是由于scp1突变体体内乙烯合成降低导致的。
2.4 scp1突变体功能基因的图位克隆
在scp1与ZH11杂交后代的F2群体中筛选具有短胚芽鞘表型的单株,统计分离比,短胚芽鞘与正常胚芽鞘的比例近1∶3,说明该突变表型是单基因控制的隐性遗传。提取具有短胚芽鞘表型单株的DNA,利用图位克隆技术将SCP1基因定位在5号染色体上两个分子标记(M1560与M1564)之间,该区间范围32.01 kb。在水稻数据库(https://rapdb.dna.affrc.go.jp/index.html)中查询,发现此区间内存在5个功能基因(图4),其中3个编码未知蛋白(LOC_ Os05g26860、LOC_Os05g26870、 LOC_Os05g26880),1个编码Dna J伴随蛋白(LOC_Os05g 26902),还有1个已克隆的基因OsRGA1(LOC_Os05g26890),编码GTP结合蛋白。在scp1突变体和HZ中对这五个功能基因进行扩增和测序,发现scp1突变体中OsRGA1基因组序列开放阅读框第1 110 bp后完全缺失,通过qPCR检测,发现scp1突变体中OsRGA1基因完全不表达,从而导致功能完全丧失。而其他四个基因序列没有突变且表达水平也没有改变,表明scp1突变体的表型是由于OsRGA1基因突变所致。
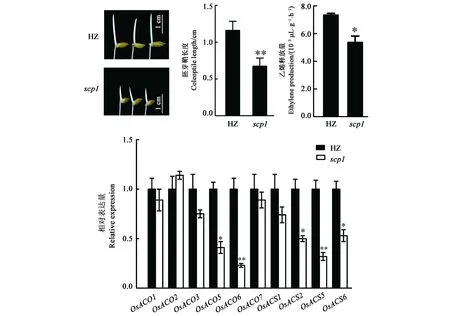
注:*和**分别代表与HZ相比在 P<0.05和 P<0.01水平具有统计学意义。Note: * and ** indicate statically significant difference compared to HZ at P<0.05 and P<0.01 levels, respectively.图1 SCP1调控胚芽鞘的生长及乙烯合成Fig.1 SCP1 regulates coleoptile growth and ethylene biosynthesis
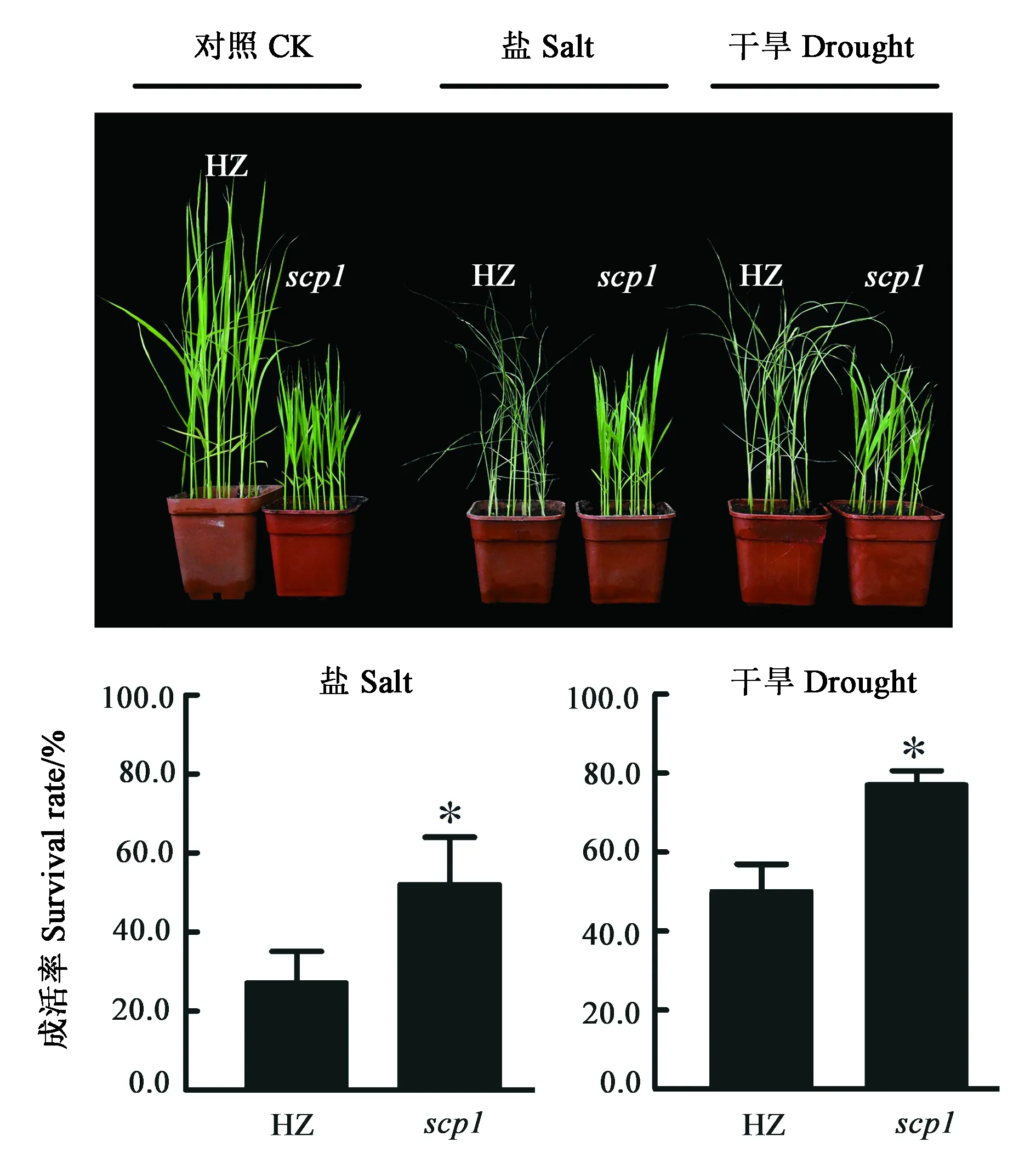
注:*代表与HZ相比在 P<0.05水平具有统计学意义。Note: * indicates statically significant difference compared to HZ at P<0.05 level.图3 HZ与scp1突变体盐和干旱胁迫表型和成活率Fig.3 Phenotype and survival rate of HZ and scp1 mutants under salt and drought stress
为了进一步验证该突变体是由OsRGA1基因突变引起的,对osrga1的另一个等位突变体d1进行观察,发现d1也表现出短胚芽鞘的表型,乙烯释放量测定结果表明,d1乙烯释放量显著低于野生型,与scp1突变体类似(图5)。以上结果表明,scp1突变体是osrga1的另一个等位突变体。
3 讨论
OsRGA1基因早已被克隆出来[26],到目前已陆续报道了至少8个点突变体或者片段插入突变体,例如等位突变体d1、dwarf89[27]及cha-2[28]中OsRGA1基因表达水平显著降低,且均表现出矮杆、粒小且圆等性状特征。本研究筛选到一个短胚芽鞘突变体,通过图位克隆发现OsRGA1基因组序列存在大片段缺失,导致scp1体内OsRGA1基因不表达(图4)。scp1表现出与osrga1突变体类似的株高、粒形等表型,说明scp1是osrga1的等位突变体。胚芽鞘在水稻破壳、出土[29]及逆境胁迫[30-31]应答过程中起着重要作用。本研究发现OsRGA1通过调控水稻乙烯生物合成来调控胚芽鞘的生长及苗期耐逆性,进一步丰富了OsRGA1在水稻中的功能,同时也为OsRGA1功能研究提供材料。

图4 SCP1基因的图位克隆Fig.4 Map-based cloning of the SCP1 gene

注:*代表与HZ相比在 P<0.05水平具有统计学意义。Note: * indicates statically significant difference compared to HZ at P<0.05 level.图5 d1胚芽鞘表型和乙烯释放量Fig.5 Coleoptile phenotype and ethylene production in d1 coleoptile
乙烯是一种重要的植物激素,从植物种子萌发到器官衰老的过程中都有重要作用,而且在植物应对生物和非生物胁迫中起着关键作用[10]。目前已有研究表明,OsRGA1参与赤霉素信号转导途径来调控节间伸长[32],并且在乙烯介导的缺氧信号传递过程中起调节作用[9],表明OsRGA1参与多种激素信号的转导过程。但是OsRGA1与乙烯合成之间的关系还不清楚。本研究结果显示,scp1突变体中乙烯合成基因的表达水平明显低于野生型,并且其乙烯释放量也显著低于野生型(图1),说明OsRGA1参与调控水稻乙烯的合成。该研究丰富了该基因在激素合成与信号传递过程中的角色,但是目前还未研究清楚该基因具体如何调控乙烯合成的,这将是下一步工作的重点。
盐和干旱是水稻可能面临的两大非生物胁迫[33]。从本研究可以看出,scp1突变体表现出更强的耐盐性和耐旱性(图3),这与已报到的d1突变体类似[4, 34]。同时scp1突变体中乙烯含量降低,表明SCP1可能通过调控乙烯合成来影响水稻的耐旱和耐盐性。但具体机制还有待深入研究。
综上所述,本研究克隆了一个与乙烯合成相关的突变体,表现出短胚芽鞘的表型。通过图位克隆确定该表型是由于基因LOC_Os05g26890(OsRGA1)突变所致。scp1突变体表现出矮化、小粒、耐盐性和耐旱性增强,说明该基因可能为育种专家权衡产量与耐逆性提供材料。同时scp1突变体的乙烯合成量减少,说明其可能参与了乙烯的合成调控途径,拓展了OsRGA1的功能。

