人类TBC1D7蛋白的表达纯化及其在mTOR通路中的作用机制研究
盖中朝, 王 兵
(1.陕西科技大学食品与生物工程学院, 西安 710021; 2.贵州医科大学生物与医学工程重点实验室, 贵阳 550025)
mTOR (mammalian Target of Rapamycin) 信号通路是真核生物细胞中控制分解代谢和合成代谢过程的关键通路之一,在细胞生长、增殖和死亡过程中发挥着至关重要的作用[1-3].在mTOR信号通路中,存在两种由mTOR蛋白组成的核心复合物:mTORC1 (mammalian target of rapamycin complex 1) 和mTORC2 (mammalian target of rapamycin complex 2),前者由mTOR, Raptor, mLST8, Deptor和PRAS40亚基组成,对雷帕霉素较为敏感;后者由mTOR, Rictor, mLST8, mSin1, Deptor和Proctor1/2亚基组成,对雷帕霉素不敏感[4-5].mTORC1主要控制生物大分子的合成代谢和分解代谢、细胞周期调控、细胞生长、细胞自噬等工程;mTORC2主要负责细胞骨架调配、细胞存活和部分细胞代谢过程.mTORC1和mTORC2在空间结构上较为近似,整个复合物以二聚体形式组成一个近似菱形的拟二重轴结构[6-7].
在mTOR信号通路中,TSC(Tuberous Sclerosis Complex)蛋白复合物位于mTORC1上游,且对后者具有负调控作用,TSC复合物由TSC1(Tuberous Sclerosis Complex 1)、TSC2(Tuberous Sclerosis Complex 2)和TBC1D7(TBC1 domain family member 7)三个亚基组成[4, 8].目前已知,TSC复合物与结节性硬化综合症有直接联系,该病多见于皮肤、脑、肾、心脏和肺组织,临床病理特征表现为面部皮脂腺瘤、癫痫发作和智能减退等[9-11].当前认为,结节性硬化症的发病原因主要是由于TSC1和TSC2两个肿瘤抑制基因发生突变所引起,二者所编码的TSC1、TSC2蛋白和TBC1D7蛋白形成一个稳定的TSC三亚基复合物.人类TBC1D7基因位于6号染色体上,全长TBC1D7蛋白包含293个氨基酸.有研究显示,TBC1D7基因的突变会导致智障和巨脑症的发生,一些偏头痛患者基因组样品中也存在TBC1D7基因的突变[12-13].
鉴于TBC1D7蛋白在mTOR通路和人类多种疾病中发挥着重要的调控功能,所以对其生物学功能的研究就显得尤为重要.本课题组前期研究发现,TBC1D7可以稳定结合TSC1蛋白C末端区域,促进后者发生二聚化并维持此二聚结构的稳定性[14].目前已知,TSC1与TSC2蛋白相互作用,通过TSC2蛋白C末端的Rap-GAP结构域来调控溶酶体膜表面Rheb蛋白的GTP/GDP结合状态,最终负调控mTORC1的活性[15-16].但是,TBC1D7在mTOR通路中所扮演的角色及其对下游mTORC1的调控形式,均需要进一步探索.本文以人类全长TBC1D7蛋白为研究对象,借助一系列分子生物学研究手段,通过一系列尝试和探索,获得了纯化的TBC1D7蛋白,并通过在人类心肌细胞系(HCM)中高表达和敲降TBC1D7基因的表达,分析了TBC1D7对mTORC1复合物活化的影响.研究结果显示,当人类心肌细胞细胞HCM高表达Flag-TBC1D7时,细胞内S6K1蛋白Thr389磷酸化程度降低,表明mTORC1活化程度降低,而当HCM细胞内TBC1D7表达被敲降时,检测发现胞内S6K1蛋白Thr389磷酸化升高,表明mTORC1活化程度提高.这一系列实验证实了TBC1D7对mTORC1的活性调控发挥了重要作用.
1 材料与方法
1.1 试剂与引物
PCR实验所使用的高保真DNA聚合酶(货号:AP221-02)购自天根生物工程有限公司;限制性内切酶NdeI(1161A)、XhoI(1094A)、HindIII(1094A)、BamHI(1094A)、EcoRI(1040A)以及T4 DNA连接酶(2011A)购自日本宝生物公司;质粒抽提试剂盒(GK2002-200)、PCR产物纯化以及胶回收试剂盒(GK2043-200)购自上海捷瑞生物工程有限公司;LB培养基(A507002)购自上海生工生物工程有限公司;Trizol试剂(10296010)购自Thermo公司;反转录试剂盒(KR116-02)和定量PCR试剂(FP215-02)均购自天根生物工程有限公司;凝血酶(605157)购自美国Sigma公司;GAPDH(ab181602)、S6K1(ab9366)、TBC1D7(ab234684)、pS6K1(Thr389)(ab60948)一抗以及Protein A Beads(ab193255)购自澳大利亚Abcam公司;引物及shRNA均由擎科生物工程有限公司合成,序列信息如表1所示.
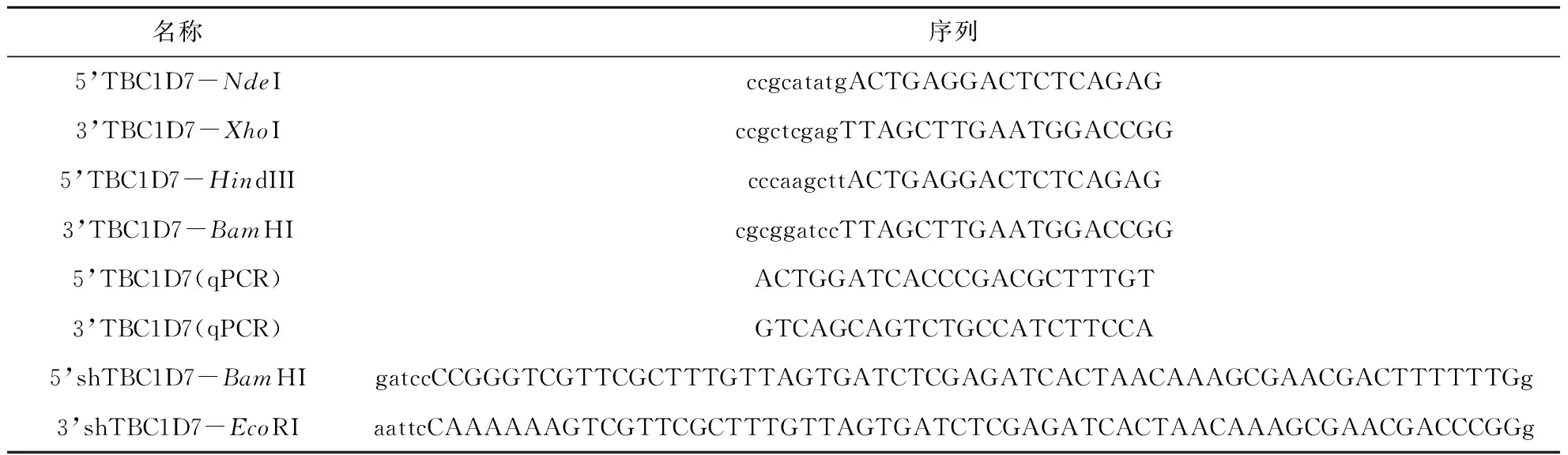
表1 本研究中所使用的引物及shRNA序列
注:小写字母部分为酶切位点序列
Notes: The lowercase parts are the sequence of digestion sites
1.2 菌株、细胞和质粒
克隆构建和原核表达所使用菌株为大肠杆菌EscherichiacoliTOP10菌株、EscherichiacoliBL21 (DE3);细胞实验所使用细胞为人心肌细胞系HCM;pET28a、pcDNA-Flag、pGreenPuro表达载体均为本实验室保藏.
1.3 序列保守性分析及进化树构建
从Uniprot数据库中分别下载人类(Homosapiens, Q9P0N9)、原鸡(Gallusgallus, A0A1L1RR07)、斑马鱼(Daniorerio, F1QRX7)、非洲爪蟾(Xenopuslaevis, F6UMY3)、家蚕(Bombyxmori, H9JMN1)、果蝇(Drosophilamelanogaster, Q9VCC4)以及粗壮厌氧真菌(Anaeromycesrobustus, A0A1Y1XIW3)的TBC1D7蛋白氨基酸序列,使用Clustal W 程序对其进行序列比对.
1.4 表达质粒的构建
以人类TBC1D7基因cDNA为模板,使用高保真DNA聚合酶对目的片段进行扩增,扩增完毕后通过琼脂糖凝胶电泳检测扩增结果,并切胶回收目的条带,将切回的包含目的条带的凝胶使用胶回收试剂盒进行溶胶和NDA回收,完毕后使用Nano-Drop设备检测回收产物浓度.将化学合成的TBC1D7 shRNA在PCR仪中退火,收集产物以待连入载体中.
使用限制性内切酶对回收的扩增产物以及pET28a、pcDNA-Flag、pGreenPuro空载体在37 ℃水浴条件下酶切过夜,酶切产物经琼脂糖凝胶电泳检测后再次进行纯化回收,随后使用Nano-Drop设备检测产物浓度后,按照目的片段和载体3∶1的摩尔比将二者混合,使用T4 DNA连接酶连接二者,连接反应在16 ℃条件下进行4 h.
连接完毕后,取10 μL连接产物,转化E.coliTOP10感受态细胞.经热激和冰浴后,将感受态细胞加入1 mL LB培养基中活化,随后离心附近菌体并将感受态细胞均匀涂布至卡那霉素抗性的LB平板中,37 ℃培养过夜.通过菌落PCR检测平板上的单克隆,并挑取阳性克隆进行摇管培养,14 h后提取质粒并将质粒送测序公司进行测序验证.测序正确的质粒样品可用于下一步研究.
1.5 蛋白的原核表达
将构建完成的pET28a-TBC1D7质粒热激转 化E.coliBL21感受态细胞.第二天挑取单菌落接种至50 mL LB培养基中进行活化培养,当菌液浓度达到A600=0.8~1.0时,再将菌液扩大培养至2 L LB培养基中. 当扩大培养的菌液浓度达到A600=0.8时,将培养温度降至16度并加入终浓度为0.2 mmol·L-1IPTG进行诱导.在16 ℃条件下继续培养16 h,随后离心收集所培养的菌体,并使用Ni柱平衡液(25 mmol·L-1Tris-HCl pH 8.0, 300 mmol·L-1NaCl, 20 mmol·L-1咪唑)进行重悬.
1.6 Ni2+-NTA亲和层析
使用高压细胞均质仪,在4 ℃条件下,以100 Mpa的压力下进行破壁.反复破壁3次后,将菌液在4 ℃,20 000 g条件下离心40 min,以去除不溶物.在离心的同时,使用预冷的Ni柱平衡液平衡Ni2+-NTA重力柱,离心完毕后立即将上清取出,加入Ni柱中,反复结合2遍后使用Ni柱平衡液冲洗5倍柱体积,随后分别以60 mmol·L-1、200 mmol·L-1、500 mmol·L-1咪唑洗脱液进行梯度洗脱,各浓度洗脱10 mL.根据 Bradford 法测定蛋白质含量,并使用12%浓度SDS-PAGE跑胶检测蛋白纯化情况.
1.7 凝血酶酶切去除组氨酸标签
取纯化的His-TBC1D7蛋白,使用5 kDa孔径的透析袋在4 ℃条件下对其进行透析,透析缓冲液为PBS.透析12 h后,取出His-TBC1D7蛋白,根据 Bradford 法测定蛋白质含量并按照凝血酶单位数与蛋白毫克数为2∶1的比例加入凝血酶,继续在4 ℃条件下酶切12 h.酶切完毕后,将酶切产物跑12% SDS-PAGE检测酶切是否完全,若残存有部分His-TBC1D7,可以将酶切产物再次挂Ni2+-NTA层析柱,反复挂两边并收集流出液,通过此步骤去除存留的His-TBC1D7蛋白.使用Bradford法再次测蛋白产物浓度.
1.8 凝胶排阻层析
将去除标签后的TBC1D7蛋白使用10 kDa截留孔径的超滤浓缩管,在4 ℃,4 000 g条件下进行离心浓缩,直至总体积小于2 mL.随后使用AKTA 蛋白液相层析系统(GE)结合Superdex200凝胶排阻层析柱(GE),进行层析分离.收集洗脱峰,跑SDS-PAGE胶检测并将蛋白浓缩保存,最终获得在溶液中状态均一的TBC1D7蛋白.
1.9 细胞培养及转染
HCM细胞使用添加了10%胎牛血清的RPMI1640培养基,在37℃,5% CO2培养箱中静置培养,每2~3 d传代一次.细胞转染使用Lipo3000试剂,每6 cm培养皿使用15 μL转染试剂以及10 μg质粒(总量),转染完毕5 h后换入新鲜培养基,继续培养24或48 h,收集细胞进行下一步实验.
1.10 定量PCR
将细胞使用Trizol试剂提取总RNA,完毕后使用Nano-Drop设备测产物浓度.将总RNA使用反转录试剂盒进行反转录,参照实际说明书进行,反转录产物再次测量浓度后分装备用.使用反转录cDNA进行定量PCR扩增,使用2×SYBR qPCR mix试剂,设置20 μL扩增体系.使用BioRad CFX96 定量PCR仪进行扩增和数据读取.扩增数据处理使用2-ΔΔCT方法进行处理分析,实验重复3次.
1.11 免疫沉淀及免疫印迹
使用含0.1% BSA的细胞裂解液稀释Flag抗体,将50 μL Protein A Beads加入1 mL抗体稀释液,在4 ℃条件下孵育结合2 h.孵育完毕后将Beads清洗5遍.随后加入裂解后的组织总蛋白,在4 ℃条件下旋转孵育过夜,离心后收集Beads.使用细胞裂解液清洗5遍后,将Beads使用1×Loading buffer 煮沸,离心收集上清备用.
将免疫沉淀获取样品使用10% SDS-PAGE电泳分离,完毕后将PAGE胶在200 mA横流条件下湿转75 min,于低温条件下进行.转膜完毕后使用含5%脱脂奶粉的TBS-Tween溶液进行封闭,随后一抗4 ℃孵育过夜,洗膜3次后再次以HRP二抗室温孵育60 min,完毕后洗膜3次并使用ECL药水进行化学发光检测.
1.12 蛋白质三维结构分析
从PDB数据库(https://www.rcsb.org)中下载TBC1D7结构数据(PDB id: 4Z6Y),使用PyMOL软件(版本:1.7)对TBC1D7分子进行静电势和保守性分析及显示[17-18].
2 结果与分析
2.1 氨基酸序列保守性分析
人类TBC1D7蛋白包含293个氨基酸,从功能方面而言,该蛋白具有TBC1结构域(第50~231位氨基酸区域),具有Rab-GAP活性,可以直接激活Rab蛋白的GTPase活性[19].该功能在进化上较为保守,多物种来源的TBC1D7序列相似性较高,其在物种进化过程中保持高度的保守性,尤其是其N端结构域(图 1).一般而言,在进化上保持高度保守的蛋白在生命活动中大多扮演着重要角色,这也在一定程度上可以解释为何TBC1D7基因突变与人类多种疾病有关.

图1 多物种来源TBC1D7蛋白氨基酸序列比对Fig.1 Sequence alignment of TBC1D7 from different species
2.2 人类TBC1D7蛋白分子表面残基保守性及电势能分析
在得到TBC1D7蛋白氨基酸序列保守性结果后,进一步分析了人类TBC1D7蛋白三维结构信息,计算了蛋白分子表面电势能以及表面残基保守性.
结果显示,人类TBC1D7蛋白空间结构近似“半月形”,表面均匀分布了正负电荷,疏水区较少.进一步的表面保守性显示,人类TBC1D7蛋白表面保守残基较为集中,主要位于“半月形”结构的背部,该结果说明有潜在的相互作用蛋白与TBC1D7在该区域结合(图2).
2.3 TBC1D7的克隆与表达
目前用于蛋白表达的系统有使用较多的有大肠杆菌表达系统、昆虫细胞表达系统和哺乳动物细胞表达系统,相比较而言,三者中大肠杆菌表达系
A) 人类TBC1D7蛋白三维结构表面静电势,蓝色为正电区,红色为负电区,灰色为疏水中性区域;B) 人类TBC1D7蛋白三维结构表面残基保守性分析,青色区域为非保守氨基酸区域,灰色为中度保守区,紫红色区域为高度保守区A) Electrostatic potential of TBC1D7: blue regions represents positive, and red regions represents negative; B) Surface conversation of human TBC1D7: cyan region represents variable residues and purple means conversed residues图2 人类TBC1D7蛋白分子表面残基保守性及电势能分析Fig.2 Electrostatic potential and surface conversation of human TBC1D7
统最为经济、快捷,可以用于多种原核和真核生物来源基因的高效表达.pET28a质粒是一种较为常用和高效的原核表达载体,在N 端和C 端各有一个6×His标签,在His标签之后存在thrombin酶切位点,载体启动子为T7启动子, 目的基因被克隆到质粒载体上,受噬菌体强转录及翻译信号控制,并且目的蛋白的表达将被T7终止子所终止蛋白翻译,蛋白质的表达可由IPTG诱导.
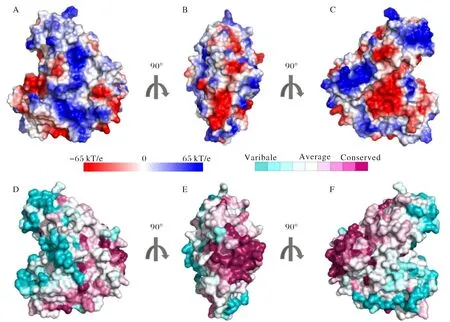
全长TBC1D7基因包括882 bp,通过酶切位点分析后选择了NdeI和XhoI两个限制性酶切位点,通过引物合成和后续的PCR过程,将其连在了目的片段的两端.将目的片段和pET28a载体分别通过酶切和回收,随后完成连接、转化和表达鉴定过程(图3A、3B).
由于采用了低温诱导的策略来表达目的蛋白,所以得到的蛋白大多为可溶蛋白,通过高压破碎细胞壁后,蛋白从菌体内部释放出来.由于TBC1D7蛋白融合表达His标签,根据组氨酸与Ni2+离子特异性吸附的特点,使用Ni2+-NTA柱来纯化目的蛋白.将破壁离心后的菌液反复挂柱数次,随即使用平衡液冲洗除杂.最终,通过60 mmol·L-1、200 mmol·L-1和500 mmol·L-1咪唑溶液梯度洗脱,收集洗脱样品.由于His-TBC1D7蛋白的理论分子量约为36 kDa,所以为了方便清楚地鉴定蛋白纯化结果,使用12% SDS-PAGE凝胶来分离目的蛋白,发现在200 mmol·L-1咪唑浓度条件下,大部分蛋白可以被洗脱下来,并且纯度较高(图3C).
2.4 TBC1D7蛋白的纯化
在亲和层析完毕后,得到了在N端融合有His标签的TBC1D7蛋白.考虑到His标签可能会对后续蛋白功能研究存在影响,需要去除TBC1D7蛋白N端融合的His标签.由于pET28a载体在His标签与目的蛋白之间存在一个凝血酶酶切位点(Leu-Val-Pro-Arg-Gly-Ser)编码序列,所以该载体表达的蛋白也存在着该酶切位点.
由于通过Ni2+亲和层析所得到蛋白融合中存在这较高浓度的咪唑,而高浓度的咪唑比例与酶切的进行,所以通过透析的手段去除了蛋白溶液中所含的高浓度咪唑.随后通过使用凝血酶将His标签与TBC1D7蛋白切开,并通过进一步的凝胶排阻层析手段来最终得到纯化的TBC1D7蛋白.根据Superdex200凝胶排阻层析柱标准品洗脱相对分子量公式计算,发现TBC1D7蛋白的表观相对分子量为38 k, 非常接近理论分子量36 k,由此推断,TBC1D7蛋白在溶液中以单体形式存在.层析完毕后,收集最终的洗脱蛋白并通过Bradford方法测蛋白浓度,发现通过该策略最终每升大肠杆菌菌液可以获得12 mg纯化的TBC1D7蛋白(图4A、B).
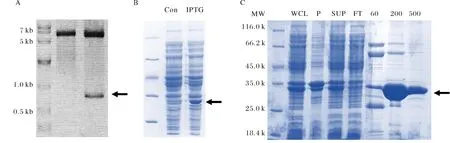
图3 TBC1D7的克隆与表达A) 双酶切方法验证所构建的表达质粒,左侧泳道为空载体酶切产物,箭头所指为目的片段;B)转化后大肠杆菌表达检测;C)Ni2+亲和层析纯化His-TBC1D7融合蛋白;WCL:全细胞裂解液;P:沉淀;SUP:上清;FT:流穿液;60、200、500分别为 60,200,500 mmol/L 咪唑缓冲液洗脱的蛋白组分Fig.3 Clone and expression of TBC1D7A)Double digestion of constructions;B)Expression of transformed E.coli;C)Purification of His tagged TBC1D7 protein through Ni2+ affinity chromatography; WCL:Whole cell lysate;P: Pellet;SUP:Supernatant;FT:Flow through;60、200、500: 60,200,500 mmol·L-1 imidazole buffer elution
A) TBC1D7蛋白经Superdex200凝胶排阻层析柱洗脱峰形图;B) 12% SDS-PAGE 检测A图中的各洗脱组分A) Elution curve of SEC; B) Elution fractions dissolved in 12% SDS-PAGE图4 凝胶排阻层析纯化TBC1D7蛋白Fig.4 Purification of TBC1D7 through Size exclusion chromatography
2.5 TBC1D7的过表达和敲降
首先我们构建了过表达质粒:pcDNA-Flag-TBC1D7和敲降质粒:pGreenPuro-shTBC1D7,并将构建的质粒转染HCM细胞,分别于0 h(对照)、24 h和48 h收集细胞,提取总RNA并反转录.定量PCR实验对检测基因高表达和敲降水平,对扩增结果进行t-test分析,结果证实所构建的TBC1D7过表达(图5A)和敲降(图5B)质粒均可有效地发挥作用,在转染后24 h即可显著上调或下调TBC1D7的表达.
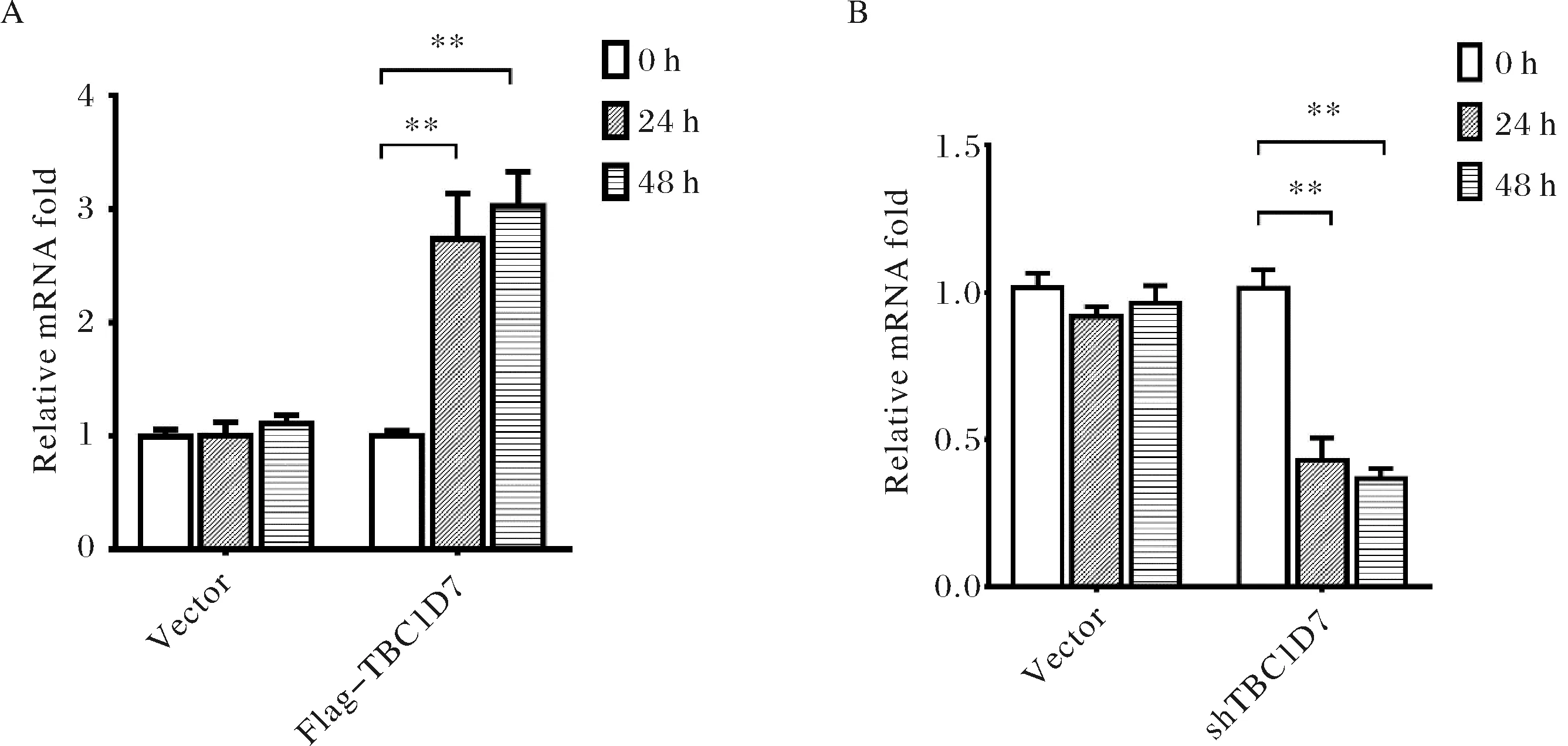
A) TBC1D7的过表达检测;B) TBC1D7的敲降检测.图中**表示p<0.01A) Overexpression of TBC1D7. B) Knock-down of TBC1D7. ** indicates p<0.01.图5 定量PCR检测TBC1D7的过表达和敲降Fig.5 Up-and down-regulation of TBC1D7 measured by qPCR

A) WB检测TBC1D7表达水平的改变对mTORC1下游S6K1磷酸化的影响;图B)与C),WB条带的相对灰度比例A) The phosphorylation level of S6K1(Thr389) that affected by up-and down-regulation of TBC1D7; B) and C) Quantitative of the gray scale of western blot bands in A图6 TBC1D7表达水平的改变对mTORC1活性的影响Fig.6 The activity change of mTORC1 that affected by TBC1D7
2.6 TBC1D7表达水平的改变对mTORC1活性的影响
目前已知TBC1D7是TSC复合物的重要组成部分,然而TBC1D7在人类心肌细胞中对mTOR信号通路的影响尚有待确定[8].本研究中,以人心肌细胞系HCM为研究对象,通过高表达和敲降TBC1D7来改变胞内TBC1D7的表达水平,检测mTOR信号通路中mTORC1复合物活化水平标志物:S6K1蛋白Thr389残基的磷酸化情况,以确定TBC1D7的表达对mTORC1活化水平的影响.实验结果显示,当在HCM细胞中高表达TBC1D7时,胞内S6K1蛋白Thr389磷酸化程度降低,表明mTORC1活性受到抑制,而当HCM细胞内TBC1D7被敲降时,胞内S6K1蛋白Thr389磷酸化升高,表明mTORC1活化程度提高(图6).这一系列实验证实了在人心肌细胞中TBC1D7对mTORC1的活性调控发挥了重要的负调控作用.
2.7 TBC1D7与mTOR信号通路蛋白质作用网络分析
为进一步深入了解TBC1D7在mTOR信号通路中的作用和功能,从String数据库下载并分析了人类TBC1D7蛋白的相互作用网络[20].图中绿色节点(Nodes),如TSC1,TSC2,AKT1等代表TBC1D7的第一层(Fist shell)相互作用蛋白,在功能上具有非常紧密的联系(图7).除此之外,TBC1D7的相互作用网络中包含诸如mTOR,Rheb, EIF4EBP1, MAPK, GSK3B等mTOR信
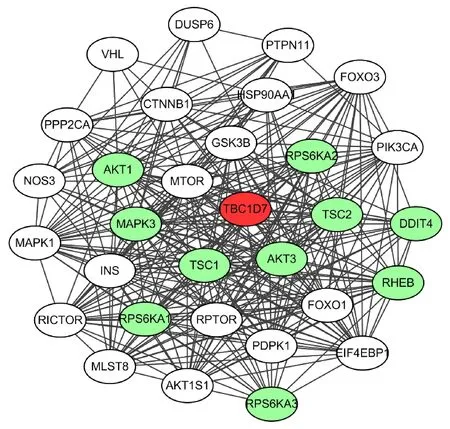
图7 TBC1D7与mTOR信号通路蛋白相互作用网络Fig.7 Protein-protein network of TBC1D7 and mTOR signaling pathway
号通路关键蛋白.由此可见,TBC1D7蛋白在mTOR信号通路中发挥了重要的调控作用.
3 讨论
作为真核细胞内调节细胞代谢的关键途径,当mTOR通路中某个或某些蛋白发能功能受损时,真核生物机体则产生对应的病理性变化.对于人类而言,目前已在包括直肠癌、胃癌、乳腺癌和前列腺癌等恶性肿瘤疾病中发现mTOR蛋白的功能性突变[21-23];TSC1/TSC2的突变致使其对下游mTORC1复合物抑制作用减弱,导致结节性硬化症的发病[9];此外,mTOR信号通路异常也被认为与阿尔茨海默症和昆廷顿舞蹈病等神经退行性疾病的发病相关[24-26].正因为其在真核生物体内发挥着极其关键的作用,mTOR信号通路从20世纪90年代初被发现至今仍在世界范围内被诸多实验室深入研究,但截止当前,依然有许多未知之处等待深入研究.
除了已知的TSC1/2蛋白,真核细胞内还存在着其它效应蛋白可以介导TBC1D7蛋白的功能发挥.有研究人员发现果蝇体内TBC1D7蛋白可以通过胰岛素信号来调控机体生长,而这一过程不依赖TSC1/2[27].本研究中,蛋白相互作用网络显示AKT1和AKT3均与TBC1D7存在相互作用,有相关研究证实AKT可以磷酸化TBC1D7蛋白第124位丝氨酸(Ser),通过磷酸化来调控后者与14-3-3ζ及β-TrCP2的相互作用,而14-3-3ζ又可通过与mTORC1复合物中Raptor亚基相互作用来抑制复合物的激酶活性[28-29].
作为mTOR信号通路的重要一员,TBC1D7蛋白与TSC1、TSC2形成三元复合物,以复合物形式发挥功能,此TSC复合物的功能异常可导致结节性硬化的发病.结节性硬化通常会导致心脏组织发生病变,心脏横纹肌瘤(cardiac rhabdomyoma)是结节性硬化症常见的临床表现之一,此症状常在胎儿时期出现,严重影响了胎儿的正常发育[30-31].对TSC复合物的作用机理进行研究可进一步了解结节性硬化的发病,并促进新型诊疗手段的出现.虽然目前尚未在结节性硬化症患者中发现有TBC1D7基因突变的情况,但是目前已知TBC1D7基因的突变却可以导致其他一些神经系统疾病,例如巨头症、智障、视神经萎缩等[12,32].此外,有研究者发现,相较于野生型小鼠,糖尿病模型小鼠心脏组织中TBC1D7蛋白表达显著下调,进一步的相互作用网络分析显示TBC1D7作为一个潜在的调节因子参与至糖尿病性心肌病的调控之中[33].因此,对TBC1D7蛋白的生物学功能研究就显得尤为重要.本研究建立了一种简单有效的人类TBC1D7蛋白的表达纯化策略,并研究了在人类心肌细胞中TBC1D7的表达与其下游mTOR信号通路之间的联系,发现TBC1D7蛋白可负调控下游mTORC1复合物激酶活性,并与mTOR信号通路蛋白网络存在紧密联系.本研究为人类TBC1D7蛋白和mTOR信号通路的进一步研究打下了良好基础.

