基于倾向性评分匹配法筛选高尿酸血症的差异核心菌群
纪泽敏 牟菲 陈姝琴 赵焕虎
中央民族大学药学院,民族医药教育部重点实验室(中央民族大学)(北京100081)
高尿酸血症(hyperuricemia,HUA)是由嘌呤代谢异常引起的代谢性疾病,主要是由于尿酸产生过多或者排泄减少。HUA 患病率与遗传、性别、年龄、生活方式、饮食习惯、药物治疗和经济发展程度等因素显著相关,已成为仅次于糖尿病的第二大代谢性疾病[1]。肠道微生物在代谢性疾病中起到关键作用,如痛风[2]、糖尿病[3]、肥胖症[4]等。肠道微生物与代谢性疾病之间的密切关联,为治疗HUA 提供了新思路。目前,关于HUA 病理学和生理学机制的研究比较深入,但肠道菌群与HUA 之间作用关系及其机制的研究较少。本研究对HUA 患者和非HUA 志愿者的肠道菌群进行高通量测序分析,利用倾向性评分匹配法筛选样本,降低混杂因素对实验的干扰,分析肠道菌群的物种组成,筛选差异核心菌群并进行功能预测。
1 材料与方法
1.1 样本来源本研究获得了中央民族大学伦理委员会批准。受试者来自中央民族大学校医院教职工慢性病体检和大肠癌筛查项目,均签署书面知情同意书。受试者均无精神病史,无滥用药物且1个月内无服用过抗生素。
1.2 粪便样本采集与DNA 提取使用粪便收集器进行粪便采集,每管样品300 mg,共133个样品。储存于-80℃,直至DNA 提取。肠道细菌总DNA提取按照PowerSoil®DNA Isolation Kit 使 用 说明进行操作。
1.3 16 S rDNA 扩增与高通量测序16S rDNA的V3-V4区PCR扩增的上游引物为308F(5′-ACTCCTACGGGAGGCAGCA-3′),下游引物为806R(5′- GGACTACHVGGGTWTCTAAT-3′)。反应体系(50 μL)为:10 μL buffer,0.2 μL Q5 High-Fidelity DNA Polymerase,10 μL High GC Enhancer,10 μmol/L上游引物,10 μmol/L下游引物,1 μL dNTPs,60 ng genomic DNA,ddH2O 补充至总体系50 μL。反应程序为:95℃预变性5 min,95℃变性1 min,退火时间为30s,退火温度从95℃到50℃,50℃退火1 min,72℃延伸1 min,共15个循环,最后72℃延伸7 min。扩增产物使用AMPure XP 磁珠纯化,目标区域PCR 纯化产物进行二次PCR 扩增,最终的PCR 产物进行磁珠纯化、Nanodrop 2000定量,琼脂糖凝胶(1.8%)电泳切胶回收,质量合格的文 库 用Illumina HiSeq 2500(2 × 250 paired ends)进行测序。
1.4 数据处理测序得到的原始数据以FASTQ文件格式储存。使用Vsearch(vesion 2.8.0)对FASTQ 文件去除引物、去除嵌合体和聚类分析(identity 参数设为97%),生成各样本操作分类单元(Operational Taxonomic Units,OTU)。每个OTU代表序列比对Silva 参考数据库(Silva 123)[5]得到分类信息。功能预测分析由QIIME[6]和PICRUSTs[7]共同完成。预测的功能主要包括Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库中的基因。研究中的绘图主要在QIIME和R 平台上完成。
1.5 统计学方法运用SPSS 25对HUA 组与对照组除尿酸以外的年龄、性别、舒张压、收缩压等临床指标进行倾向性评分匹配(propensity score matching,PSM),挑选性别相同的配对样本分为HUA 组和对照组;运用R edgeR 包筛选差异菌群,P值<0.05,|log2foldchange| >2 则认为差异有统计学意义。R bnlearn 包用于差异菌群的贝叶斯网络推断,Cytoscape软件绘制贝叶斯网络图;运用STAMP软件对组间菌群功能进行差异分析,Welch′s t-test 分析两组间的差异,P<0.05 被认为差异有统计学意义。
2 结果
2.1 组间临床信息与倾向性评分匹配共采集133名志愿者的粪便样品,其中HUA 组有40名,对照组有93名。PSM 前,性别、肌酐、甘油三酯、血尿素氮和尿酸等指标在两组间差异有统计学意义。成功匹配24对样本。PSM后,除尿酸(t=-7.805,P <0.001)外,其他指标均无统计学意义(表1)。
表1 48例样本临床资料统计Tab.1 Clinical information of 48 samples ±s

表1 48例样本临床资料统计Tab.1 Clinical information of 48 samples ±s
注:*P <0.05;**P <0.01
特征描述性别男女年龄(岁)舒张压(mmHg)收缩压(mmHg)葡萄糖体质量指数腰臀比谷丙转氨酶胆固醇肌酐高密度脂蛋白甘油三酯低密度脂蛋白血尿素氮尿酸同型半胱氨酸对照组3 21 69.79±8.62 78.67±10.3 131.42±16.82 5.9±1.17 25.57±3.4 0.86±0.07 26.5±17.67 5.22±1.09 68.63±13.98 1.4±0.29 2.18±1.27 3.29±0.88 5.15±1.28 293.67±50.38 13.14±3.23高尿酸血症组3 21 70.88±9.84 78.46±10.54 140.38±18.2 6.3±1.22 25.2±2.59 0.86±0.07 22.42±9.8 5.15±1.26 74.5±16.6 1.4±0.35 1.92±0.84 3.23±0.99 5.8±1.45 416.38±58.26 14.23±4.82统计量χ2 =0 t=-0.406 t=0.069 t=-1.771 t=-1.166 t=0.427 t=0.348 t=0.99 t=0.205 t=-1.326 t=0.009 t=0.835 t=0.224 t=-1.631 t=-7.805 t=-0.923 P 值1 0.687 0.945 0.083 0.25 0.671 0.729 0.327 0.838 0.191 0.993 0.408 0.823 0.11 0.000** 0.361
2.2 测序数据与评估经过数据过滤,共获得6 540 093条reads,平均每个样本含有136 251.938条reads。Chao1及shannon多样性稀释曲线(图1)表明各个样本的测序数据深度都已足够,数据可用于后续分析。
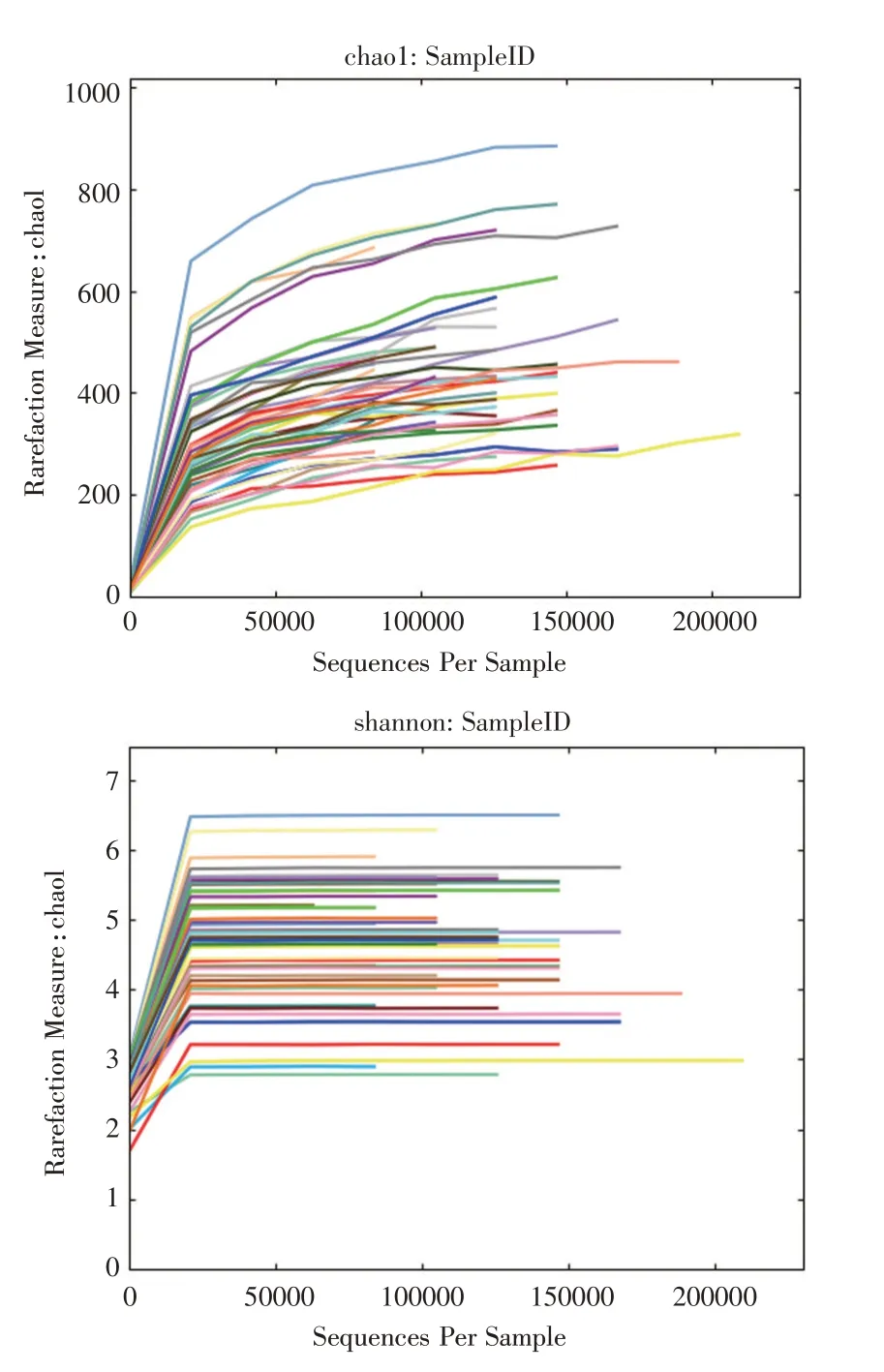
图1 Chao1及shannon多样性稀释曲线Fig.1 Chao1 diversity index curves and Shannon diversity index curves for the sequenced sample
2.3 肠道菌群的物种组成分析本研究分别从门、纲、目、科、属水平上对菌群进行鉴定和分析,共鉴定24个门,319个属。门水平上(图2A),HUA组中Proteobacteria(13.6%vs.10.5%)、Actinobacteria(6.2%vs.3.5%)高于对照组,Firmicutes(50.5%vs.54.5%)、Bacteroidetes(28.4%vs.30.9%)低于对照组。属水平上(图2B),平均相对丰度>2%的优势属中,HUA 组中的Bacteroides(25.5%vs.19.7%)、Escherichia/Shigella(8.9%vs.5.6%)、Clostridium Xl-Va(5.9%vs.1.4%)、Bifidobacterium(4.9%vs.2.5%)、Megasphaera(2.6%vs.1.1%)、Gemmiger(2.3%vs.1.6%)含量高于对照组,Faecalibacterium(8.8%vs.8.9% )、Lachnospiracea_incertae_sedis(5.8%vs.8.1%)、Roseburia(5.7%vs.7.4%)、Prevotella(0.5%vs.7.8%)、Klebsiella(1.8%vs.2.9%)、Blautia(1.7%vs.2.2%)低于对照组。
2.4 菌群多样性分析α多样性分析显示,HUA组的物种多样性低于对照组但差异无统计学意义(chao1指数:P=0.2,Shannon指数:P=0.16)(图3A-B)。基于Unweighted Unifrac 距离和Weighted Unifrac距离的主成分坐标分析(图3C-D)未发现明显的聚类。adonis检验显示,无论基于哪种算法,组间差异均无统计学意义(Unweighted Unifrac:R2= 0.02,P=0.52;Weighted Unifrac:R2=0.01,P=0.89)。
2.5 高尿酸血症的差异核心菌群分析虽然α和β多样性分析显示HUA 组和对照组样本肠道菌群的主要构成没有明显差异,但在属水平上的差异分析,找到23个差异OTU(图4A)。根据物种注释信息,组间差异菌群共有19个,在对照组高表达的有13个,分别为Coprococcus、Barnesiella、Clostridium IV、Anaerostipes、Dialister、Lachnospiracea_incertae_sedis、Eubacterium、Veillonella、Bacteroides、Rose-buria、Haemophilus、Alistipes和Klebsiella,在HUA 组高表达的有6个,分别是Flavonifractor、Acetanaerobacterium、Anaerovorax、Bilophila、Acidaminobacter、Anaerotruncus。

图2 组间菌群门(A)、属(B)水平相对丰度柱状图Fig.2 Bar plots of the relative abundances of gut microbiota at phylum(A)and genus(B)level
差异OTU的贝叶斯网络关系图(图4B)显示,与是否患有HUA 直接相关的是差异核心菌群是Flavonifractor(OTU_2403)、Acidaminobacter(OTU_2409)、Bilophila(OTU_6)。
2.6 高尿酸血症患者与对照组肠道菌群功能比较对差异核心菌群进行功能预测分析,在KO2水平上共鉴定到37个KEGG 通路,其中Signal Transductiona 通路在HUA 组高于对照组,差异并有统计学意义(P=0.021)。在KO3水平上共鉴定到200个KEGG 通路,HUA 患者肠道菌群中双组分系
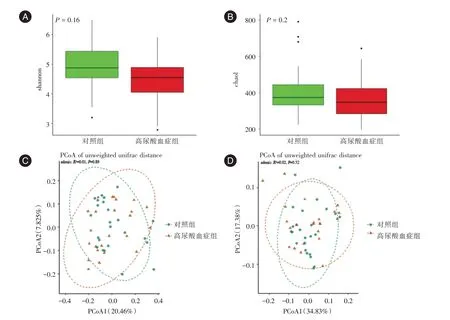
图3 组间多样性指数比较Fig.3 Comparison of α-diversity indexes[chao1(A);shannon(B)]and β-diversity indexes[Unweighted Unifrac distance(C);Weighted Unifrac distance(D)]between two groups

图4 差异分析可视化火山图和差异菌群贝叶斯网络图Fig.4 Volcano plot(A)and Bayesian network(B)of differential gut microbiota
注:A,α多样性分析(chao1 指数);B,α多样性分析(Shannon 指数);C,β多样性分析(Unweighted Unifrac 距离);D,β多样性分析(Weighted Unifrac 距离)统(Two-component system)(P= 0.020)、光合生物中的碳固定(Carbon fixation in photosynthetic organisms)(P= 0.025)、糖酵解/糖异生(Glycolysis/Gluconeogenesis)(P= 0.028)、果糖和甘露糖代谢(Fructose and mannose metabolism)(P=0.042)等通路高于对照组,差异并有统计学意义(图5)。

图5 组间功能预测比较分析Fig.5 Comparison of functional predictions between two groups
3 讨论
高尿酸血症是一种复杂的代谢性疾病,与痛风、高血压、糖尿病、肾病等疾病的发生发展密切相关[8-10],其对老年人的危害是不可忽视的问题。人体胃肠道定植了数万亿个微生物,肠道微生物失调与许多代谢性疾病有关[11]。为了探索肠道菌群与HUA 之间的相关性,本研究对HUA 患者和非HUA 人群的肠道菌群进行差异分析及功能预测。
肠道菌群的差异分析和贝叶斯网络推断分析结果显示,Flavonifractor、Acidaminobacter、Bilophila含量与HUA的直接相关且在HUA 组中含量较高。研究发现,Bilophila Wadsworthia与伴有Oddi 松弛括约肌的胆管结石病、肥胖、早期小儿多发性硬化症[12-14]有关。B. wadsworthia能引起SPF 小鼠的全身炎症反应[15],与高脂肪饮食协同作用可以促进更严重的炎症反应、肠屏障功能障碍、胆汁酸代谢障碍以及更严重的葡萄糖代谢障碍[16]。其中,肠屏障功能障碍能增加肠道对细菌内毒素(如LPS)的渗透性,并反过来增加粘膜炎症并导致全身性炎症。Flavonifractor是属于梭菌属(Clostridiales)的厌氧革兰阳性杆菌。Flavonifractor的富集与自身免疫性疾病系统性红斑狼疮有关[17]。Flavonifractor plautii也可能是胆囊炎[18]和小儿炎性肠病的潜在病原体[19]。体外实验证实,与IgG 高度结合的F. plautii和人体细胞培养物接触时能表现出侵袭能力并诱导促炎性免疫应答[19]。痛风的急性症状由对尿酸单钠结晶的炎症反应引发,主要由巨噬细胞和中性粒细胞介导,先天免疫途径在痛风的发病机制中是至关重要的,并且饮食会影响高尿酸血症以及痛风中巨噬细胞的炎症状态[19]。Flavonifractor对HUA的影响可能与机体免疫或促进炎症的发生有关。Acidaminobacter是蛋白质发酵菌属,发酵氨基酸特别是谷氨酸,乙酸是主要的代谢产物。目前Acidaminobacter与疾病相关性尚未见研究报道。
功能预测结果显示,双组分系统在HUA 组中上调,双组分系统通常使细胞能够通过诱导转录的变化来感知和响应刺激。糖酵解/糖异生、果糖和甘露糖代谢属于碳水化合物代谢途径,光合生物中的碳固定属于能量代谢途径,其在HUA 组均上调,这与YU[20]等的研究发现在碳水化合物和能量代谢途径在高尿酸血症小鼠中上调的结果一致。
本研究分析高尿酸血症患者与非高尿酸血症人群的肠道差异菌群,发现Flavonifractor、Acidaminobacter、Bilophila与HUA 紧密相关,其丰度变化在高尿酸血症的发生和发展过程中可能有重要作用。本研究中筛选出的菌属对高尿酸血症的影响还需要进一步的实验进行验证。综上所述,本研究为后续基于肠道菌群的高尿酸血症研究提供参考。

